Jun
23
De Max Planck y otros
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Física Cuántica ~
Clasificado en Física Cuántica ~
 Comments (0)
Comments (0)
 Siempre me llamó la atención y se ganó mi admiración el físico alemán Max Planck (1858-1947), responsable, entre otros muchos logros, de la ley de radiación de Planck que, de la distribución de energía radiada por un cuerpo negro. Introdujo en Física el concepto novedoso de que la energía es una cantidad que es radiada por un cuerpo en pequeños paquetes discretos, en vez de una emisión continua.
Siempre me llamó la atención y se ganó mi admiración el físico alemán Max Planck (1858-1947), responsable, entre otros muchos logros, de la ley de radiación de Planck que, de la distribución de energía radiada por un cuerpo negro. Introdujo en Física el concepto novedoso de que la energía es una cantidad que es radiada por un cuerpo en pequeños paquetes discretos, en vez de una emisión continua.
Estos pequeños paquetes se conocieron como cuantos y la ley formulada es la base de la teoría cuántica.
Einstein se inspiró en este trabajo para a su vez, presentar el suyo propio sobre el efecto fotoeléctrico donde la energía máxima cinética del fotoelectrón, Em está dada por la ecuación que lleva su nombre: Em = hf – Φ
Planck publicó en 1.900, un artículo sobre la radiación de cuerpo negro que, sentó las bases para la teoría de la mecánica cuántica que más tarde desarrollaron otros, como el mismo Einstein, Heisemberg, Schrördinger, Dirac, Feynman, y otros.
Todos los físicos son conocedores de la enorme contribución que Max Planck hizo en física: la constante de Planck, radiación de Planck, longitud de Planck, unidades de Planck, etc. Es posible que sea el físico de la historia que más veces ha dado su nombre a conceptos de la física.
Pongamos un par de ejemplos de su ingenio:
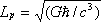 vale 10-35 metros
vale 10-35 metros
Esta escala de longitud (veinte (20) ordenes de magnitud menor que el tamaño del protón 10-15 m.) es a la que la descripción clásica de la gravedad cesa de ser válida y deber ser tenida en cuenta la mecánica cuántica.
En la formula que la describe, G es la constante gravitacional, ħ es la constante de Planck racionalizada y c es la velocidad de la luz.
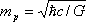 Masa de Planck
Masa de Planck
Es la masa de una partícula cuya longitud de onda Compton es igual a la longitud de Planck. Está dada por la ecuación 2), donde ħ es la constante de Planck racionalizada, c es la velocidad de la luz y G es la constante gravitacional (los mismos términos de la ecuación 1), pero intercambiándolos de manera que tienen otro significado).
La descripción de una partícula elemental de esta masa, o partículas que interaccionan con energías por partículas equivalentes a ella (a través de E=mc2), requiere una teoría cuántica de la gravedad. Como la masa de Planck es del orden de 10-8 Kg (equivalente a una energía de 1019 GeV) y, por ejemplo, la masa del protón es del orden de 10-27 kg y las mayores energías alcanzables en los aceleradores de partículas actuales son del orden de 103 GeV, los efectos de gravitación cuántica no aparecen en los laboratorios de física de partículas.
Únicamente, en un laboratorio aparecieron partículas que tenían energías del orden de la masa de Planck: en el Universo primitivo, de acuerdo con la teoría del Big Bang, motivo este por el que es necesaria una teoría cuántica de la gravedad para estudiar aquellas condiciones.
Esta energía de la que estamos hablando, del orden de 1019 GeV (inalcanzable para nosotros), es la que necesitamos para verificar la teoría de supercuerdas.
Siempre, desde que puedo recordar, me llamó la atención los misterios y secretos encerrados en la Naturaleza y, la innegable batalla mantenida, a lo largo de la historia, por los científicos para descubrirlos.
Hacia 1.900 se sabía que el átomo no era una partícula simple e indivisible-invisible, como predijo Demócrito, pues contenía, por lo menos, un corpúsculo subatómico: el electrón, cuyo descubridor fue J.J.Thomson, el cual supuso que los electrones se arracimaban con uvas en el cuerpo principal del átomo de carga positiva.
Poco tiempo después resultó evidente que existían otras partículas en el interior del átomo. Cuando Becquerel descubrió la radiactividad, identificó como emanaciones constituidas por electrones algunas de las radiaciones emitidas por sustancias radiactivas.
Pero también quedaron al descubierto otras emisiones. Los Curie en Francia y Ernest Rutherford en Inglaterra, detectaron una emisión bastante menos penetrante que el flujo electrónico. Rutherford la llamó “rayos alfa”, y denominó “rayos beta” a la emisión de electrones.
Los electrones volantes constitutivos de esta última radiación son, individualmente, “partículas beta”. Así mismo, se descubrió que los rayos alfa estaban formados por partículas, que fueron llamadas “partículas alfa”. Como ya sabemos, “alfa” y “beta” son las primeras letras del alfabeto griego y se escriben con los gráficos α y ß.
Entretanto, el químico francés Paul Verich Villard descubría una tercera forma de emisión radiactiva, a la que dio el nombre de “rayos gamma”, es decir, la tercera letra del alfabeto griego γ. Pronto se identificó como una radiación análoga a los rayos x, aunque de menor longitud de onda.
Mediante sus experimentos, Rutherford comprobó que un campo magnético desviaba las partículas alfa con mucho menos fuerza que las partículas beta. Por añadidura, las desviaba en dirección opuesta. La cual significaba que la partícula alfa tenía una carga positiva, es decir, contraria a la negativa del electrón. La intensidad de tal desviación permitió calcular que la partícula alfa tenía como mínimo, una masa dos veces mayor que la del hidrogenión cuya carga positiva era la más pequeña conocida hasta entonces.
En 1.909, Rutherford pudo aislar las partículas alfa. Puso material radiactivo en un tubo de vidrio fino rodeado por vidrio grueso e hizo el vacío entre ambas superficies. Las partículas alfa pudieron atravesar la pared fina, pero no la gruesa, lo que dio lugar a que las partículas quedaran aprisionadas entre ambas, y Rutherford recurrió entonces a la descarga eléctrica para excitar las partículas alfa, hasta llevarla a la incandescencia. Entonces mostraron los rayos espectrales del helio.
Hay pruebas de que las partículas alfa producidas por sustancias radiactivas en el suelo constituyen el origen del helio en los pozos de gas natural.
Si la partícula alfa es helio, su masa debe ser cuatro veces mayor que la del Hidrógeno. Ello significa que la carga positiva de este último equivale a dos unidades, tomando como unidad la carga del hidrogenión.
Más tarde, Rutherfor identificó otra partícula positiva en el átomo. A decir verdad, había sido detectada y reconocida ya muchos años antes. En 1.886, el físico alemán Eugen Goldstein, empleando un tubo catódico con un cátodo perforado, descubrió una nueva radiación, que fluía por los orificios del cátodo en dirección opuesta a la de los rayos catódicos. La denominó “rayos canales”.
En 1.902, esta radiación sirvió para detectar por vez primera el efecto Doppler-Fizean respecto a las ondas luminosas de origen terrestre. El físico alemán de nombre Johannes Stark orientó un espectroscopio de tal forma que los rayos cayeron sobre éste, revelando la desviación hacia el violeta. Por estos trabajos se le otorgó el premio Nóbel de Física en 1.919.
Puesto que los rayos canales se mueven en dirección opuesta a los rayos catódicos de carga negativa, Thomson propuso que se diera a esta radiación el nombre de “rayos positivos”. Entonces se comprobó que las partículas de rayos positivos podían atravesar fácilmente la materia. De aquí que fuesen considerados, por su volumen, mucho más pequeños que los iones corrientes o átomos. La desviación determinada, en su caso, por un campo magnético, puso de relieve que la más ínfima de estas partículas tenía carga y masa similares a las del hidrogenión, suponiendo que este ion contuviese la misma unidad posible de carga positiva.
Por consiguiente, se dedujo que la partícula del rayo positivo era la partícula positiva elemental, o sea, el elemento contrapuesto al electrón, Rutherford la llamó “protón” (del neutro griego protón, “lo primero”).
Desde luego, el protón, y el electrón llevan cargas eléctricas iguales, aunque opuestas; ahora bien, la masa del protón, referida al electrón, es 1.836 veces mayor (como señalo en el gráfico anterior).
Parecía probable pues que el átomo estuviese compuesto por protones y electrones, cuyas cargas se equilibran entre sí. También parecía claro que los protones se hallaban en el interior del átomo y no se desprendían, como ocurría fácilmente con los electrones. Pero entonces se planteó el gran interrogante: ¿cuál era la estructura de esas partículas en el átomo?
El núcleo atómico
El propio Rutherford empezó a vislumbrar la respuesta.
Entre 1.906 y 1.908 (hace ahora un siglo) realizó constantes experimentos disparando partículas alfa contra una lámina sutil de metal (como oro o platino), para analizar sus átomos. La mayor parte de los proyectiles atravesaron la barrera sin desviarse (como balas a través de las hojas de un árbol). Pero no todos. En la placa fotográfica que le sirvió de blanco tras el metal, Rutherford descubrió varios impactos dispersos e insospechados alrededor del punto central. Comprobó que algunas partículas habían rebotado. Era como si en vez de atravesar las hojas, algunos proyectiles hubiesen chocado contra algo más sólido.
Rutherford supuso que aquellas “balas” habían chocado contra una especie de núcleo denso, que ocupaba sólo una parte mínima del volumen atómico y ese núcleo de intensa densidad, desviaban los proyectiles que acertaban a chocar contra él. Ello ocurría en muy raras ocasiones, lo cual demostraba que los núcleos atómicos debían ser realmente ínfimos, porque un proyectil había de encontrar por fuerza muchos millones de átomos al atravesar la lámina metálica.
Era lógico suponer, pues, que los protones constituían ese núcleo duro. Rutherford representó los protones atómicos como elementos apiñados alrededor de un minúsculo “núcleo atómico” que servía de centro (después de todo eso, hemos podido saber que el diámetro de ese núcleo equivale a algo más de una cienmilésima del volumen total del átomo.)
En 1.908 se concedió a Rutherfor el premio Nóbel de Química, por su extraordinaria labor de investigación sobre la naturaleza de la materia. El fue el responsable de importantes descubrimientos que permitieron conocer la estructura de los átomos en esa primera avanzadilla.
Desde entonces se pueden descubrir con términos más concretos los átomos específicos y sus diversos comportamientos. Por ejemplo, el átomo de hidrógeno posee un solo electrón. Si se elimina, el protón restante se asocia inmediatamente a alguna molécula vecina; y cuando el núcleo desnudo de hidrógeno no encuentra por este medio un electrón que participe, actúa como un protón -es decir, una partícula subatómica-, lo cual le permite penetrar en la materia y reaccionar con otros núcleos si conserva la suficiente energía.
emilio silvera
















 Totales: 83.332.740
Totales: 83.332.740 Conectados: 56
Conectados: 56






















