Sep
28
Cosas de Física a petición del un Centro Escolar
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Física ~
Clasificado en Física ~
 Comments (2)
Comments (2)
Acoplamiento espín órbita:
El pequeño cuadrado verde en esta imagen marca el punto cero grados de latitud y 180 º de longitud en la superficie de Mercurio. Este es una de los dos “polos calientes” de Mercurio . El otro es en la latitud 0 ° y 0 ° de longitud. La excéntrica órbita de Mercurio y el acoplamiento espín-órbita se combinan de modo que uno u otro de estos “polos calientes” apunta hacia el Sol cuando Mercurio pasa más cerca del Sol en su órbita, y este se encuentra arriba ya en estos puntos que en cualquier otro lugar del planeta… Pero, lo que quierp decir es que…
Es Interacción entre el momento angular orbital y el momento angular de espín de una partícula individual, como un electrón. Para los átomnos ligeros, el acoplamiento espín-órbita es pequeño, de manera que los multipletes de los átomos de muchos electrones se describen por el acoplamiento de Russell-Saunders. Para los átomos pesados, el acoplamiento espín-órbita es grande, de forma que los multipletes de los átomos de muchos electrones se describen por el acoplamiento i-i. Para los átomos de tamaño medio las magnitudes de las energías asociadas con el acoplamiento espín-órbita son comparables a las magnitudes de las energías asociadas con la repulsión electrostática entre los electrones, estando los multipletes descritos en este caso por un acoplamiento intermedio. El de espín-órbita es grande en muchos núcleos, particularmente en los nñucleos pesados.
Empezaremos considerando a un electrón girando sobre sí mismo como si fuese un trompo, una imagen que representa una buena simbolización del momento angular de spin de dicha partícula. El mismo electrón además de poseer este momento angular intrínseco posee también otro tipo de momento angular al estar atrapado orbitalmente como parte de un átomo:
Aunque ambos momentos angulares son cosa aparte, aceptemos que poseen la característica de poder acoplarse para dar origen a nuevas líneas en el espectro, las cuales no pueden ser explicadas sin la presunción de ese acoplamiento. Por acoplamiento entendemos la suma de los momentos angulares, orbital y de spin, y dándoles a estas cantidades una cualidad pseudo-vectorial al igual que como se acostumbra a hacerlo en la mecánica clásica, el momento angular total J se define como la suma “vectorial” del momento angular de spin S y el momento angular orbital L:
Todo profesor, casi siempre, se ve en apuros cuando un alumno plantea algunas de las siguientes interrogantes: ¿por qué el mercurio es líquido?, ¿por qué la plata y el oro tienen diferente color?, ¿a qué se debe realmente el efecto del par inerte?, ¿cómo podría explicar la contracción del bloque d o la contracción lantánida? o ¿por qué algunos elementos tienen configuraciones electrónicas aparentemente anómalas? Por no mencionar el acoplamiento espín-orbital y los valores extraños en: los potenciales de ionización, las afinidades electrónicas, los desplazamientos químicos en el RMN, entre otros.
Como todos sabemos, el estudio del comportamiento del electrón en el átomo se lleva a cabo matemáticamente resolviendo la ecuación de Schrödinger que, en algunos textos, se puede encontrar simplificada (ecuación 1a) o más desarrollada (ecuación 1b)
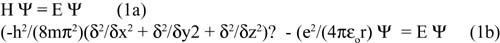
donde h es la constante de Planck, m es la masa del electrón, x, y, z son las coordenadas del electrón, e es la carga del electrón, r es la distancia del electrón al núcleo, εo es la permisividad del vacío, Ψ es la función de onda y E es la energía. La solución de esta ecuación consiste en encontrar valores para ? y E. Al resolver esta ecuación aparecen tres números cuánticos: n, l y m l . No aparece el cuarto número cuántico, el espín, como algunos textos dan a entender erróneamente. En este tratamiento mecánico cuántico -que se encuentra en casi todos los textos de química- se asume que la velocidad del electrón es pequeña comparada con la velocidad de la luz (c ) y que su masa (m) es aproximadamente igual a su masa en reposo (m o ). Esta simplificación, que se conoce como mecánica cuántica no-relativística, es adecuada para explicar muchos parámetros de los elementos químicos más ligeros. Sin embargo, falla al tratar de explicar valores como las distancias y energías de los electrones para los elementos más pesados. Cuando la carga nuclear se incrementa, la atracción de los electrones hacia el núcleo crece, lo que ocasiona que los electrones se muevan a mayor velocidad; en algunos casos, es cercana a la de la luz. Por ello, en los átomos más pesados los electrones internos tienen velocidades muy grandes y se sabe por la teoría de la relatividad, dada por Einstein en 1905, que la masa de cualquier objeto que se mueve se incrementa a medida que aumenta su velocidad. Cuando se toma en cuenta la gran velocidad con la que el electrón realmente se mueve y corrigiendo su masa por las ecuaciones 2 y 3, entramos al campo de la mecánica cuántica relativística y eso fue lo que Dirac desarrolló en el año 1925.
donde Z es el número atómico, v es la velocidad del electrón y m es la masa relativística del electrón.
La ecuación de Dirac para estudiar el comportamiento del electrón en el átomo (ecuación 4) es análoga a la de Schrödinger:1
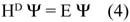
donde HD es el Hamiltoniano de Dirac para muchos electrones.
Por ejemplo, para el mercurio, Z = 80, si aplicamos la ecuación (2) calculamos la velocidad que debe ser aproximadamente 0,58 c (58 % de la velocidad de la luz). Luego por la ecuación (3) calculamos la masa en movimiento que es más o menos 1,23 mo. Conociendo la masa del electrón se puede calcular el radio de Bohr mediante la fórmula 5:
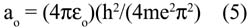
de donde se encuentra que la distancia promedio para el electrón que está en el nivel 6s del mercurio, a o , será un 23 % menor a la correspondiente al valor no-relativístico. En otras palabras, el orbital se comprime un 23 % cuando se toma en cuenta el efecto relativístico. Para el electrón 1s del átomo de hidrógeno los resultados relativísticos indican que su masa es 1.00003 × m o . Se comprime un 3 x10 –5 %, cantidad insignificante al considerar el efecto relativístico.
Como hemos visto, la diferencia de la distancia entre el electrón y el núcleo, así como las energías de los electrones, es pequeña cuando comparamos los valores obtenidos por los efectos relativísticos y los no relativísticos, para los elementos ligeros. Pero esta diferencia aumenta para los elementos pesados, por efecto del incremento de la carga nuclear donde se observa que realmente todos los orbitales s se contraen bastante y también los p.
El espín electrónico fue un término acuñado por Uhlenbeck y Goudsmit 2 en 1925 para explicar la estructura fina del espectro del átomo de hidrógeno (que también explica el resultado del experimento realizado en 1922 por Stern y Gerlach con los átomos de plata) y aplicado al movimiento intrínseco del electrón. Dirac, al realizar el tratamiento matemático aplicando los principios de la mecánica cuántica y la relatividad, encontró que el acoplamiento espín-orbital es un efecto puramente relativístico. Todos los electrones, incluyendo los s, tienen momento angular y no hay distinción entre momento angular orbital y momento angular del espín. Sólo hay un momento J, momento cuántico angular. La interacción espín-orbital divide una capa de un valor dado de l (número cuántico del momento angular) en subcapas con un total de momento angular j = l – ½ y j = l + ½. Por ello los 3 orbitales p son diferentes; ellos forman dos grupos de orbitales p 1/2 y p 3/2. La diferencia de energía entre estas subcapas viene a ser justo la energía espín-orbital. Tras ello, Dirac propuso que el orbital s debe recibir la denominación s 1/2 , que es el momento angular que aparece en las mediciones espectroscópicas. Como s 1/2 y p 1/ 2 tienen la misma dependencia angular, un orbital p 1/2 es de hecho esféricamente simétrico y tiene una menor energía que el p 3/2 . (éste último tiene la forma de una dona). Este desdoblamiento energético de los orbitales es la explicación para la energía de acoplamiento espín-orbital.
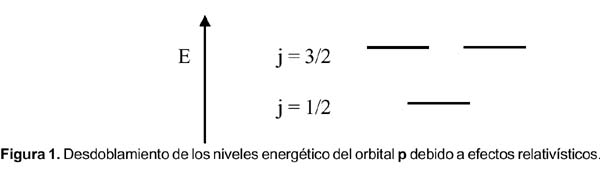
Un tratamiento matemático riguroso, que no vamos a desarrollar aquí, concluye que los efectos relativísticos aplicados a los orbitales atómicos son tres:
1. La contracción radial relativística y la disminución (mayor estabilización) energética
de los orbitales s y p.
2. Los electrones en orbitales donde l > 0 (p, d, f, …) sufrirán el conocido desdoblamiento espín-orbital en j = l + s; j = l ± 1/2.
3. Los electrones en orbitales d y f, debido a que serán más eficientemente apantallados por la contracción de las capas s y p, se orientan radialmente hacia fuera y subirán en energía (se desestabilizan). Esto se conoce como efecto relativístico indirecto o de segundo orden.
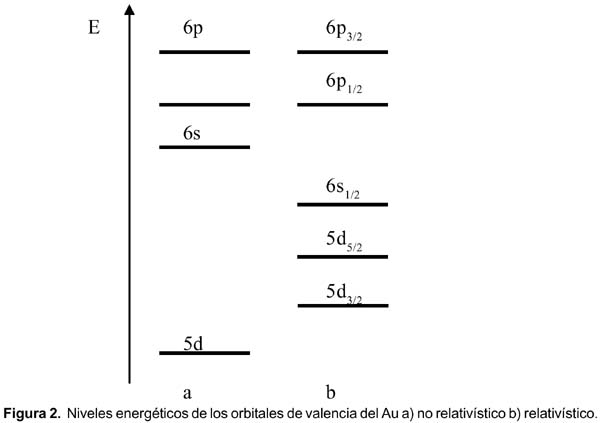
Estos tres efectos son de la misma magnitud y crecen a medida que lo hace Z 2 . Aplicado a un elemento pesado, como el oro (figura 2), da lugar a una distribución energética de los orbitales atómicos diferente a la que aparece en muchos textos de química.
La mecánica cuántica resulta difícil no sólo por las matemáticas, sino también debido a que surgen conceptos que son difíciles de comprender, no sólo por alumnos o profesores sino que escapa a la cotidianidad del ser humano. Por ejemplo, nosotros podemos percibir un gira de 90º, 180º y hasta uno de 360º; sin embargo, el electrón tiene un giro de 720 º ¡ningún ser humano puede percibir semejante giro! La velocidad promedio del electrón 1s del átomo de hidrógeno (Z = 1) es ca. 2 × 10 6 m s -1 ; si considerásemos al electrón como una partícula podríamos verlo orbitando el núcleo 10 15 veces en un segundo. En el caso del electrón 1s del oro (Z = 79) su velocidad promedio es mucho mayor que en el caso anterior ca. 1,6 × 10 8 ms -1 , velocidad cercana a la de la luz, c = 3 × 10 8 ms -1 .
A pesar de la importancia de los efectos relativísticos en la química, muy pocos textos los toman en cuenta o siquiera los mencionan. Una de la excepciones es el libro de Química Inorgánica Descriptiva de Geoff Rayner-Canham.3 A continuación veremos cómo se altera nuestra comprensión de parámetros y conceptos químicos debido a los efectos relativísticos, campo en el cual actualmente se realizan muchos estudios teóricos.
EFECTOS RELATIVÍSTICOS EN LOS ELEMENTOS
1. ¿Qué tiene de particular el mercurio para que este elemento sea líquido a temperatura ambiente?
La configuración electrónica para el mercurio es [Xe]4f 14 5d 10 6s 2 y debido a los efectos relativísticos, los orbitales d y f deben subir en energía (desestabilizarse), mientras que los orbitales s, se acercan más al núcleo y se estabilizan. Un diagrama OM para la molécula Hg 2 , similar al diagrama bien conocido del He 2 , se muestra en la figura 3.
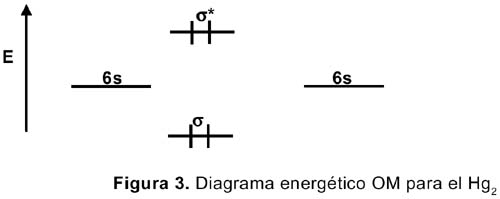
Vemos que los orbitales antienlazantes están poblados lo cual desestabiliza a la molécula diatómica. En fase gas el Hg está formando especies monoméricas. En el caso del vecino que precede al mercurio, el oro, con una configuración [Xe]4f 14 5d 10 6s 1 , formaría una molécula Au 2 estable en fase gas. Los electrones 6s del mercurio, al estar muy establizados en energía, no contribuyen mucho a la formación del enlace Hg-Hg. Lo cual nos lleva a que el enlace mercurio-mercurio debe ser debido a las fuerzas de van der Waals y probablemente a una débil interacción 6p. Ambas fuerzas son muy débiles. Esta es la razón por la cual el enlace Hg-Hg es tan débil. En el caso de los elementos del mismo grupo del Hg, Zn y Cd, los orbitales 4s y 5s, respectivamente, no están tan estabilizados en energía, como en el caso del mercurio.2
Por otro lado, es bien conocido que la especie [Hg-Hg]2+ es muy estable; se conocen muchos compuestos tanto en solución como en fase sólida. Un leve análisis de la configuración electrónica nos revela que esta especie es isoelectrónica al Au 2 que, como ya se mencionó, es estable. También, por efectos relativísticos las distancias Au 2 y Hg 2 2+ son un 16 % más cortas que en el caso de los análogos de plata y cadmio.
Además, la conductividad eléctrica en el Hg es mucho menor que la del Au, ello debido a que los dos electrones 6s están muy localizados y contribuyen muy poco a la banda de conducción.
Beta de Oro
2 ¿Por qué el oro tiene un color diferente a la plata?
Para este caso debemos comparar la distribución energética de los orbitales de valencia de ambos elementos. El color del oro podría deberse a una transición electrónica de un electrón 5d 5/2 al nivel 6s 1/2 (ver figura 2), cuando la luz azul es absorbida. En el caso de la plata la transición deber ser análoga del 4d 5/2 a 5s 1/2 , pero como en el caso del Au (que tiene mayor Z) la diferencia de energía entre los orbitales 6s 1/2 y 5d 5/2 es más pequeña que en el caso 5s 1/2 y 4d 5/2 . Esta última cae dentro del rango del ultravioleta y la del oro en el rango del visible. Sin embargo, la transición, 5d 5/2 a 6s 1/2 está prohibida; por ello, en el caso del átomo de oro debería ser incoloro y no amarillo. Nuestro error está en que hemos debido considerar la teoría de bandas ya que observamos el color amarillo en un bloque sólido de oro, no en un átomo de oro. Y para ello, la teoría de bandas es la apropiada; en ella la diferencia de energía entre las bandas de valencia llenas (esencialmente d) y la banda de conducción (esencialmente s) es 2,4 eV para el oro y 3,7 eV para la plata. La primera cae dentro del rango del visible y la segunda en el ultravioleta. Tal como en el caso anterior, el nivel de cercanía entre las bandas es mayor en el caso del oro, con respecto a la plata, por los efectos relativísticos.
3. ¿Por qué existen valores anómalos en las energía de ionización y la afinidad electrónica?
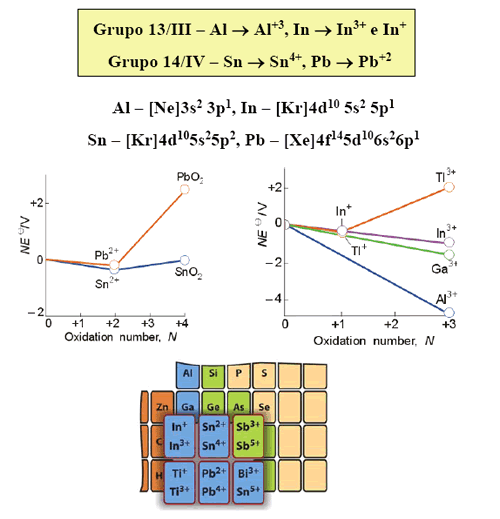
Es bien conocido el hecho de la variación de la energía de ionización (EI) a lo largo de los elementos del grupo 13 al 18, tal como se muestra en la tabla 1
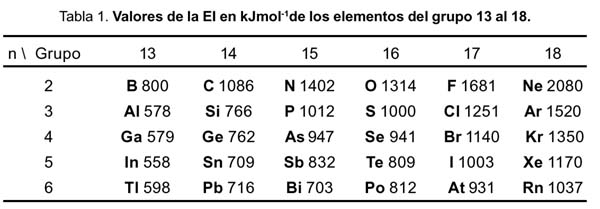
La explicación de estas variaciones se basa en varios hechos: a lo largo de un periodo la carga nuclear se incrementa, a la repulsión electrón-electrón y al apantallamiento incompleto de los electrones. Para los casos donde n = 2, 3, 4 y 5 la explicación, encontrada en los textos, introduce el concepto de repulsión electrón-electrón. La menor repulsión electrón-electrón se logra cuando los espines de los electrones son paralelos ya que cada par de espines paralelos contribuye a una estabilización de intercambio energético del átomo. Por ello, para estos casos, la EI depende del número de pares de espines paralelos que se pierden en la ionización. Por ejemplo, para el caso del nitrógeno, el cambio en el número de espines paralelos al pasar de p 3 a p 2 es de dos, pero para el oxígeno, que cambia de p 4 a p 3 , la variación es cero y se desestabiliza teniendo una menor EI que la del nitrógeno.
Por otro lado, la explicación de las variaciones cuando n = 6 no se encuentra en los textos. La EI del bismuto es menor que la de sus vecinos el plomo y el polonio. Para estos elementos más pesados debemos considerar el efecto relativístico,4 donde el acoplamiento espín-orbital, o sea el momento angular total J, es más importante que la repulsión electrón-electrón. Si los momentos magnéticos debido al espín y al orbital apuntan en direcciones opuestas, se cancelan mutuamente y la interacción es atractiva (el átomo se estabiliza). En el caso que apunten en la misma dirección, la interacción es repulsiva; por consiguiente el átomo se desestabiliza. De la figura 1, el llenado electrónico en el nivel p y para el caso del plomo, bismuto y polonio son: (p 1/2 ) 2 (p 3/2 ) 0 , (p 1/2 ) 2 (p 3/2 ) 1 y (p 1/2 ) 2 (p 3/2 ) 2 , respectivamente.
Por ello, la EI del bismuto es menor que la del plomo, ya que el electrón del primero ocupa un nivel desestabilizado en energía p 3/2 y del plomo uno establizado p 1/2 . La EI del polonio es mayor que la del bismuto por el efecto del incremento de la carga nuclear efectiva.
En las tablas de las energías de ionización podemos observar una “anomalía”. Los valores de la primera y segunda energía de ionización son para la plata 0,73 y 2,07 MJ/mol y para el oro 0,89 y 1,98. La tendencia general es que la EI disminuya al descender en un grupo, sin embargo, esto no ocurre. Para resolver esta interrogante tendríamos que calcular el valor de las energías de los orbitales de valencia del oro y de la plata. Se puede hacer de una manera indirecta a través de cálculos relativísticos de las moléculas diatómicas AuH y AgH, realizadas por Pyykkö y mostrados en la figura 4.
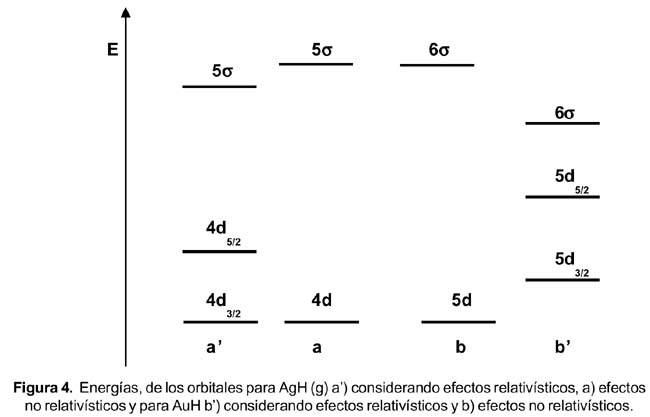
Se puede apreciar que la primera energía de ionización (electrón s) es menor en la plata (5? ) con respecto al oro (6? ). Pero la segunda energía de ionización (electrón que está en d 5/2 ) es menor en el oro que en la plata. Nuevamente, por efectos relativisticos el nivel 6s del oro es mas estable que el de la plata, pero sus orbitales d se desestabilizan más que los de la plata.
Con el oro sucede otro hecho curioso, ¡su afinidad electrónica es de 193 kJ/ mol, que es mayor a la del oxígeno (142,5 kJ/mol)! La razón de esta gran afinidad electrónica es que si el orbital 6s es ocupado por dos electrones el oro adquiere una estabilidad. El oro forma compuestos con otros metales como CsAu en el que el estado de oxidación formal del oro es –1. Por ello, suponer que el oro actúa siempre como un metal electropositivo sería un error.
4. ¿Cuál es la explicación para el efecto del par inerte?
La contracción relativista de los orbitales s significa que para un átomo de elevado número atómico, hay una energía extra de atracción entre los electrones s y del núcleo. Esto se pone de manifiesto en las energías de ionización más elevadas para los electrones 6s, que contribuyen al efecto termodinámico del par inerte 6s.

La configuración electrónica de valencia de los elementos del grupo 13 (B. Al, Ga, In y Tl) es ns 2 np 1 . Estos elementos pueden formar tres enlaces covalentes o, desde otro punto de vista, pueden tener un estado de oxidación formal de +3. Es muy conocido el hecho de que los elementos más pesados de este grupo (y muchos más en el caso del talio) forman muchos compuestos iónicos, con un estado de oxidación formal de +1, en los que sólo se ionizan los electrones del nivel p, pero no los del s. Este comportamiento en la ionización de los elementos más pesados se conoce como efectos del par inerte, relacionado al hecho de que los dos electrones s no se pierden.
Los efectos de apantallamiento y relativísticos son responsables de que todos los elementos del periodo 6 (Tl 6s 2 6p 1 , Pb 6s 2 6p 2 , Po 6s 2 6p 4 ) tengan mayores energías de ionización que sus congéneres del periodo 5 (In, Sn, Te). Por ello, los electrones 6s 2 son reacios a participar en un enlace químico y por ello son estables los estados de oxidación Tl(I), Pb(II) y Bi(III).
Este hecho se puede comprender fácilmente si observamos que el Tl(I) es isoelectrónico al mercurio; su orbital 6s está muy estabilizado en energía y se re-quiere mucha energía para remover los dos electrones de este nivel, aproximadamente 4 848 kJ/mol. Recordemos que para formar un catión se gasta energía que debe ser compensada por la energía reticular y, por otro lado, es muy importante el tamaño del catión, ya que si es grande la energía reticular será menor. En el caso del Tl ambos factores son desfavorables; el alto costo energético de remover los dos electrones 6s y el gran tamaño del Tl(III), hacen que se reduzca mucho la estabilidad de este compuesto iónico. Esta es la razón por la cual existen un gran número de compuesto de Tl(I) y pocos de Tl(III). Sin embargo, se conocen halogenuros de Tl(III) pero su comportamiento es típico de halogenuros covalentes, como cabría esperar.5,6
Blanco plateado
Mercurio vertíendose en una placa de petri
Lo mismo sucede en el caso del plomo (II) que es isoelectrónico al mercurio. El cloruro de plomo (II) forma una red cristalina del tipo iónico. Por otro lado, el cloruro de plomo (IV) muestra enlaces covalentes, aunque es inestable ya que se descompone con la humedad o estalla al calentarlo. Los otros halogenuros de plomo(IV), de bromo y yodo, no existen ya que el potencial rédox de estos halógenos reduce el plomo (IV) a plomo (II).
Adicionalmente al análisis realizado a los electrones 6s 2 , también se podría realizar a los electrones 5s 2 y 4s 2 . Para los electrones 5s 2 el efecto es menor, pero importante y en el caso del 4s 2 es mucho menor el efecto relativístico.
Un caso curioso lo manifiesta el SnCl 2 (5s 2 ) el cual teóricamente es una base de Lewis, pero en presencia de cloruro reacciona para formar [SnCl 3 ] – . Y más aún, los ángulos de enlace ClSnCl de la especie [SnCl 3 ] – son de 90º. Esto último implica que el estaño debe hacer uso de sus orbitales p exclusivamente y no involucran a los s (no se forman orbitales híbridos sp 2 ) ya que deben estar muy estabilizados en energía.3b La vasta cantidad de datos estructurales demuestra que este par de electrones, si bien no participa como una base de Lewis es, muchas veces, estéricamente activo. En términos simplificados, los compuestos del Sn(II) deben tener estructuras regulares si el par libre de electrones permanece en el orbital esférico y simétrico s; pero parece que en muchas moléculas ocurre una mezcla s-p que da a los orbitales del par libre un considerable carácter p (que son direccionables). Ello explica que el SnCl 2 no es lineal (95º), en cambio, en el caso del ZnCl 2 , que no tiene par libre, es de 180º. Además, el [SnCl 3 ] – sí actúa como base de Lewis con BX 3 y con metales de transición.
5. ¿Cómo se explica la contracción lantánida?
Al ir del lantano (Z = 57) al lutecio (Z = 71) se observa que el radio iónico disminuye en 18,3 pm. El llenado electrónico de los orbitales 4f produce una con-tracción gradual, llamada contracción lantánida, no sólo en los radios iónicos sino también en los tamaños atómicos. A medida que se avanza del lantano al lutecio se incrementa la carga nuclear y el número de electrones en el nivel f se incrementa; sin embargo, debido al poco efecto pantalla que brinda un electrón a otro en el nivel f, la carga nuclear efectiva que experimenta cada electrón aumenta, produciéndose una reducción del tamaño de la capa f. Es necesario informar que dicha disminución de tamaño no es muy regular.
Ahora bien, habría que añadir a la explicación ya dada, el efecto relativístico, que contribuye con aproximadamente un 10% a esta contracción. La contracción de los actínidos puede ser explicada en los mismos términos que la de los lantánidos.
Como se ha podido apreciar en esta revisión, los efectos relativísticos pueden explicar una serie de hechos que de otro modo serían un misterio.
DEDICACIÓN
Este trabajo va dedicado a Albert Einstein, ya que habiendo pasado 100 años desde la presentación de cinco trabajos relevantes de Albert Einstein 7 -4 en la revista Annalen der Physik, así como su tesis doctoral- el año 1905 es llamado annus mirabilis de Einstein. Los artículos famosos publicados pueden ser con sultados en las siguientes referencias: Ann. Phys. 1905, Lpz 17 ,132-148, Ann. Phys. 1905, Lpz 17 ,549-560, Ann. Phys., 1905, Lpz 17, 891-921 y Ann. Phys., 1905, Lpz 18, 639-641. En la actualidad se sigue investigando la relatividad aplicada a los elementos y compuestos químicos, los cuales seguro contribuirán a tener una mejor visión y comprensión de la química.
REFERENCIAS
1. P. Pyykkö, Chem. Rev., 1988, 88, 563.
2. L. J. Norrby, J. Chem. Educ., 1991, 68, 110.
3. a) G. Rayner-Canham, “ Química Inorgánica Descriptiva”, Addison Wesley Longman, Segunda edición, México, 2000, p. 30 y 241. b) Ibid, p 288.
4. The University of Hull, http://150.237.140.43/lectures/ajb/non-classical.pdf. (Última vista, 16 de febrero 2005).
5. P. Pyykkö y J-P Desclaux, Acc. Chem. Res., 1979, 12, 276.
6. K. S. Pitzer, Acc. Chem. Res., 1979, 12, 271.
Transcripción de emilio silvera
















 Totales: 75.444.971
Totales: 75.444.971 Conectados: 62
Conectados: 62
























