Feb
5
La Evidencia experimental…¡Nos dará la respuesta!
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Física Cuántica ~
Clasificado en Física Cuántica ~
 Comments (1)
Comments (1)
¿De qué está hecho el Universo?
¿Qué lo mantiene Unido?
¿Qué es, en realidad la materia?
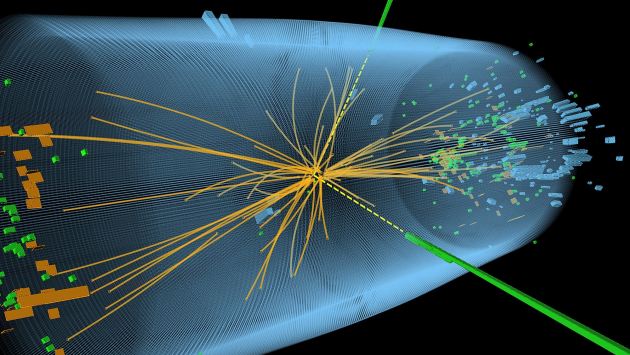
Muchos han sido los medios que lanzando las campanas al vuelo, se atrevieron decir: “¡Por fín, se encontró la “partícula de Dios!” Cuando lo cierto es que, simplemente se publicó (31/07/2012), en los experimentos ATLAS y CMS del LHC se ha descubieto una partícula, nunca antes vista. Un Bosón con una masa cercana a los 126 GeV.
El descubrimiento se enmarca dentro de la búsqueda del Bosón de Higgs del Modelo estándar de las interacciones fundamentales, si bien no es posible afirmar aún si dicha partícula predice las propiedades predicha por la teoría, y, siendo así (que lo es), no podemos afirmar que sea, el buscado Bosón de Higgs esa partícula observada.

Nos dicen que existen lugares que llaman los Océanos de Higgs, y, por ellos, circula libremente el dichoso Bosón que, también según nos dicen, proporciona la masa al resto de las partículas.
El modelo estándar de la física de partículas es una teoría que describe las relaciones entre las interacciones fundamentales conocidas y las partículas elementales que componen toda la materia. Es una teoría cuántica de campos desarrollada entre 1970 y 1973 que es consistente con la mecánica cuántica y la relatividad especial. Hasta la fecha, casi todas las pruebas experimentales de las tres fuerzas descritas por el modelo estándar están de acuerdo con sus predicciones. Sin embargo, el modelo estándar no alcanza a ser una teoría completa de las interacciones fundamentales debido a que no incluye la gravedad, la cuarta interacción fundamental conocida, y debido también al número elevado de parámetros numéricos (tales como masas y constantes que se juntan) que se deben poner a mano en la teoría (en vez de derivarse a partir de primeros principios).

Todo ese galimatias de más abajo, es, el Modelo estándar y aún más: Veréis…

¿Impresionada? No era mi intención asustarte, solo te he puesto la fórmula para que te fijes en un detalle y comprendas por qué se empeñan los científicos en buscar el bosón de Higgs. Vuelve a mirar la ecuación y fíjate en las “H“. Ese valor representado en la fórmula es elbosón de Higgs y, aunque no lo hemos encontrado, es fundamental para que el Universo se comporte como se comporta, ya que cada vez que ponemos en marcha la ecuación, nuestras predicciones funcionan. (fuente fórmula blog inti-illimani).
Se cree que el Higgs guarda , por tanto, una relación íntima con el concepto de unificación de fuerzas y con el origen de la masa. Se trataría además de la primera partícula escalar con caracter fundamental, esto es, que no necesita estar compuesta por entidades más pequeñas. No es por tanto sorprendente que el descubrimiento reciente en el LHC de un nuevo Bosón con una masa de unos 126 GeV, con unas propiedades compatibles con el Bosón de Higgs, tanga de fiesta a toda la comunicad cientñifica del CERN que, de ser cierto el hallazgo, verían de cerca el Nobel que les otorgarían.

Claro que nadie sabe como sería el Bosón de Higgs, qué condiciones físicas debe tener y que masa, las predicciones teóricas no lo dicen en el modelo mH Es natural pensar que sea del mismo orden que la escala caracterísitica de la interacción electrodébil. mH ≈ 100 GeV – 1 TeV, y de hecho, la mayor parte de las predicciones conducen de una forma u otra a este intervalo de masas. La masa debe ser por tanto determinada experimentalmente. Una vez conocida esta, las propiedades de producción y desintegración del Bosón de Higgs están realmente determinadas por la teoría.

Ya veremos si realmente, la experimentación corrobora lo que predice la teoría y, podemos verificar los mecanismos mediante los cuáles, el Bosón de Higgs, puede “dar” masa a las partículas. Claro que, siempre en un escenario cercano al Modelo Estándar, eunbosón de higgs de 126 GeV posee una anchura de desintegración de unos pocos megas electrón voltios. Incluso para los aceleradores de mayor energía, esta anchura es aún suficientemente grande como para que la longitud media de desintegración del Bosón de Higgs sea inferior a una milésima de micra, demasiado pequeña para ser visible en un detector.
El choce de los haces de hadrones, produce una miríada de infinitesimales objetos producto de los protones rotos y que, de entre tanta “basura”, tendremos que localizar la probable partícula llamada Bosón de Higgs, lo cual, no resultará nada fácil.
El Bosón de Higgs debe aparecer por tanto como una partícula que se desintegra inmediatamente en el punto en el que los haces colisionan, además, la medida de su masa no estará condicionada por su anchura de desintegración, sino por la resolcuión energética del detector, que, en general, es al menos del orden de 1 GeV.
El Higgs se produce predominantemente en el LHC a través de un proceso de fusión de gluones: gg→ H. En cuanto se refiere a modos de desintegración, una masa de unos 126 GeV es especialmente interesante porque permite el acceso a varios canales diferentes.

Si bien la desintegración dominante para esta masa es en un par de Quarks b, el fondo enorme de otros procesos con este mismo estado final impide una búsqueda directa a partir del proceso gg→ H. Afortunadamnete existen varios canales alternativos con fracciones de desintegración aceptables, como pares de Bosones W o Z. Por último, el canal de desintegración en dos fotones, H → γγ, a pesar de su baja frecuencia, es extremadamente limpio desde el punto de vista experimental.

En todos los canales citados anteriormente, únicamente H → γγ y H → ZZ, y este último en un estado final con electrones o muones, permiten una medida precisa de mH al nivel de 1 GeV, y por tanto observar al Bosón de Higgs como exceso en el espectro de masas. Las colaboraciones ATLAS y CMS han medido mH = 120.0 ± o,4 GeV y mH = 125.3 ± 0,4 (stat.) ± 0,5 (syst.) GeV , respectivamente.
Está claro que la búsqueda del Bosón de Higgs no está nada clara y que, son muchos los parámetros que nos pueden llevar a tomar, alguna partícula parecida por ese extraño Bosón que se dedica a dar masa a las demás partículas, y, debemos comprobar, si aparece por fin, de qué mecanismo se vale para tal “milagro”, o, mejor maravilla.
Publica: emilio silvera
Se agradece la aportación realizada por los físicos Juan Alcaráz, Javier Cuevas, Carmen García y Mario Martinez que, con su trabajo publicado en el volumen 26, número 4, de 2012, han ayudado a entender, algo mejor, el complejo tema del Bosón de Higgs.
Feb
5
Conociendo la materia
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Química ~
Clasificado en Química ~
 Comments (1)
Comments (1)
Entre 1.906 y 1.908 (hace ahora un siglo) Rutherford realizó constantes experimentos disparando partículas alfa contra una lámina sutil de metal (como oro o platino), para analizar sus átomos. La mayor parte de los proyectiles atravesaron la barrera sin desviarse (como balas a través de las hojas de un árbol). Pero no todos. En la placa fotográfica que le sirvió de blanco tras el metal, Rutherford descubrió varios impactos dispersos e insospechados alrededor del punto central. Comprobó que algunas partículas habían rebotado. Era como si en vez de atravesar las hojas, algunos proyectiles hubiesen chocado contra algo más sólido.
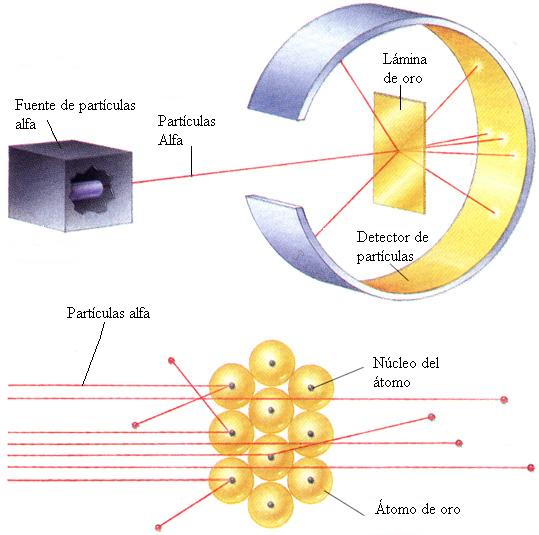
Rutherford supuso que aquellas “balas” habían chocado contra una especie de núcleo denso, que ocupaba sólo una parte mínima del volumen atómico y ese núcleo de intensa densidad, desviaban los proyectiles que acertaban a chocar contra él. Ello ocurría en muy raras ocasiones, lo cual demostraba que los núcleos atómicos debían ser realmente ínfimos, porque un proyectil había de encontrar por fuerza muchos millones de átomos al atravesar la lámina metálica.
Era lógico suponer, pues, que los protones constituían ese núcleo duro. Rutherford representó los protones atómicos como elementos apiñados alrededor de un minúsculo “núcleo atómico” que servía de centro (después de todo eso, hemos podido saber que el diámetro de ese núcleo equivale a algo más de una cienmilésima del volumen total del átomo.)

En 1908 se concedió a Rutherfor el premio Nóbel de Química, por su extraordinaria labor de investigación sobre la naturaleza de la materia. El fue el responsable de importantes descubrimientos que permitieron conocer la estructura de los átomos en esa primera avanzadilla.
Desde entonces se pueden descubrir con términos más concretos los átomos específicos y sus diversos comportamientos. Por ejemplo, el átomo de hidrógeno posee un solo electrón. Si se elimina, el protón restante se asocia inmediatamente a alguna molécula vecina; y cuando el núcleo desnudo de hidrógeno no encuentra por este medio un electrón que participe, actúa como un protón -es decir, una partícula subatómica-, lo cual le permite penetrar en la materia y reaccionar con otros núcleos si conserva la suficiente energía.

Átomo de Helio

El helio, que posee dos electrones, no cede uno con tanta facilidad. Sus dos electrones forman un caparazón hermético, por lo cual el átomo es inerte. No obstante, si se despoja al helio de ambos electrones, se convierte en una partícula alfa, es decir, una partícula subatómica portadora de dos unidades de carga positiva.
Hay un tercer elemento, el litio, cuyo átomo tiene tres electrones. Si se despoja de uno o dos, se transforma en ion. Y si pierde los tres, queda reducida a un núcleo desnudo, con una carga positiva de tres unidades.
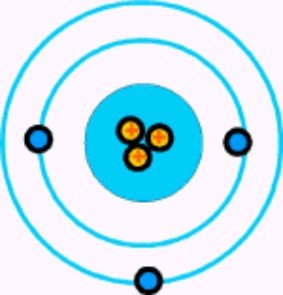
Átomo de Litio
Las unidades de una carga positiva en el núcleo atómico deben ser numéricamente idéntica a los electrones que contiene como norma, pues el átomo suele ser un cuerpo neutro y esta igualdad de lo positivo con lo negativo, es el equilibrio. Y, de hecho, los números atómicos de sus elementos se basan en sus unidades de carga positiva, no en las de carga negativa, porque resulta fácil hacer variar el número de electrones atómicos dentro de la formación iónica, pero, en cambio, se encuentran grandes dificultades si se desea alterar el número de sus protones.
Apenas esbozado este esquema de la construcción atómica, surgieron nuevos enigmas. El número de unidades con carga positiva en un núcleo no equilibró, en ningún caso, el peso nuclear ni la masa, exceptuando el caso del átomo de hidrógeno. Para citar un ejemplo, se averiguó que el núcleo de helio tenía una carga positiva dos veces mayor que la del núcleo de hidrógeno; pero, como ya se sabía, su masa era cuatro veces mayor que la de este último. Y la situación empeoró progresivamente a medida que se descendía por la tabla de elementos, e incluso cuando se alcanzó el uranio, se encontró un núcleo con una masa igual a 238 protones, pero una carga que equivalía sólo a 92.

Átomo de Uranio
¿Cómo era posible que un núcleo que contenía cuatro protones (según se suponía del núcleo de helio) tuviera sólo dos unidades de carga positiva? Según la más simple y primera conjetura emitida, la presencia en el núcleo de partículas cargadas negativamente y con peso despreciable, neutralizaba dos unidades de su carga. Como es natural, se pensó también –en el electrón-. Se podría componer el rompecabezas si se suponía que el núcleo de helio estaba integrado por cuatro protones y dos electrones neutralizadores, lo cual deja libre una carga positiva neta de dos, y así sucesivamente, hasta llegar al uranio, cuyo núcleo tendría, pues, 238 protones y 146 electrones, con 92 unidades libres de carga positiva.
El hecho de que los núcleos radiactivos emitieran electrones (según se había comprobado ya, por ejemplo, en el caso de las partículas beta) reforzó esta idea general. Dicha teoría prevaleció durante más de una década, hasta que, por caminos indirectos, llegó una respuesta mejor, como resultado de otras investigaciones.
Casi todo espacio vacío
Pero entretanto se había presentado algunas objeciones rigurosas contra dicha hipótesis. Por lo pronto, si el núcleo estaba constituido esencialmente de protones, mientras que los ligeros electrones no aportaban prácticamente ninguna contribución a la masa, ¿cómo se explicaba que las masas relativas de varios núcleos no estuvieran representadas por números enteros? Según los pesos atómicos conocidos, el núcleo del átomo cloro, por ejemplo, tenía una masa 35’5 veces mayor que la del núcleo del hidrógeno. ¿Acaso significaba esto que contenía 35’5 protones? Ningún científico (ni entonces ni ahora) podía aceptar la existencia de medio protón. Este singular interrogante encontró una respuesta incluso antes de solventar el problema principal. Y ello dio lugar a una interesante historia.
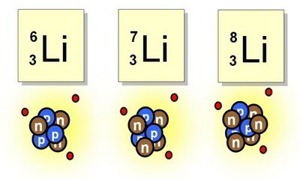
ÍSOTOPOS
Construcción de bloques uniformes
Allá por 1816, el físico inglés William Prout había insinuado ya que el átomo de hidrógeno debía de entrar en la constitución de todos los átomos. Con el tiempo se fueron desvelando los pesos atómicos, y la teoría de Prout quedó arrinconada, pues se comprobó que muchos elementos tenían pesos fraccionarios (para lo cual se tomó el oxígeno, tipificado a 16). El cloro (según dije antes) tiene un peso atómico aproximado de 35’5, o para ser exactos, de 35’457. Otros ejemplos son el antimonio, con un peso atómico de 121’75; el bario, con 127’34; el boro, con 10’811, y el cadmio, con 112’40.

Hacia principios de siglo se hizo una serie de observaciones desconcertantes, que condujeron al esclarecimiento. El inglés William Crookes (el del “tubo Crookes) logró disociar del uranio una sustancia cuya ínfima cantidad resultó ser mucho más radiactiva que el propio uranio. Apoyándose en su experimento, afirmó que el uranio no tenía radiactividad, y que esta procedía exclusivamente de dicha impureza, que él denomino “uranio X”. Por otra parte, Henri Becquerel descubrió que el uranio purificado y ligeramente radiactivo adquiría mayor radiactividad con el tiempo, por causas desconocidas. Si se dejan reposar durante algún tiempo, se podía extraer de él repetidas veces uranio activo X. Para decirlo de otra manera: por su propia radiactividad, el uranio se convertía en el uranio X, más activo aún.
Por entonces, Rutherfor, a su vez, separó del torio un “torio X” muy radiactivo, y comprobó también que el torio seguía produciendo más torio X. Hacia aquellas fechas se sabía ya que el más famoso de los elementos radiactivos, el radio, emitía un gas radiactivo, denominado radón. Por tanto, Rutherford y su ayudante, el químico Frederick Soddy, dedujeron que, durante la emisión de sus partículas, los átomos radiactivos de transformaban en otras variedades de átomos radiactivos.

Varios químicos, que investigaron tales transformaciones, lograron obtener un surtido muy variado de nuevas sustancias, a los que dieron nombres tales como radio A, radio B, mesotorio I, mesotorio II y Actinio C. Luego los agruparon todos en tres series, de acuerdo con sus historiales atómicos. Una serie de originó del uranio disociado; otra, del torio, y la tercera, del actinio (si bien más tarde se encontró un predecesor del actinio, llamado “protactinio”).
En total se identificaron unos cuarenta miembros de esas series, y cada uno se distinguió por su peculiar esquema de radiación. Pero los productos finales de las tres series fueron idénticos: en último término, todas las cadenas de sustancias conducían al mismo elemento, estable: PLOMO.

Ahora bien, esas cuarenta sustancias no podían ser, sin excepción, elementos disociados, entre el uranio (92) y el plomo (82) había sólo diez lugares en la tabla periódica, y todos ellos, salvo dos, pertenecían a elementos conocidos.
En realidad, los químicos descubrieron que aunque las sustancias diferían entre sí por su radiactividad, algunas tenían propiedades químicas idénticas. Por ejemplo, ya en 1907, los químicos americanos Herbert Newby Mc Coy y W.H. Ross descubrieron que el “radiotorio” (uno entre los varios productos de la desintegración del torio) mostraba el mismo comportamiento químico que el torio, y el “radio D”, el mismo que el del plomo; tanto, que era llamado a veces “radio plomo”. De todo lo cual se infirió que tales sustancias eran en realidad variedades del mismo elemento: el radiotorio, una forma de torio; el radioplomo, un miembro de una familia de plomos, y así sucesivamente.
En 1.913, Soddy esclareció esa idea y le dio más amplitud. Demostró que cuándo un átomo emitía una partícula alfa, se transformaba en un elemento que ocupaba dos lugares más abajo en la lista de elementos, y que cuando emitía una partícula beta, ocupaba, después de su transformación, el lugar inmediatamente superior. Con arreglo a tal norma, el “radiotorio” descendería en la tabla hasta el lugar del torio, y lo mismo ocurría con las sustancias denominadas “uranio X” y “uranio Y”, es decir, que los tres serían variedades del elemento 90. Así mismo, el “radio D”, el “radio B” el “torio B” y el “actinio B” compartirían el lugar del plomo como variedades del elemento 82.

Soddy dio el nombre de “isótopos” (del griego iso y topos, “el mismo lugar”) a todos los miembros de una familia de sustancias que ocupaban el mismo lugar en la tabla periódica. En 1921 se le concedió el premio Nóbel de Química.
El modelo protón-electrón del núcleo concordó perfectamente con la teoría de Soddy sobre los isótopos. Al retirar una partícula de dicho núcleo, exactamente lo que necesitaba para bajar dos lugares en la tabla periódica. Por otra parte, cuando el núcleo expulsaba un electrón (partícula beta), quedaba sin neutralizar un protón adicional, y ello incrementaba en una unidad la carga positiva del núcleo, lo cual era como agregar una unidad al número atómico, y, por tanto, el elemento pasaba a ocupar la posición inmediatamente superior en la tabla periódica de elementos.

¿Cómo se explica que cuando el torio se descompone en “radiotorio” después de sufrir no una, sino tres desintegraciones, el producto siga siendo torio? Pues bien, en este proceso el átomo de torio pierde una partícula alfa, luego una partícula beta y, más tarde, una segunda partícula beta. Si aceptamos la teoría sobre el bloque constitutivo de los protones, ello significa que el átomo ha perdido cuatro electrones (dos de ellos, contenidos presuntamente en la partícula alfa) y cuatro protones. (La situación actual difiere bastante de este cuadro, aunque, en cierto modo, esto no afecta al resultado.)

El núcleo de torio constaba inicialmente (según se suponía) de 232 protones y 142 electrones. Al haber perdido cuatro protones y otros cuatro electrones, quedaba reducido a 228 protones y 138 electrones. No obstante, conservaba todavía y el número atómico 90, es decir, el mismo antes.
Así, pues, el “radiotorio”, a semejanza del torio, posee 90 electrones planetarios, que giran alrededor del núcleo. Puesto que las propiedades químicas de átomo están sujetas al número de sus electrones planetarios, el torio y el “radiotorio” tienen el mismo comportamiento químico, sea cual fuere su diferencia en peso atómico (232 y 228, respectivamente).
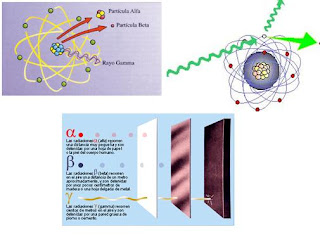
Los isótopos de un elemento se identifican por su peso atómico, o “número másico”. Así, el torio corriente se denomina torio 232, y el “radiotorio”, torio 228. Los isótopos radiactivos del plomo se distinguen también por estas denominaciones:
Plomo 210 – Plomo 214-Plomo 212 y Plomo 211
“radio D” – “radio B” – “Torio B” y “Actinio B”
Se descubrió que la noción de isótopos podía aplicarse indistintamente tanto a los elementos estables como a los radiactivos. Por ejemplo, se comprobó que las tres series radiactivas anteriormente mencionadas terminaban en tres formas distintas de plomo. La serie del uranio acababa en plomo 206; la del torio, en el plomo 208, y la del actinio, en el plomo 207. Cada uno de estos era un isótopo estable y “corriente” del plomo, pero los tres plomos diferían por su peso atómico.

En las explotaciones a cielo abierto se hacen voladuras controladas para remover las rocas, que posteriormente son transportadas hacia la planta de trituración en vehículos. En este proceso se libera polvo tóxico a la atmósfera, además de gas radón producto de la desintegración radioactiva. Otro foco de contaminación asociado a este tipo de minería es que, debido a los procesos de tratamiento del mineral, se generan como residuos elementos como radio, torio, uranio empobrecido, metales pesados en lodos junto con el uranio, etc., que se pueden incorporar a las aguas tanto en superficie como subterráneas. Además, los elementos radioactivos se desintegran de forma espontánea con la emisión de partículas alfa, beta y gamma.
Lo cierto es que, jugamos con fuerzas que no sabemos controlar y de las que, ni pensamos en las consecuencias que nos puedan traer. Bueno, saberlo si lo sabemos pero cerramos los ojos, dado que el beneficio de tales negocios “bien valen algunos daños coñaterañes”…
Sin comentario a este último pensamiento.
emilio silvera
















 Totales: 75.427.883
Totales: 75.427.883 Conectados: 1
Conectados: 1






















