Feb
1
¡Los pensamientos! ¿Quién nos los puede quitar?
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en El Universo y los pensamientos ~
Clasificado en El Universo y los pensamientos ~
 Comments (3)
Comments (3)
Los procesos científicos que comentamos en este lugar, los fenómenos del Universo que hemos debatido y, también, los misterios y secretos que el inmenso Cosmos nos oculta han contribuido, aunque inadvertidamente, a comprometer e involucrar a nuestra especie en la vastedad del universo. La astronomía ha venido a descorrer el velo, que supuestamente, aislaban la Tierra de los ámbitos etéreos que están situados mucho más allá de la Lunase hallan, todo eso, nos llevó lejos al auténtico Universo que ahora, sí conocemos. La Física cuántica llegó para destruir esa barrera invisible que separaba lo grande de lo muy pequeño y que supuestamente, separaba al observador distante del mundo observado; descubrimos que estamos inevitablemente enredados en aquello que estudiamos.
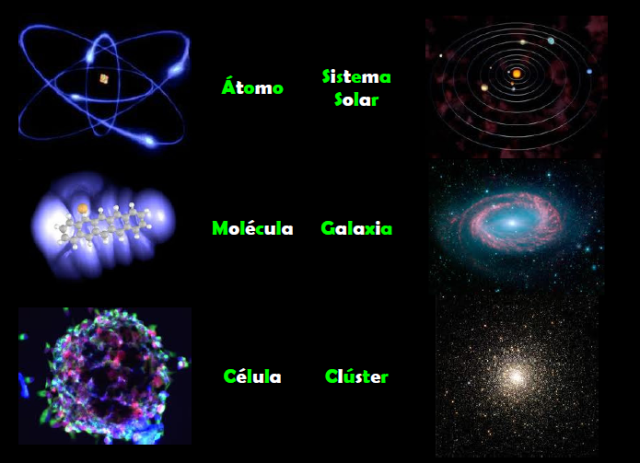
La Astrofísica, al demostrar que la materia es la misma en todas partes y que en todas partes obedece a las mismas leyes, reveló una unidad cósmica que se extiende desde la fusión nuclear en las estrellas hasta la química de la vida que allí se produce a lo largo de todo el Universo. La evolución darwiniana, al destacar que todas las especies de la vida terrestre están relacionadas y que todas surgieron de la materia ordinaria, puso de manifiesto que no hay ninguna muralla que nos separe de las otras criaturas de la Tierra, o del planeta que nos dio la vida: que estamos hechos del mismo material del que están hechos los mundos.
Bio-moléculas, precursoras de la vida en el espacio
La convicción de que, en cierto sentido, formamos una unidad con el universo, por supuesto, ha sido afirmada antes muchas veces, en otras esferas de pensamiento. Hahvé creó a Adán del polvo; el griego Heráclito escribió que “todas las cosas son una sola”; Lao-tse, en China, describió al hombre y la naturaleza como gobernados por un solo principio (“lo llamó el Tao”); y la creencia en la unidad de la Humanidad con el cosmos estaba difundida entre los pueblos anteriores a la escritura, como lo puso de relieve el jefe indio suquamish Seattle, quien declaró en su lecho de muerte que, “todas las cosas están conectadas, como la sangre que une a una misma familia. Todo es como una misma familia, os lo digo”.

La física sugiera que la vida, pudiera ser un fenómeno cuántico antes que biológico
Pero hay algo sorprendente en el hecho de que la misma concepción general ha surgido de ciencias que se enorgullecen de su lúcida búsqueda de hechos objetivos, empíricos. Desde los mapas de cromosomas y los registros fósiles que representan las interconexiones de todos los seres vivos de la Tierra, hasta la semejanza de las proporciones químicas cósmicas con las de las especies vivas terrestres, nos muestran que realmente formamos parte del universo en su conjunto.
La verificación científica de nuestra participación en las acciones del cosmos tiene, desde luego, muchas implicaciones. Una de ellas es, si la vida inteligente ha evolucionado en este planeta, también puede haberlo hecho en otras partes. La Teoría de la evolución de Darwin, aunque no explica el antiguo enigma de por qué existe la vida, deja claro que la vida puede surgir de la materia ordinaria y evolucionar hasta una forma “inteligente”, al menos en un planeta como la Tierra que gira alredeedor de una estrella como el Sol (más de dioez mil millones en la Vía Láctea solamente) y, presumiblemente, más que unos pocos planetas semejantes a la Tierra, podemos especular que no somos la única especie que ha estudiado el universo y se ha preguntado sobre su papel en él.


Nuestra comprensión de la relación entre la Mente el el Universo puede depender de que podamos tomar contacto con otra especie inteligente con la cual compararnos. Raramente la ciencia ha obtenido buenos resultados al estudiar fenómenos de los que sólo tenía un ejemplo: Las leyes de Newton y Einstein habrían sido mucho más difíciles -quizá imposibles- de fortmular si sólo hubiese habido un planeta para someterlas a prueba, y a menudo se dice que el problema de la cosmología es que sólo tenemos un universo para examinar. (El descubrimiento de la evolucoión cósmica reduce un poco esta dificultad al ofrecer a nuestra consideración el estado muy diferente del universo en los primeros momentos de la evolución cósmica.) La cuestión de la vida estraterrestre, pues, va más allá de problemas como el de si estamos solos en el universo, o si podemos esperar tener compañia cósmica o si debemos temer invasiones exteriores; también es un modo de examinarnos a nosotros mismos y nuestra relación con el resto de la Naturaleza.



¿Quién sabe lo que nos podemos encontrar ahí fuera? Sabemos que las moléculas biológicas de la vida están en las Nebulosas, y, también sabemos que existen muchos mundos que, como la propia Tierra, pueden albergar formas de vida de tan rica diversidad como, la Naturaleza, es capaz de producir.
Aunque mucho de esto es nuevo, el interés reciente por la vida estraterrestre puede considerarse como un resultasdo del último vuelco en la fortuna del materialismo, la doctrina filosófica según la cual es posible explicar los sucesos exclusivamente en términos de interacciones materiales, sin recurrir a conceptos insustanciales tales como el espíritu. El darwinismo engendró una nueva actitud de respeto hacia las potencialidades de la materia ordinaria:
“Un montón de barro en un charco de agua de lluvia empieza a parecer mágico, si se piensa que sus iguales de antaño lograron elevarse hasta dar origen a todo el conjunto de la vida terrestre, inclusive la del individuo que contempla el barro.”

Una persona reflexiva, recordando que su ascendencia se remonta, a través de los mamíferos, hasta los peces, los aminoácidos, los azúcares de la materia prebiótica, no puede estar de acuerdo con Martín Lutero en que la Tierra es “sucia” y “nociva”, o aceptar el veredicto de la Christia Sciencie de que “no hay vida, verdad, sustancia ni inteligencia en la materia”.
En realidad -al menos eso creo-, la materia tiene memoria y está predeterminada para lo que tiene que hacer, sigue lo que le dicta la Naturaleza que la lleva, de manera irremediable…, hacia la vida.
Históricamente, los materialistas se han inclinado a pensar que hay vida en otros mundos. El atomista Metrodoro escribió en el siglo IV a. de C. que:

“Considerar la Tierra como el único mundo poblado en el espacio infinito es tan absurdo como afirmar que en todo un campo sembrado de mijo sólo un grano crecerá”.
Cinco siglos más tarde, el epicuréo Lucrecio sostuvo que “hay infinitos mundos iguales y diferentes de este mundo nuestro”. La Iglesia católica romana, convencida de que los seres humanos son esencialmente espíritus inmateriales, se sintió amenazada por el punto de vista materialista: cuando Giordiano Bruno, el decano renacentista del misticismo popular, afirmaba que la materia “es en verdad toda la naturaleza y la madre de todo lo vivo, y declaró que Dios “es glorificado, no en uno, sino en incontables soles; no es una sola Tierra, sino en mil, que digo, en infinidad de mundos”, fue atado a una estaca de hierro y quemado vivo, el 19 de febrero de 1600, en la Piazza Campo dei Fiori de Roma.
Sin embargo, cuando la ciencia creció también lo hizo el materialismo, y con él la creencia de una pluralidad de mundos. Podríamos seguir por este camino y filosofar sobre lo que fue, lo que es y, lo que probablemente será pero, el tiempo se me acaba y, desde luego, no quisiera cerrar este trabajo sin dejar una falsa sensación.
La Ciencia está muy bien, el materialismo viene a poner nuestros pies en el suelo y hacer que nos fijemos en las cosas tal como son o, al menos, tal como creemos que son. Sin embargo, una cuestión me tiene desconcertado: ¿Cómo podemos sentir en la forma que sentimos? ¿De donde vienen esos sentimientos? ¿Será quizá una muestra suprema de la evolución del mundo material? ¿Tendrá memoria la materia?
Por si acaso, yo dejaría aquí un gran signo de interrogación, ya que, hemos alcanzado una pequeña cota de la altísima montaña que nos hemos propuesta escalar, y, desde luego, no sabemos lo que nos podremos encontrar cuando lleguemos a cotas más elevadas, ya que, pensar en llegar al final…no parece nada fácil.
Una cosa sí que está clara para mí:
¡Que hay mucha vida en el Universo y que, la única libertad que tenemos…, son nuestros pensamientos!
La primera tenemos que demostrarla y, la segunda, simplemente con mirar la Historia…, hallaremos la respuesta.
emilio silvera















 Totales: 75.497.045
Totales: 75.497.045 Conectados: 33
Conectados: 33























