Jul
18
Consecuencias biológicas si las constantes fuesen variables
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Constantes universales ~
Clasificado en Constantes universales ~
 Comments (0)
Comments (0)
No varían con el paso del Tiempo. Existen muchas constantes físicas; algunas de las más conocidas son la constante de Planc racionalizada 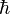 , la constante de gravitación
, la constante de gravitación  , la velocidad de la luz
, la velocidad de la luz  , la permitividad en el vacío
, la permitividad en el vacío 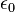 , La constante de estructura fina α, la permeabilidad magnética en el vacío
, La constante de estructura fina α, la permeabilidad magnética en el vacío  y la carga elemental
y la carga elemental  . Todas éstas, por ser tan fundamentales, son llamadas constantes universales.
. Todas éstas, por ser tan fundamentales, son llamadas constantes universales.

Según todos los indicios de los que podemos disponer, si esas constantes hubieran tenido variables, en tan sólo unas simples fracciones infinitesimales de millonésimas, la vida, no habría podido surgir en nuestro planeta.
Muchos han sido los que se han sentido atraídos por las posibles consecuencias biológicas de las teorías cosmológicas en que las “constantes” tradicionales cambian con el paso del tiempo o donde los procesos gravitatorios se despliegan de acuerdo con un reloj cósmico diferente del de los procesos atómicos (¿será precisamente por eso que la relatividad general – el cosmos –, no se lleva bien con la mecánica cuántica – el átomo –?).
La radiactividad natural es el proceso de emisión espontánea de radiaciones por parte de núcleos atómicos inestables, que se fisionan y se transforman en otros núcleos. No hace mucho tiempo que sabemos de ella. Las radiaciones nos llegan de distintas fuentes, estamos constantemente expuestos a radiaciones naturales.
Universos de dos tiempos habían sido propuestos por Milne y fueron las primeras sugerencias de que G podría no ser constante. Unos procesos, como la desintegración radiactiva o los ritmos de interacción molecular, podrían ser constantes sobre una escala de tiempo pero significativamente variables con respecto a la otra. Esto daba lugar a un escenario en el que la bioquímica que sustentaba la vida sólo se hacía posible después de una particular época cósmica, y, algunos, como Haldane, han sugerido que:
“Hubo, de hecho, un momento en el que se hizo posible por primera vez la vida de cualquier tipo, y las formas superiores de vida sólo pueden haberse hecho posibles en una fecha posterior. Análogamente, un cambio en las propiedades de la materia puede explicar algunas de las peculiaridades de la geología precámbrica.”
Este imaginativo escenario no es diferente del que ahora se conoce como “equilibrio interrumpido”, en el que la evolución ocurre en una sucesión discontinua de brotes acelerados entre los que se intercalan largos periodos de cambio lento. Sin embargo, Haldane ofrece una explicación para los cambios.
Lo que tienen en común todas estas respuestas a las ideas de Eddington y Dirac es una apreciación creciente de que las constantes de la naturaleza desempeñan un papel cosmológico vital en el Universo para todo lo que contiene y, sobre todo, para la vida de las estrellas y, también, para la vida de seres como nosotros que, con unas constantes diferentes, simplemente no estaríamos aquí.

El mayor misterio que rodea a los valores de las constantes de la naturaleza es sin duda la ubicuidad de algunos números enormes que aparecen en una variedad de consideraciones aparentemente inconexas. El número de Eddington es un ejemplo notable. El número total de protones que hay dentro del alcance del universo observable esta próximo al número
1080
Si preguntamos ahora por la razón entre las intensidades de las fuerzas electromagnéticas y gravitatoria entre dos protones, la respuesta no depende de su separación, sino que es aproximadamente igual a
1040
Es un misterio. Es bastante habitual que los números puros que incluyen las constantes de la naturaleza difieran de 1 en un factor del orden de 102, ¡pero 1040, y su cuadrado 1080, es rarísimo! Y esto no es todo. Si seguimos a Max Planck y calculamos en valor estimado para la “acción” del universo observable en unidades fundamentales de Planck para la acción, obtenemos.
10120
Existe un lazo entre la estructura del universo en conjunto y las condiciones locales internas que se necesitan para que la vida se desarrolle y persista. Si las constantes tradicionales varían, entonces las teorías astronómicas tienen grandes consecuencias para la biología, la geología y la propia vida.
No podemos descartar la idea ni abandonar la posibilidad de que algunas “constantes” tradicionales de la naturaleza pudieran estar variando muy lentamente durante el transcurso de los miles de millones de años de la historia del universo. Es comprensible por tanto el interés por los grandes números que incluyen las constantes de la naturaleza. Recordemos que Newton nos trajo su teoría de la Gravedad Universal, que más tarde mejora Einstein y que, no sería extraño, en el futuro mejorará algún otro con una nueva teoría más completa y ambiciosa que explique lo grande (el cosmos) y lo pequeño (el átomo), las partículas (la materia) y la energía por interacción de las cuatro fuerzas fundamentales.

Gravitación universal de Isaac Newton.
Aquí, hablamos de lo que pasaría con la vida en caso de que esas constantes universales pudieran variar con el tiempo, y, según todos los indicios, la cosa no pinta nada bien.
La Carga del electrón, la Constante de Planck, la Constante Gravitacional, la masa en reposo del electrón, protón o neutron, o, la velocidad de la luz, se tienen todas por constantes de la naturaleza, es decir, no varían con el paso del tiempo, y, los cálculos que se han realizado en el sentido de una pequeña variación en alguna de ellas, son catastróficas, por ejemplo, si la carga del eletrón, variará, tan solo una diez millónesima, sería más que suficiente para que no se conformaran los átomos y, la materia no podría existir tal como la conocemos y, siendo así (que lo es) ¿qué pasaría con la vida?

Bueno, el cambio de las constantes no es que pusiera el mundo del revés, sino que, simplemente, el mundo tal como lo conocemos, no sería. Igualmente, el Universo sería también distinto y, vaya usted a saber que clase de universos y mundos serían. ¿Un electrón diferente? ¿Qué pasaría con los átomos y la materia, y las estrellas y…nosotros?
El Universo es como es gracias a equilibrios entre fuerzas y, por ejemplo, en un átomo la carga negativa de los electrones es similar a la carga positiva de los protones, y, tal equilibrio de fuerzas hace posible la estabilidad para que se formen y se junten para formar moléculas y materia. En las estrellas, una fuerza, la fusión tienede a expandir a la estrella, otra fuerza, la de Gravedad, tiende a comprimirla, y, de esta manera, aparece el equilibrio necesario para que las estrellas brillen durante miles de millones de años y lancen al espacio interestelar su luz y su calor, creen elementos complejos, y, en su final, hagan que sea posible sembrar de materiales diversos en inmensas nubes la materia primigenia para la vida, y, todo ello, en presencia de las fuerzas fundamentales y las constantes de la naturaleza.
Así que, sería preferible que las constantes de la Naturaleza se queden tal cual. ¿Qué ganaríamos nosotros si cambiaran? ¿Desaparecer? No gracias. Aunque no como quisieramos pero, estamos bien aquí, al menos hay una oportunidad para cambiar las cosas.






Jul
18
¡Siempre queriendo saber!
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en exploración del espacio ~
Clasificado en exploración del espacio ~
 Comments (1)
Comments (1)
Todos los días podemos sorprendernos de los hallazgos y logros de nuestros ingenios que, tanto aquí como en el espacio, están continuamente trabajando para que nosotros conozcamos el Universo y los objetos que lo pueblan. De momento (somos aún muy jóvenes), estamos algo limitados en Ciencia y Tecnología para que, seámos nosotros mismos los que vayamos a buscar esas emocionantes sensaciones in situ. Así que, enviamos a nuestras sondas robóticas para que lo hagan por nosotros que, en la distancia, nos sorprendemos y maravillamos de lo que vamos descubriendo por ahí fuera.

Plutón es un planeta enano del sistema solar, que forma parte de un sistema planetario doble con su satélite Caronte.

“La misión New Horizons (Nuevos Horizontes) es una misión espacial no tripulada de la agencia espacial estadounidense (NASA) destinada a explorar Plutón, sus satélites y probablemente el Cinturón de Kuiper. La sonda fue lanzada desde Cabo Cañaveral el 19 de enero de 2006 tras posponerse por mal tiempo la fecha original de lanzamiento. New Horizons viajó primero hacia Júpiter donde llegó en febrero-marzo de 2007. A su paso por Júpiter aprovechó la asistencia gravitatoria del planeta para incrementar su velocidad relativa unos 4 023,36 m/s (14 484 km/h). Llegará a Plutón en julio de 2015. Tras dejar atrás Plutón, la sonda probablemente sobrevuele uno o dos objetos del Cinturón de Kuiper.
Después de las Voyager 1 y 2 es la sonda con mayor velocidad de lanzamiento desde la Tierra hasta el momento, alcanzando respecto al Sol una velocidad máxima de 15,1km/s. (54 000 km/h aproximadamente.”
Las últimas noticias sobre el proyecto han salido en los medios y, en cualquiera de ellos (pongo el siguiente al azar), podemos leer cosas como estas:
“La nave New Horizons, que salió hacia plutón y que llegará a aquel mundo en 2015, se ha acercado lo suficiente para fotografiar su luna Caronte por primera vez.

Plutón, el objeto más brillante en el centro, y Caronte, más débil cerca de su posición a las once en punto
Lanzada en 2006, la nave espacial New Horizons de la NASA llegará a Plutón en abril de 2015. Cuando sobrevuele este mundo enano, estimará sus contornos, temperatura, composición atmosférica y otras características, además de tomar imágenes de las cinco lunas que lo rodean. En realidad, la sonda ya ha comenzado el trabajo y ha utilizado su cámara telescópica de mayor resolución para fotografiar por primera vez la luna más grande del sistema, Caronte, un mundo cubierto de hielo.

La imagen representa un importante hito en el viaje de nueve años y medio de la nave espacial y, en cierto sentido, inicia el estudio del sistema de Plutón. Caronte orbita a más de 19.000 kilómetros de distancia del propio Plutón. «La imagen en sí misma puede no parecer muy impresionante para el ojo inexperto, pero en comparación con las imágenes del descubrimiento de Caronte desde la Tierra, son fantásticas», afirma el científico del proyecto New Horizons Hal Weaver, de la Universidad Johns Hopkins. «Estamos muy emocionados de ver a Plutón y Caronte como objetos separados por primera vez para New Horizons».
Allí donde se decía
La nave se encontraba todavía a 550 millones de millas de Plutón, una distancia aún mayor que la que separa a la Tierra de Júpiter, cuando su cámara de largo alcance logró un total de seis imágenes: tres el 1 de julio y tres más el 3 de julio. La excelente sensibilidad y resolución espacial del instrumento revelaron que Caronte se encuentra exactamente a la distancia de Plutón anunciada en su descubrimiento hace 35 años.
«Estamos emocionados de tener nuestro primer píxel de Caronte», afirma Alan Stern, «pero dentro de dos años, cuando estemos a punto de la máxima aproximación, tendremos casi un millón de píxeles de Caronte». Además de ser un logro técnico, estas nuevas imágenes ya pueden ayudar a los científicos a conocer algo más sobre las propiedades de la superficie de Caronte y Plutón, quizás la existencia de una capa superpuesta de partículas finas.”
Lo cierto es, amigo míos, que cuando nos empeñamos en alguna cosa y ponemos el punto de mira en algo, más tarde o más temprano lo conseguiremos y, una de las cosas que nos traemos entre manos mes conocer, primero nuestro entorno más cercano (El Sistema solar), y, más tarde, daremos el salto hacia las estrellas.

Plutón, el último y más pequeño de los nueve planetas -ahora planeta enano- del sistema solar, es muy extraño. Ni es un cuerpo rocoso como la Tierra, Marte o Venus, ni un gigante gaseoso como Júpiter o Saturno. Además, sigue una órbita muy elíptica alrededor del Sol, de 248 años, situándose en determinados periodos más cerca de la estrella que de Neptuno. Los astrónomos dudan si realmente es un planeta o un cuerpo del cinturón de Kuiper, la remota región poblada por miles de pequeños cuerpos helados. New Horizons estudiará un mundo único, y por ahora sólo cabe imaginar lo que podremos aprender de él.
El objetivo de la misión, un viejo sueño de la exploración espacial que tardó años en concretarse dadas las dificultades que entrañaba, es pasar muy cerca de Plutón, a sólo 10.000 kilómetros de su superficie, haciendo observaciones científicas durante unos meses para poder saber de él, de lo que es en realidad y de lo que ocurre en sus alrededores. Poco a poco, vamos consiguiendo que las distancias no sean un abstáculo para nosotros.
Plutón es difícil de observar desde la Tierra, por su pequeño tamaño (2.360 kilómetros de diámetro, o dos tercios del de la Luna) y por lo lejos que está (5.900 millones de kilómetros de distancia media del Sol, frente a los 150 millones de kilómetros de distancia de la Tierra al Sol). En el cielo, ese pequeño cuerpo helado con una temperatura de 233 grados bajo cero se ve 50.000 veces más apagado que Marte. Cuando llegue, los instrumentos de la nave New Horizons verán Plutón 10.000 veces mejor que el telescopio Hubble.
Esperémos a ver que nos envía, en 2.015, la nave New Horizons.
emilio silvera
Jul
18
El colapso del núcleo de las estrellas
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Astronomía y Astrofísica ~
Clasificado en Astronomía y Astrofísica ~
 Comments (2)
Comments (2)

En la imagen podemos contemplar lo que se clasifica como NGC 3603, es un cúmulo abierto de estrellas en una vasta región estelar, rodeada de una región H II (una enorme nube de gas y plasma en el que constantemente están naciendo estrellas), situado en el brazo espiral Carina de la Vía Láctea, a unos 20.000 años-luz de distancia en la constelación de Carina. Es uno de los jóvenes cúmulos de estrellas más luminosas e impresionante en la Vía Láctea, y la concentración más densa de estrellas muy masivas conocidas en la galaxia. Se estima que se ha formado hace alrededor de un millón de años. Las estrellas azules calientes en el núcleo son responsables de la fuerte radiación ultravioleta y los vientos estelares, tallando una gran cavidad en el gas.
NGC 3603 alberga miles de estrellas de todo tipo: la mayoría tienen masas similares o menores a la de nuestro Sol, pero las más espectaculares son algunas de las estrellas muy masivas que están cerca del final de sus vidas. Ahí están presentes algunas estrellas supergigantes que se agolpan en un volumen de menos de un año luz cúbico, se han localizado en la misma zona a tres llamadas Wolf-Rayet, estrellas muy brillantes y masivas que expulsan grandes cantidades de material antes de convertirse en supernovas.
Una de estas estrellas (NGC 3603-A1), una estrella doble azul que orbita alrededor de la otra una vez cada 3,77 días, es la estrella más masiva conocida hasta ahora en la Vía Láctea. La más masiva de estas dos estrellas tiene una masa estimada de 116 masas solares, mientras que su compañera tiene una masa de 89 masas solares.

Las estrellas supermasivas cuando colapsan forman extrañas y, a veces, fantásticas imágenes que podemos captar por nuestros más sofisticados telescopios. Hace veinte años, los astrónomos fueron testigos de uno de los más brillantes explosiones estelares en más de 400 años. La supernova titánica, llamada SN 1987A, ardió con la fuerza de 100 millones de soles durante varios meses después de su descubrimiento el 23 de febrero de 1987.
Las observaciones de SN 1987A, hechas en los últimos 20 años por el Telescopio Espacial Hubble de NASA / ESA y muchos otros grandes telescopios terrestres y espaciales, han servido para cambiar la perspectiva que los astrónomos tenían de cómo las estrellas masivas terminan sus vidas.Estudiando estos sucesos desde sus comienzos se pueden ver los detalles más significativos del acontecimiento, cosa que, estuadinado los remanentes de supernovas muy antiguas no se podían ver.

Arriba podemos contemplar observaciones realizadas en distintas fechas que nos muestran la evolución de los anillos de SN 1987 A

El clúster abierto NGC 3603 contiene a Sher 25, una super gigante B1a que inevitablemente morirá en un masivo suceso supernova en los próximos 20,000 años. ¡Esto emitirá una luz tan potente que competirá en el cielo con el planeta Venus! Un detalle muy emocionante es que Sher 25 presenta anillos similares a los que dejó la supernova SN 1987 A.
Cuando colapsa el núcleo de una estrella, como ocurre en la formación de una estrella de neutrones, es preciso que la estrella esté evolucionada hasta el punto de que su núcleo esté compuesto completamente por hierro, que se niega a ser quemado en reacciones nucleares, no se puede producir la fusión y, por tanto, no produce la energía suficiente como para soportar la inmensa fuerza de gravedad que propia masa de la estrella genera y que, solamente era frenada por la energía que produce la fusión nuclear que tiende a expandir la estrella, mientras que la gravedad tiende a contraerla.
El núcleo entonces se contrae, liberando energía potencial gravitatoria, se rompen los núcleos de los átomos de hierro en sus protones y sus neutrones constiituyentes. A medida que aumenta la densidad, los protones se combinan con los electrones para formar neutrones. El colapso sólo se detiene cuando la presión de degeneración del gas de neutrones compensa el empuje hacia adentro de la Gravedad. El proceso completo hasta que se forma la estrella de neutrones dura menos de un segundo.

Otra perspectiva del remanente de la supernova por colapso de núcleo SN 1987A.
Han sido muy variados los grupos de astrónomos investigadores que han realizado observaciones durante largos períodos de tiempo para llevar a cabo la no fácil tarea de comprender cómo se forman las estrellas de neutrones y púlsares cuando estrellas masivas llegan al final de sus vidas y finalizan el proceso de la fusión nuclear, momento en el que -como explicaba antes- la estrella se contrae, implosiona sobre sí misma, se produce la explosión supernova y queda el remanente formado por material más complejo en forma de gases que han sido expulsados por la estrella en este proceso final en el que, las capas exteriores de la estrella, forman una nebulosa y la estrella en sí misma, al contraerse y hacerse más densa, es decir de 1017 kg/m3.
Se ha podido llegar a saber que las supernovas por colapso de núcleo suelen ocurrir en los brazos de galaxias espirales, así como también en las regiones HII, donde se concentran regiones de formación estelar. Una de las consecuencias de esto es que las estrellas, con masas a partir de 8 veces la masa del Sol, son las estrellas progenitoras de estos estos sucesos cósmicos. También es muy interesante y se está estudiando ahora cómo se forman los inmensos campos magnéticos alreddor de estas estrellas de neutrones y púlsares para que se conviertan en magnétares.

Cuando hace unos pocos años se descubrió la estrella de neutrones SGR0418, poco podían pensar los astrónomos que su funcionamiento alteraría todas las teorías existentes hasta ahora acerca del funcionamiento de los magnétares. Sin embargo es así, ya que funciona como uno de éstos y no como sería propio de su condicción. Este hallazgo obliga a la ciencia a replantearse las teorías que se manejaban hasta ahora acerca del origen y evolución de los magnétares.
El “universo” de los procesos que siguen al colapso de los núcleos de las estrellas masivas es fascinante. Así, cuando se forma un púlsar que es una estrella de neutrones que gira sobre sí misma a una gran velocidad y tambien una fuente de ondas de radio que vibran con periodos regulares, este tipo de estrellas tan extrañas son fruto -como antes decía- de una supernova o por consecuencías de la acreción de materia en estrellas enanas blancas en sistemas binarios. Una enana blanca que también es muy masiva, si tiene una estrella compañera cercana, como genera mucha fuerza gravitatoria comienza a tirar del material de la estrella vecina y se lo queda hasta tal punto que, se transforma en una estrella de neutrones en una segunda etapa en la que se producen nuevos procesos de implosión.
La densidad de estas estrellas es increiblemente grande, tanto que un cubo de arena lleno del material de una estrella de neutrones tendría un peso parecido al de la montaña mas grande de la tierra, el monte Everest. Los púlsares fueron descubiertos en 1970 y hasta ahora solo se conece unas 300 estrellas de este tipo. Sin embargo, se calcula que sólo en nuestra Galaxia podrían ser un millón. La rápida rotación de los pùlsares los mantiene fuertemente magnetizados y sus rotaciones vertiginosas generan y son inmensas fuentes de electricidad. Llegan a producir mil millones de millones de voltios. Cuando nustros aparatos los observan y estudian detectan intensos haces de radiación en toda la gama del espectro (radio, luz, rayos X, Gamma).

Imagen de rayos-X en falso color de la región del cielo alrededor de SGR 1627-41 obtenida con XMM-Newton. La emisión indicada en rojo procede de los restos de una estrella masiva que estalló. Cubre una región más extendida de lo que se deducía anteriormente de las observaciones de radio, alrededor del SGR. Esto sugiere que la estrella que estalló fue el progenitor del magnetar. Crédito: ESA/XMM-Newton/EPIC (P. Esposito et al.)
Por ahora se conoce que de cada diez supernovas una se convierte en magnetar, si la supernova posee entre 6 y 12 masas solares, se convierte en una estrella de neutrones de no más de 10 a 20 km de diámetro. En el caso de las estrellas supermasivas de decenas de masas solares, el resultado es muy diferente y nos encontramos con los agujeros negros, esos monstruos del espacio devoradores de materia.

Cuando una estrella supermasiva muere, las consecuencias energéticas son inmensas. Ahí, en esa explosión se producen transiciones de fase que producen materiales pesados y complejos. En una supernova, en orden decreciente tenemos la secuencia de núcleos H, He, O, C, N, Fe, que coincide bastante bien con una ordenación en la tabla periódica de elementos.

La explosión de una estrella gigante y supermasiva hace que esta brille más que la propia galaxia que la acoge y, en su ese tránsito de estrella a púlsar o agujero negro, se forman elementos que, como el oro o el platino, se riegan por el espacio interestelar en las inmensas nebulosas de las que, más tarde, naceran nuevas estrellas y nuevos mundos.
Pero está claro que todo el proceso estelar evolutivo inorgánico nos condujo desde el simple gas y polvo cósmico a la formación de estrellas y nebulosas solares hasta los planetas, la Tierra en particular, en cuyo medio ígneo describimos la formación de las estructuras de los silicatos, desplegándose con ello una enorme diversidad de composiciones, formas y colores, asistiéndose, por primera vez en la historia de la materia, a unas manifestaciones que contrastan con las que hemos mencionado en relación al proceso de las estrellas. Porque, en última instancia, debemos ser conscientes de un hecho cierto: En las estrellas se ¡ “fabrican los materiales que darán lugar al surgir de la vida”!.

Es posible que lo que nosotros llamamos materia inerte, no lo sea tanto, y, puede que incluso tenga memoria que transmite por medios que no sabemos reconocer. Esta clase de materia, se alía con el tiempo y, en cada momento adopta una forma predeterminada y de esa manera sigue evolucionando hasta llegar a su máximo ciclo o nivel en el que, de “materia inerte” llega a la categoría de “materia viva”, y, por el camino, ocupará siempre el lugar que le corresponda. No olvidemos de aquel sabio que nos dijo: “todas las cosas son”. El hombre, con aquellas sencillas palabras, elevó a todas las cosas a la categoría de ¡SER!
¿No os hace pensar que nosotros estemos hechos, precisamente, de lo que llamamos materia inerte?
Claro que, el mundo inorgánico es sólo una parte del inmenso mundo molecular. El resto lo constituye el mundo orgánico, que es el de las moléculas que contienen carbono y otros átomos y del que quedan excluidos, por convenio y características especiales, los carbonatos, bicarbonatos y carburos metálicos, los cuales se incluyen en el mundo inorgánico.
Según expliqué muchas veces, los quarks u y d se hallan en el seno de los nucleones (protones y neutrones) y, por tanto, en los núcleos atómicos. Hoy día, éstos se consideran como una subclase de los hadrones. La composición de los núcleos (lo que en química se llama análisis cualitativo) es extraordinariamente sencilla, ya que como es sabido, constan de neutrones y protones que se pueden considerar como unidades que dentro del núcleo mantienen su identidad. Tal simplicidad cualitativa recuerda, por ejemplo, el caso de las series orgánicas, siendo la de los hidrocarburos saturados la más conocida. Recordad que su fórmula general es CnH2n+2, lo que significa que una molécula de hidrocarburo contiene n átomos de carbono (símbolo C) y (2n+2) átomos de hidrógeno (símbolo H).
Bueno, otra vez, como tantas veces me pasa, me desvío del camino que al principio del trabajo me propuse seguir y me pierdo en las elucubraciones que imaginan mis pensamientos. Mejor lo dejamos aquí.
emilio silvera
Jul
18
Átomos, sustancias, elementos, química…
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Química ~
Clasificado en Química ~
 Comments (3)
Comments (3)
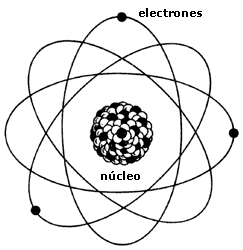
Poco tiempo después resultó evidente que existían otras subpartículas en el interior del átomo. Cuando Becquerel descubrió la radiactividad, identificó como emanaciones constituidas por electrones algunas de las radiaciones emitidas por sustancias radiactivas. Pero también quedaron al descubierto otras emisiones. Los Curie en Francia y Ernest Rutherford en Inglaterra detectaron una emisión bastante menos penetrante que el flujo electrónico. Rutherford la llamó rayos alfa, y denominó rayos beta a la emisión de electrones.
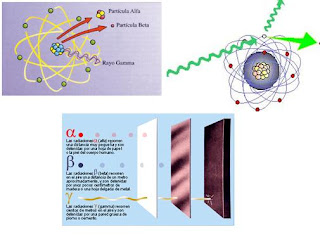
Los electrones volantes constitutivos de esta última radiación son, individualmente, partículas beta. Así mismo, se descubrió que los rayos alfa estaban formados por partículas, que fueron llamadas partículas alfa. Como ya sabemos, alfa y beta son las primeras letras del alfabeto griego y se escriben con los gráficos α y β.

Entretanto, el químico francés Paul Ulrico Villard descubría una tercera forma de emisión radiactiva, a la que dio el nombre de rayos gamma, es decir, la tercera letra del alfabeto griego (γ). Pronto se identificó como una radiación análoga a los rayos X, aunque de menor longitud de onda.
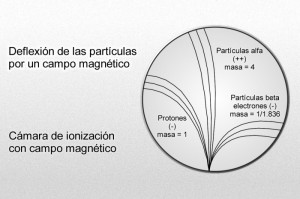
Mediante sus experimentos, Rutherford comprobó que un campo magnético desviaba las partículas alfa con mucho menos fuerza que las partículas beta. Por añadidura, las desviaba en dirección opuesta, lo cual significaba que la partícula alfa tenía una carga positiva, es decir, contraria a la negativa del electrón. La intensidad de tal desviación permitió calcular que la partícula alfa tenía como mínimo una masa dos veces mayor que la del hidrogenión, cuya carga positiva era la más pequeña conocida hasta entonces.

En 1.909, Rutherford pudo aislar las partículas alfa. Puso material radiactivo en un tubo de vidrio fino rodeado por vidrio grueso, e hizo el vacío entre ambas superficies. Las partículas alfa pudieron atravesar la pared fina, pero no la gruesa, lo que dio lugar a que las partículas quedaran aprisionadas entre ambas, y Rutherford recurrió entonces a la descarga eléctrica para excitar las partículas alfa, hasta llevarlas a la incandescencia. Entonces mostraron los rayos espectrales del helio.

Hay pruebas de que laspartículas alfa producidas por sustancias radiactivas en el suelo constituyen el origen del helio en los pozos de gas natural. Si la partícula alfa es helio, su masa debe ser cuatro veces mayor que la del hidrógeno. Ello significa que la carga positiva de éste último equivale a dos unidades, tomando como unidad la carga del hidrogenión.
Más tarde, Rutherford identificó otra partícula positiva en el átomo. A decir verdad, había sido detectada y reconocida ya muchos años antes. En 1.886, el físico alemán Eugen Goldstein, empleando un tubo catódico con un cátodo perforado, descubrió una nueva radiación que fluía por los orificios del cátodo en dirección opuesta a la de los rayos catódicos. La denominó rayos canales.

Part of Astronomy that study physical and chemical characteristics of heavenly bodies. Astrophysics is the most important part of Astronomy at the present time owing to advance of modern physics. Doppler- Fizeau´s effect, Zeeman´s effect, quantum theories and thermonuclear reactions applied to study of heavenly bodies have permitted to discover the solar magnetic field, study stellar radiations and their processes of nuclear fusion, and determine radial velocity of stars, etc. Electromagnetic radiation of heavenly bodies permits to make spectrum analysis of themselves, and they are the principal fountain of information in this part of Astronomy
En 1.902, esta radiación sirvió para detectar por vez primera el efecto Doppler-Fizeau respecto a las ondas luminosas de origen terrestre. El físico alemán de nombre Johannes Stara orientó un espectroscopio de tal forma que los rayos cayeron sobre éste, revelando la desviación hacia el violeta. Por estos trabajos se le otorgó el premio Nobel de Física en 1.919.
Puesto que los rayos canales se mueven en dirección opuesta a los rayos catódicos de carga negativa, Thomson propuso que se diera a esta radiación el nombre de rayos positivos. Entonces se comprobó que las partículas de rayos positivos podían atravesar fácilmente la materia. De aquí que fuesen considerados, por su volumen, mucho más pequeños que los iones corrientes o átomos. La desviación determinada, en su caso, por un campo magnético, puso de relieve que la más ínfima de estas partículas tenía carga y masa similares a los del hidrogenión, suponiendo que este ión contuviese la misma unidad posible de carga positiva.
Por consiguiente se dedujo que la partícula del rayo positivo era la partícula positiva elemental, o sea, el elemento contrapuesto al electrón; Rutherford lo llamó protón (del neutro griego proton, “lo primero”).
Desde luego, el protón y el electrón llevan cargas eléctricas iguales, aunque opuestas; ahora bien, la masa del protón, referida al electrón, es 1.836 veces mayor (como señalo en el gráfico anterior).
Parecía probable pues que el átomo estuviese compuesto por protones y electrones, cuyas cargas se equilibraran entre sí. También parecía claro que los protones se hallaban en el interior del átomo y no se desprendían, como ocurría fácilmente con los electrones. Pero entonces se planteó el gran interrogante: ¿cuál era la estructura de esas partículas en el átomo?
El núcleo atómico

El propio Rutherford empezó a vislumbrar la respuesta. Entre 1.906 y 1.908 (hace ahora un siglo) realizó constantes experimentos disparando partículas alfa contra una lámina sutil de metal (como oro o platino), para analizar sus átomos. La mayor parte de los proyectiles atravesaron la barrera sin desviarse (como balas a través de las hojas de un árbol), pero no todos. En la placa fotográfica que le sirvió de blanco tras el metal, Rutherford descubrió varios impactos dispersos e insospechados alrededor del punto central. Comprobó que algunas partículas habían rebotado. Era como si en vez de atravesar las hojas, algunos proyectiles hubiesen chocado contra algo más sólido. Rutherford supuso que aquella “balas” habían chocado contra una especie de núcleo denso, que ocupaba sólo una parte mínima del volumen atómico y ese núcleo de intensa densidad desviaban los proyectiles que acertaban a chocar contra él. Ello ocurría en muy raras ocasiones, lo cual demostraba que los núcleos atómicos debían ser realmente ínfimos, porque un proyectil había de encontrar por fuerza muchos millones de átomos al atravesar la lámina metálica.
Era lógico suponer, pues, que los protones constituían ese núcleo duro. Rutherford representó los protones atómicos como elementos apiñados alrededor de un minúsculo “núcleo atómico” que servía de centro (después de todo eso, hemos podido saber que el diámetro de ese núcleo equivale a algo más de una cienmilésima del volumen total del átomo).
En 1.908 se concedió a Rutherford el premio Nobel de Química por su extraordinaria labor de investigación sobre la naturaleza de la materia. Él fue el responsable de importantes descubrimientos que permitieron conocer la estructura de los átomos en esa primera avanzadilla.

Desde entonces se pueden describir con términos más concretos los átomos específicos y sus diversos comportamientos. Por ejemplo, el átomo de hidrógeno posee un solo electrón. Si se elimina, el protón restante se asocia inmediatamente a alguna molécula vecina; y cuando el núcleo desnudo de hidrógeno no encuentra por este medio un electrón que participe, actúa como un protón (es decir, una partícula subatómica), lo cual le permite penetrar en la materia y reaccionar con otros núcleos si conserva la suficiente energía.
El helio, que posee dos electrones, no cede uno con tanta facilidad. Sus dos electrones forman un caparazón hermético, por lo cual el átomo es inerte. No obstante, si se despoja al helio de ambos electrones, se convierte en una partícula alfa, es decir, una partícula subatómica portadora de dos unidades de carga positiva.

Con tres electrones, el litio es el elemento sólido más ligero
Hay un tercer elemento, el litio, cuyo átomo tiene tres electrones. Si se despoja de uno o dos, se transforma en ión, y si pierde los tres, queda reducida a un núcleo desnudo, con una carga positiva de tres unidades.
Las unidades de carga positiva en el núcleo atómico deben ser numéricamente idénticas a los electrones que contiene por norma, pues el átomo suele ser un cuerpo neutro, y esta igualdad de lo positivo con lo negativo es el equilibrio. De hecho, los números atómicos de sus elementos se basan en sus unidades de carga positiva, no en las de carga negativa, porque resulta fácil hacer variar el número de electrones atómicos dentro de la formación iónica, pero en cambio se encuentran grandes dificultades si se desea alterar el número de sus protones.
Apenas esbozado este esquema de la construcción atómica, surgieron nuevos enigmas. El número de unidades con carga positiva en un núcleo no equilibró, en ningún caso, el peso nuclear ni la masa, exceptuando el caso del átomo de hidrógeno. Para citar un ejemplo, se averiguó que el núcleo de helio tenía una carga positiva dos veces mayor que la del núcleo de hidrógeno; pero como ya se sabía, su masa era cuatro veces mayor que la de este último. Y la situación empeoró progresivamente a medida que se descendía por la tabla de elementos, e incluso cuando se alcanzó el uranio, se encontró un núcleo con una masa igual a 238 protones, pero una carga que equivalía sólo a 92.

¿Cómo era posible que un núcleo que contenía cuatro protones (según se suponía el núcleo de helio) tuviera sólo dos unidades de carga positiva? Según la más simple y primera conjetura emitida, la presencia en el núcleo de partículas cargadas negativamente y con peso despreciable neutralizaba dos unidades de carga. Como es natural, se pensó también en el electrón. Se podría componer el rompecabezas si se suponía que en núcleo de helio estaba integrado por cuatro protones y dos electrones neutralizadores, lo cual deja libre una carga positiva neta de dos, y así sucesivamente, hasta llegar al uranio, cuyo núcleo tendría, pues, 238 protones y 146 electrones, con 92 unidades libres de carga positiva. El hecho de que los núcleos radiactivos emitieran electrones (según se había comprobado ya, por ejemplo, en el caso de las partículas beta), reforzó esta idea general. Dicha teoría prevaleció durante más de una década, hasta que por caminos indirectos, llegó una respuesta mejor como resultado de otras investigaciones.

Pero entre tanto se habían presentado algunas objeciones rigurosas contra dicha hipótesis. Por lo pronto, si el núcleo estaba constituido esencialmente de protones, mientras que los ligeros electrones no aportaban prácticamente ninguna contribución a la masa, ¿cómo se explicaba que las masas relativas de varios núcleos no estuvieran representadas por número enteros? Según los pesos atómicos conocidos, el núcleo del átomo cloro, por ejemplo, tenía una masa 35’5 veces mayor que la del núcleo de hidrógeno. ¿Acaso significaba esto que contenía 35’5 protones? Ningún científico (ni entonces ni ahora) podía aceptar la existencia de medio protón.
Este singular interrogante encontró una respuesta incluso antes de solventar el problema principal, y ello dio lugar a una interesante historia.
Isótopos; construcción de bloques uniforme,
Allá por 1.816, el físico inglés William Prout había insinuado ya que el átomo de hidrógeno debía entrar en la constitución de todos los átomos. Con el tiempo se fueron desvelando los pesos atómicos, y la teoría de Prout quedó arrinconada, pues se comprobó que muchos elementos tenían pesos fraccionarios (para lo cual se tomó el oxígeno, tipificado al 16). El cloro, según dije antes, tiene un peso atómico aproximado de 35’5, o para ser exactos, 35’457. otros ejemplos son el antimonio, con un peso atómico de 121’75, el galio con 137’34, el boro con 10’811 y el cadmio con 112’40.

Hacia principios de siglo se hizo una serie de observaciones desconcertantes, que condujeron al esclarecimiento. El inglés William Crookes (el del tubo Crookes) logró disociar del uranio una sustancia cuya ínfima cantidad resultó ser mucho más radiactiva que el propio uranio. Apoyándose en su experimento, afirmó que el uranio no tenía radiactividad, y que ésta procedía exclusivamente de dicha impureza, que él denominó uranio X. Por otra parte, Henri Becquerel descubrió que el uranio purificado y ligeramente radiactivo adquiría mayor radiactividad con el tiempo, por causas desconocidas. Si se deja reposar durante algún tiempo, se podía extraer de él repetidas veces uranio activo X. Para decirlo de otra manera, por su propia radiactividad, el uranio se convertía en el uranio X, más radiactivo aún.
Por entonces, Rutherford, a su vez, separó del torio un torio X muy radiactivo, y comprobó también que el torio seguía produciendo más torio X. Hacia aquellas fechas se sabía ya que el más famoso de los elementos radiactivos, el radio, emitía un gas radiactivo, denominado radón. Por tanto, Rutherford y su ayudante, el químico Frederick Soddy, dedujeron que durante la emisión de sus partículas los átomos radiactivos se transformaron en otras variedades de átomos radiactivos.
El material radiactivo llega a producir mutaciones.
Varios químicos que investigaron tales transformaciones lograron obtener un surtido muy variado de nuevas sustancias, a las que dieron nombres tales como radio A, radio B, mesotorio I, mesotorio II y actinio C. Luego los agruparon todos en tres series, de acuerdo con sus historiales atómicos. Una serie se originó del uranio disociado; otra del torio, y la tercera del actinio (si bien más tarde se encontró un predecesor del actinio, llamado protactinio).
En total se identificaron unos cuarenta miembros de esas series, y cada uno se distinguió por su peculiar esquema de radiación. Pero los productos finales de las tres series fueron idénticos: en último término, todas las cadenas de sustancias conducían al mismo elemento, el plomo.
Ahora bien, esas cuarenta sustancias no podían ser, sin excepción, elementos disociados. Entre el uranio (92) y el plomo (82) había sólo diez lugares en la tabla periódica, y todos ellos, salvo dos, pertenecían a elementos conocidos.
Hay que huir de los desechos radiactivos que causan la actividad del hombre
En realidad, los químicos descubrieron que aunque las sustancias diferían entre sí por su radiactividad, algunas tenían propiedades químicas idénticas. Por ejemplo, ya en 1.907 los químicos americanos Herbert Newby McCoy y W. H. Ross descubrieron que el radiotorio (uno entre los varios productos de la desintegración del torio) mostraba el mismo comportamiento químico que el torio, y el radio D, el mismo que el plomo, tanto que a veces era llamado radioplomo. De todo lo cual se infirió que tales sustancias eran en realidad variedades de mismo elemento: el radiotorio, una forma de torio; el radioplomo, un miembro de una familia de plomos; y así sucesivamente.
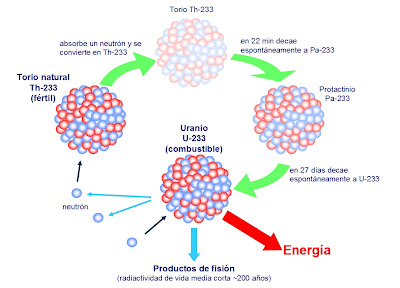
En 1.913, Soddy esclareció esta idea y le dio más amplitud. Demostró que cuando un átomo emitía una partícula alfa, se transformaba en un elemento que ocupaba dos lugares más abajo en la lista de elementos, y que cuando emitía una partícula beta, ocupaba, después de su transformación, el lugar inmediatamente superior. Con arreglo a tal norma, el radiotorio descendía en la tabla hasta el lugar del torio, y lo mismo ocurría con las sustancias denominadas uranio X y uranio Y, es decir, que los tres serían variedades del elemento 90. Así mismo, el radio D, el radio B, el torio B y el actinio B compartirían el lugar del plomo como variedades del elemento 82.

Soddy dio el nombre de isótopos (del griego iso y topos, “el mismo lugar”) a todos los miembros de una familia de sustancias que ocupaban el mismo lugar en la tabla periódica. En 1.921 se le concedió el premio Nobel de Química.
El modelo protón–electrón del núcleo concordó perfectamente con la teoría de Soddy sobre los isótopos. Al retirar una partícula alfa de un núcleo, se reducía en dos unidades la carga positiva de dicho núcleo, exactamente lo que necesitaba para bajar dos lugares en la tabla periódica. Por otra parte, cuando el núcleo expulsaba un electrón (partícula beta), quedaba sin neutralizar un protón adicional, y ello incrementaba en una unidad la carga positiva del núcleo, lo cual era como agregar una unidad al número atómico, y por tanto, el elemento pasaba a ocupar la posición inmediatamente superior en la tabla periódica de los elementos. ¡Maravilloso!

¿Cómo se explica que cuando el torio se descompone en radiotorio después de sufrir no una, sino tres desintegraciones, el producto siga siendo torio? Pues bien, en este proceso el átomo de torio pierde una partícula alfa, luego una partícula beta, y más tarde una segunda partícula beta. Si aceptamos la teoría sobre el bloque constitutivo de los protones, ello significa que el átomo ha perdido cuatro electrones (dos de ellos contenidos presuntamente en la partícula alfa) y cuatro protones. (La situación actual difiere bastante de este cuadro, aunque en cierto modo, esto no afecta al resultado).
El núcleo de torio constaba inicialmente (según se suponía) de 232 protones y 142 electrones. Al haber perdido cuatro protones y otros cuatro electrones, quedaba reducido a 228 protones y 138 electrones. No obstante, conservaba todavía el número atómico 90, es decir, el mismo de antes.

El torio en estado natural
Así pues, el radiotorio, a semejanza del torio, posee 90 electrones planetarios, que giran alrededor del núcleo. Puesto que las propiedades químicas de un átomo están sujetas al número de sus electrones planetarios, el torio y el radiotorio tienen el mismo comportamiento químico, sea cual fuere su diferencia en peso atómico (232 y 228 respectivamente).
Los isótopos de un elemento se identifican por su peso atómico, o número másico. Así, el torio corriente se denomina torio 232, y el radiotorio, torio 228. Los isótopos radiactivos del plomo se distinguen también por estas denominaciones: plomo 210 (radio D), plomo 214 (radio B), plomo 212 (torio B) y plomo 211 (actinio B).

Se descubrió que la noción de isótopo podía aplicarse indistintamente tanto a los elementos estables como a los radiactivos. Por ejemplo, se comprobó que las tres series radiactivas anteriormente mencionadas terminaban en tres formas distintas de plomo. La serie del uranio acababa en plomo 206, la del torio en plomo 208 y la del actinio en plomo 207. cada uno de estos era un isótopo estable y corriente del plomo, pero los tres plomos diferían por su peso atómico.
Mediante un dispositivo inventado por cierto ayudante de J. J. Thomson, llamado Francis William Aston, se demostró la existencia de los isótopos estables. En 1.919, Thomson, empleando la versión primitiva de aquel artilugio, demostró que el neón estaba constituido por dos variedades de átomos: una cuyo número de masa era 20, y otra con 22. El neón 20 era el isótopo común; el neón 22 lo acompañaba en la proporción de un átomo cada diez. Más tarde se descubrió un tercer isótopo, el neón 21, cuyo porcentaje en el neón atmosférico era de un átomo por cada 400.

distintos isótopos
Entonces fue posible, al fin, razonar el peso atómico fraccionario de los elementos. El peso atómico del neón (20, 183) representaba el peso conjunto de los tres isótopos, de pesos diferentes, que integraban el elemento en su estado natural. Cada átomo individual tenía un número másico entero, pero el promedio de sus masas (el peso atómico) era un número fraccionario.
Aston procedió a mostrar que varios elementos estables comunes eran, en realidad, mezclas de isótopos. Descubrió que el cloro, con un peso atómico fraccionario de 35’453, estaba constituido por el cloro 35 y el cloro 37, en la proporción de cuatro a uno. En 1.922 se le otorgó el premio Nobel de Química.
En el discurso pronunciado al recibir el premio, Aston predijo la posibilidad de aprovechar la energía almacenada en el núcleo atómico, vislumbrando ya las futuras y nefastas bombas y centrales nucleares. Allá por 1.935, el físico canadiense Arthur Jeffrey Dempster empleó el instrumento de Aston para avanzar sensiblemente en esa dirección; demostró que 993 de cada 1.000 átomos de uranio eran de uranio 238 (no válido para combustible nuclear). Y muy pronto se haría evidente el profundo significado de tal descubrimiento.

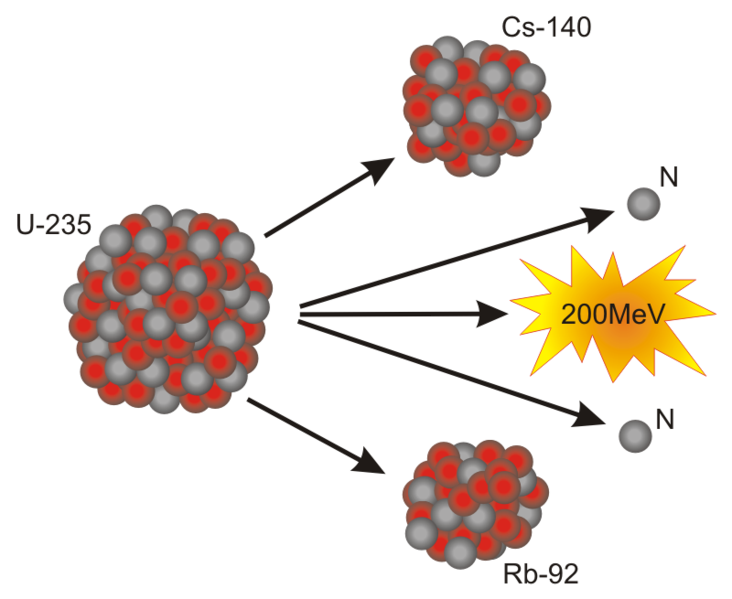
Sí, sólo el 7 por 1000 del uranio existente en la Tierra, es combustible nuclear, es decir, Uranio 235. El resto, es Uranio 238 que hay que reciclarlo en un Acelerador Generador para convertirlo en Plutonio 239 que nos sirva como combustible nuclaer de fisión.
Así, después de estar siguiendo huellas falsas durantes un siglo, se reivindicó definitivamente la teoría de Prout. Los elementos estaban constituidos por bloques estructurales uniformes; si no átomos de hidrógeno, sí, por lo menos, unidades con masa de hidrógeno.
¿Qué no será capaz de inventar el hombre para descubrir los misterios de la naturaleza?
emilio silvera
















 Totales: 74.830.947
Totales: 74.830.947 Conectados: 86
Conectados: 86