Jun
23
Física: Una clase sencilla
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Física ~
Clasificado en Física ~
 Comments (0)
Comments (0)

Hablar de una Naturaleza simétrica sería condenar a nuestro Universo a la monotonía de la igualdad, y, todos sabemos que en él se encuentra todo lo que existe, la Materia, el Tiempo y el Espacio, todo ello acompañado por fuerzas que hacen de nuestro universo el que conocemos y, dentro de toda esa inmensidad, también se encuentran la simetría y la asimetría, en nuestro mundo el día y la noche. La riqueza de la diversidad que conforma ese todo que el Universo es.
La exploración de la simetría y la asimetría en la Naturaleza comenzaba con el mayor de los objetos naturales: ¡El propio Universo! Y, hemos ido reduciendo gradualmente la escala de tamaños con estructuras cada vez más pequeñas. En otras ocasiones hemos tenido aquí mismo la oportunidad de hablar de la simetría que encontramos en la Naturaleza de las plantas y de los animales. , desvíamos nuestra atención hacia estructuras todavía menores, las diversas subunidades que constituyen todas las sustancias materiales, vivas o inertes.
de continuar y para aquellos que lo puedan desconocer, será conveniente que tengan una conciencia clara de qué son exactamente estas unidades inferiores. Comenzando con las más pequeñas y yendo después en sentido ascendente, la escala sería:

Las partículas elementales que están descritas en el Modelo estándar actual de la física de partículas que conforman la materia y las fuerzas con las que interaccionan y que, donde hemos podido saber, están divididas en familias:

Leptones: partículas puntuales con una dimensión espacial inapreciable. Los seis leptones conocidos son el electrón, el muón y el tauón, y el neutrino asociado a uno de ellos, el neutrino electrónico, muónico y tauónico.
Hadrones: Son aquellas partículas que se cree que están compuestas de pequeñas partículas puntuales llamadas quarks. Se han identificado cientos de hadrones, de los cuales los más importantes son el protón y el neutrón, ya que junto con el electrón forman la materia ordinaria.
Bosones: Partículas de “cambio”, partículas “soporte”, partículas “mensajeras” o partículas “indicadoras”. Contienen o son intermediarias de las cuatro fuerzas: electromagnetismo (conducido por el fotón), la fuerza débil (conducida por los vectores bosones intermedios), la gran fuerza nuclear (por los gluones) y la gravedad (por el gravitón aún no detectado). A finales de lños años setenta, las fuerzas elecdtromagnética y débil se unificaron en lo que llamamos la fuerza electrodébil. La teoría electrodébil predice un bosón masivo denominado partícula de Higgs que, también estamos tratando de “cazar”.
Representación de los tres bosones intermediarios en la fuerza electrodébil
Una vez descritas, muy someramente, las partículas de la materia y las fuerzas que rigen el universo conocido, tendríamos que pasar, de inmediato, al paso próximo que estaría representado por el átomo que, hasta donde conocemos, es la menor unidad estructural en la que dividirse la materia sin que pierda sus propiedades. En el centro de todo átomo está el núcleo, que debe contener al menos un protón, pero habitualmente está formado por una mezcla de protones y neutrones. Alrededor del núcleo, agrupados en “capas”, están los electrones. El átomo más sencillo, el de Hidrógeno, un núcleo con un protón, alrededor del cual se mueve un único electrón. El átomo más complejo que se ha encontrado en la Naturaleza es el del Uranio, con 92 electrones. En el laboratorio se han encontrado algunos elementos más complejos a los que se llaman transuránicos, es decir, que van más allá del uranio y que no se encuentran en la Naturaleza, son artificiales.
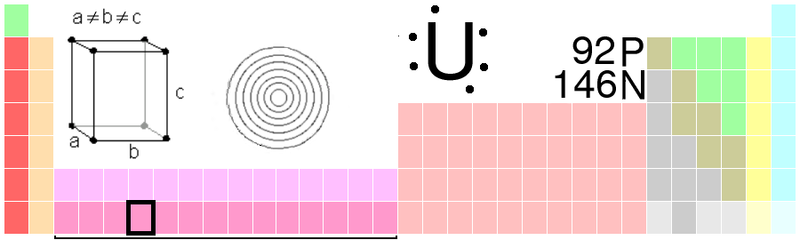
Como podéis ver, el Uranio tiene 92 Protones y 146 Neutrones. Para equilibrar el átomo, el de eletrones es también de 92, ya que al tener el elecdtrón, carga negativa equivalente a la carga positiva del protón, se consigue el equilibrio entre ambas y se alcanza la estabilidad, es decir, que el átomo sea neutro. Si un átomo pierde un electrón de su capa más externa se convierte en un átomo con carga positiva. Si gana uno, queda con carga negativa. Los átomos con carga eléctrica reciben el de iones.


La molécula es una agrupación ordenada de átomos y constituye la mínima unidad de un elemento que puede subsistir de manera independiente. Mediante la afinidad química, los átomos están capacitados se unen entre sí y forman moléculas, que tienen un tamaño de alrededor de un millonésimo de milímetro. La afinidad de los átomos depende de la cantidad de electrones que giren alrededor del núcleo. Los átomos que tienen en la órbita externa ocho electrones no se unen a ningún otro elemento, dado que se encuentran equilibrados; estos constituyen los llamados gases nobles: helio, neón, argón, criptón, xenón y radón. Los demás átomos tratan de completar el número de ocho electrones hasta configurarse como los gases nobles. Es decir, los que tienen un electrón se combinan con los que tienen siete electrones.
Muchas son ya las moléculas de la vida ahí encontradas. Si una sustancia está formada por un único tipo de átomos, diremos que es un elemento. Cuando una molécula está formada por átomos de distintos tipos, la sustancia se llama compuesto. El agua es un compuesto: su molécula consta de dos átomos de hidrógeno unidos por un enlace químico (electromagnético) a un átomo de oxígeno. El número de átomos que constiruyen la molécula de un compuesto puede variar dos o tres hasta las decenas de miles que conforman la molécula de un complejo proteínico.

Si miramos imagen de visión de rayos X de un cristal de hielo que tiene simetría exagonal, es la equivalente a multiplicar el original por 100000000. Los átomos de oxíogeno se representan como bolas rojas y los de Hidrógeno como bolas azules más pequeñas. Todos los enlaces entre estos átomos se representan como barras blancas para resaltar la red hexagonal en de colmena que forma el conjunto de moléculas de H2O.
En el agua líquida también hay molécuklas de H2O, pero en ese caso se encuentran más calientes que en el hielo. Lo que significa que se mueven mñás libremente y de hecho esa es la razón de que el agua sea un líquido sin forma propia y se adapta al recipiente que lo contiene. Pero si el agua se congela, las fuerzas de interacción entre las moléculas de H2O ganan a las fuerzas derivadas del movimiento térmico y forman un conjunto rígido que presenta su más estable (de menor energía) cuando se ordenan… precisamente con simetría Hexagonal.
Por eso los cristales de nieve son siempre hexagonales. La estructura de los cristales a nivel atómico determina su forma final. Y este no es un ejemplo aislado. La composición y la estructura a nivel atómico y molecular es la clave que determina la estructura, dureza y demás propiedades en general de todos los materiales que nos rodean. Hasta aquí llegan las escalas de estructuras básicas.

Naturalmente, podemos hablar de unidades todavía mayores, como los minerales y las rocas. Un mineral es, simplemente un elemento o un compuesto en estado sólido que se encuentra en la Naturaleza y que no es el resultado de un proceso biológico; pero si un mineral presenta una, se trata de una estructura cristalina derivada de la colocación de sus moléculas. Las rocas son, sencillamente, mezclas de uno o más minerales diferentes. Como sabemos, las rocas presentan a veces algún de dibujo , como los estratos horizontales de las rocas sedimentarias, pero el trazado es de tan bajo nivel que no se piueden llegar a tomar en consideración cuestiones de simetría como las que antes hemos referido.

Una vez dicho y explicado todo lo anterior, parece que podemos hablar de la simetría especular. Si comenzamos por la parte más alta de la escala, con la estructura de los cristales y seguir bajando por dicha escala la selva subatómica de las partículas elementales. Sólo los sólidos tienen estructura cristalina. Las moléculas de un gas están tan alejadas las unas de las otras que tienen la libertad de moverse al azar, y es imposible encontrar un modelo geométrico sistemático en su disposición. Os acordáis las formas arabescar de increíble belleza que adoptan, los gases en algunas Nebulosas.

Los fullerenos podrían ser los responsables de haber llevado a la Tierra sustancias capaces de impulsar el inicio de la vida. Los científicos han podido encontrar moléculas de fullerenos en las nubes espaciales que podrían ser, las precursorasa de la vida.

Si hablamos de las moléculas de un líquido, asl contrario de lo que ocurre con las moléculas de los gases, éstas están más juntas y próximas entre ellas, pero todavía son lo suficientemente libres en sus movimientos como para que no se puedan formar modelos fijos. Los sólidos, por otra , tienen moléculas que se aprietan estrechamente entre sí para poder crear una estructura rígida y estable. (En realidad, los átomos de un sólido siguen oscilando, pero las fuerzas electromagnéticas las enlazan tan estrechamente que sus oscilaciones son practicamente posiciones fijas. Para nuestro propósito supondremos que los átomos no tienen movimiento alguno.) En casi todos los casos se estereotipa esta dispoosición sistemática, que constituye la estructura cristalina del sólido.

El agua en sus tres estados: hielo, agua líquida y vapor en las nubes
Consideremos el agua. Tanto en su estado gaseoso (vapor) como líquido, sus moléculas están en una disposición caótica, pero cuando se hiela y pasa al estado sólido, las moléculas se agrupan entre sí en forma de figuras geométricas. El bello cristal de nieve, con simetría hexagonal, como el dibujo de un caleidoscopio, toma su forma directamente d ela forma cristalina subyacente de las moléculas de hielo de su a los gigantescos Icebergs del Ártico, todos tienen la misma estructura cristalina.
Casi todas las sustancias sólidas son cristalinas, aunque el vidrio es una excepción sobresaliente; se origina al enfriarse determinados líquidos de manera tan rápida que las moléculas se agrupan estrechamente antes de tener la menor opción a disponerse de ordenada. Sólido o no no, un cristal no es cristalino. El vidrio tallado de un bello jarrón que es “crista” para el dependiente de la tienda, no es cristal para el físico.

¿Quién puede creer en esto a estas alturas?
Las pitonisas que utilizan esferas pulidas procedentes de grandes cristales de cuarzo simples para predecir el futuro mirando a su través, hoy en día lo hacen a menudo a través de esferas de vidrio, puesto que son más baratas. Sería interesante saber si el futuro parece más claro mirándolo por un material en desorden o bien a través de una estructura ordenada.
Los sólidos no cristalinos se llaman amorfos; algunos químicos hablan de ellos como sólidos líquidos ya que, igual que éstos últimos, , carecen de estructura cristalina. El , las breas y ciertos plásticos, son ejemplos familiares, sustancias que participan con los líquidos en la tendencia a “fluir”, aunque la capacidad de flujo puede ser extremadamente lenta. Incluso el vidrio acabaría fluyendo fuera de su forma si no se tocara durante algunos cientos de años.
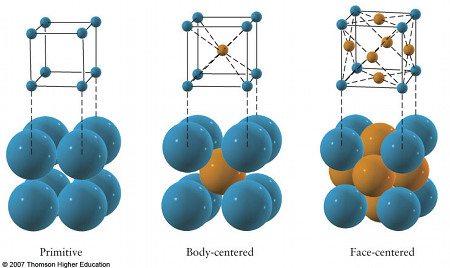

La forma geométrica subyacente de cualquier sustancia cristalina se denomina la red de la misma. Unas veces es una configuración de átomos; otras de moléculas. El dióxido de Carbono, por ejemplo, se encuentra en la naturaleza en forma de gas; cuando su temperatura disminuye lo suficiente, se solidifica y se convierte en lo que se llama hielo seco. (Recibe el de seco porque nunca se convierte en líquido, como el hielo ordinario; pasa directamente de sólido a gas.) En él, las moléculas de dióxido de carbono se agrupan entre sí formando la red cúbica con estructura semejante a las vigas de acero de un edificio de oficinas. Las moléculas situadas en las caras de cada cubo dan a esta red concreta el nombre de red cúbica de caras centradas, es decir, así:

Aquí, unidad es una molécula de Dióxido de Carbono.


La sal es uno de los minerales que más abunda en la Tierra. Su nomenclatura química, Cloruro de Sodio, se debe a sus dos iones componentes: cloro y sodio. La estructura de este compuesto, es un cristal con de cubo, en la que los átomos de cloro y sodio, dispuestos alternadamente, forman una red cúbica que se va repitiendo con la misma orientación en toda la sustancia, formando una red cristalina.
La sal no sólo sirve sazonar. Sus iones son fundamentales para la transmisión de impulsos nerviosos, para los latidos del corazón, para la contracción muscular y para desencadenar una respuesta inmune. ¡La próxima vez que aliñen una ensalada, piensen en esto!

No se debe pensar que, por estar por debajo del campo de visión de un microscopio, estas estructuras reticulares no son sino construcciones teóricas que los físicos no han sido capaces de observar. Hubo un tiempo en que esto era así, en la actualidad existen muchas técnicas que permiten “ver” estructuras mucho más pequeñas que las que pueden ser vistas directamente.
Hemos podido alcanzar a “ver” objetos y figuras estacionadas en esas distancias infinitesimales, nuestros ingenios tecnológicos pueden aumentar, en millones de veces, las proporciones físicas de pequeños objetos y sistemas. Hasta tal punto es así que, si pudiéramos tener delante de nuestros ojos lo que esos experimentos han logrado, nos parecería estar, en un mundo diferente, tan extraña y figuras podríamos contemplar en ese ámbito de lo muy pequeño.
Descendiendo muchísimo en la escala y si consideramos las moléculas como unidades individuales, completamente diferenciadas en los que puedan estar sumergidasa, ¿tienen siempre una estructura simétrica? Si es así, cuando un compuesto dse halla en la Naturaleza o bien se crea en el laboratorio, sus moléculas serán siempre iguales y el compuesto tendrá siempre las mismas propiedades, pero si una molécula está formada por una estructura asimétrica de átomos, sería posible encontrar, o crear en el laboratorio, dos formas completamente distintas del mismo compuesto. Una de ellas contrendría exclusivamente moléculas orientadas la derecha; la otra, moléculas orientadas hacia la izquierda. Las dos imágenes serían la imagen especular de las de la otra.

Una molécula con n estereocentros un máximo de 2n estereoisómeros.
Me gustaría contaros aquí y en este momento, la sensacional historia del descubrimiento de los esteroisómeros pero, no teniendo mucho espacio para finalizar el , lo dejaré para otra ocasión. Digamos, sin embargo que, el descubrimiento de las moléculas con orientación iaquierda o derecha comenzó en Francia durante la primera parte del siglo XIX. Jean Baptiste Biot, un renombrado físico y químico francés, había descubierto la propiedad de los cristales de cuarzo de desviar un plano de luz polarizada. Una sustancia que tenga esa propiredad se dice que es ópticamente activa.
Bueno amigos lectores, no siempre tenemos que hablar de grandes galaxias y espacios inconmensurables, y, de vez en cuando, conviene a las profundidades del “universo infinitesimal” en el que viven partículas, átomos y moléculas que, como todo en la Naturaleza están sometidas a una serie de leyes que rigen sus comportamientos y, conocerlos, saber lo que allí pueda pasar, es bastante lucrativo para poder aplicar, dichos conocimientos a este mundo macroscópico nuestro y saber, por qué ocurren ciertas cosas en nuestro “gran mundo”.
Ya sabéis: ¡Todo lo grande está hecho de cosas pequeñas!
emilio silvera
Jun
23
Noticias
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en General ~
Clasificado en General ~
 Comments (2)
Comments (2)

La Organización Europea para la Investigación Nuclear (CERN) ha confirmado haber encontrado un hadrones-exoticos-401397119681#”>tipo de partícula muy rara, bautizada como Z(4430). Se trata de una partícula subatómica pero que no coincide con ninguna de las dos categorías existentes de hadrones. Se trata de un hadrón exótico.
de partícula muy rara, bautizada como Z(4430). Se trata de una partícula subatómica pero que no coincide con ninguna de las dos categorías existentes de hadrones. Se trata de un hadrón exótico.
Según las evidencias presentadas por el CERN, esta partícula tiene una masa de aproximadamente cuatro veces la del protón, por lo que no encaja en el esquema tradicional de partículas (ni bariones ni mesones), ya que este “hadrón exótico” hadrones-exoticos-401397119681#”>cuenta con al menos cuatro quarks, dos quarks y dos antiquarks.
con al menos cuatro quarks, dos quarks y dos antiquarks.
Para llegar a esta confirmación, los investigadores del LHCb analizaron más de 25.000 desintegraciones de mesones B, cuyos hadrones-exoticos-401397119681#”>datos indicaban que Z(4430) es un estado cuántico, una partícula auténtica y, con un nivel de significancia estadística cercano a 14 sigma (la evidencia de que se trata de una verdadera observación y no el resultado de algún error en la medida).
indicaban que Z(4430) es un estado cuántico, una partícula auténtica y, con un nivel de significancia estadística cercano a 14 sigma (la evidencia de que se trata de una verdadera observación y no el resultado de algún error en la medida).
Registran la masa atómica más precisa del electrón

Un equipo de científicos liderado desde el Instituto Max Planck de Física Nuclear ha conseguido un hito en esta materia: la cifra más precisa hasta ahora conseguida de la masa atómica del electrón. Los resultados del estudio han sido publicados en la revista Nature.
El valor, 0,000548579909067 (unos 9,109 x 10 elevado a -28 gramos) es 13 veces más preciso que la anterior medición que se realiza en unidades de masa atómica unificada. nueva medida permitirá profundizar en el modelo estándar de la física y abrirá las puertas a una “nueva física” ya que este dato, es crucial por ser el responsable de la estructura de los átomos y sus propiedades.
Para conseguir esta nueva y precisa medida, los investigadores utilizaron una triple trampa de Penning, un dispositivo para el almacenamiento de partículas cargadas mediante campos magnéticos y eléctricos, además de utilizar como base teórica la electrodinámica cuántica.
“El valor para la masa atómica del electrón es un eslabón en una cadena de medidas que permitirá hacer un test del modelo estándar de la física de partículas con una precisión superior a una parte por trillón, además del impacto que tiene en los de otras constantes fundamentales”, destaca el investigador Edmund G. Myers, de la Universidad Estatal de Florida (EEUU).

Tras 80 años de ensayos, un equipo de físicos del Imperial College London (Reino Unido) ha descubierto la de crear materia a partir de la luz. Este hallazgo supone un hito en física: probar la realidad de una teoría formulada en 1934 por los científicos Breit y Wheeler.
Ambos físicos sugirieron que debería ser posible convertir la luz en materia mediante la destrucción simultánea de dos partículas de luz (fotones) para crear un electrón y un positrón, lo que suponía desde entonces el método más simple de convertir la luz en materia. , esta teoría es una realidad gracias a la demostración realizada en el Imperial College London y que ha sido publicada en la revista Nature Photonics.
El estudio habla de un experimento de física de alta energía que podría explicar algunos de los misterios más grandes de la física aún sin resolver, como el proceso de origen del universo, en una de las maneras más simples en las que la luz y la materia pueden interactuar.
“A pesar de que todos los físicos aceptan que la teoría es verdad, cuando Breit y Wheeler la propusieron por primera vez, me dijeron que no esperaban que se mostrara en el laboratorio en la actualidad; casi 80 años más tarde, demostramos que estaban equivocados”, afirma Steve Rose, del Departamento de Física del Imperial College y coautor del estudio.
Fuente: En la Revista Muy Interesante.
















 Totales: 75.427.762
Totales: 75.427.762 Conectados: 65
Conectados: 65





















