Mar
2
¡Mi Hija María!
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Mi hija María ~
Clasificado en Mi hija María ~
 Comments (5)
Comments (5)
Integrantes del Grupo de Música de Cámara: ZELENKA
Jorge Uribe Moreno, Oboista
Después de más de 17 años viviendo y trabajando en Europa, (Alemania, Suiza y España) decide regresar a México en donde actualmente es profesor de Oboe, en la Escuela Superior de Música y del Conservatorio Nacional de México.
Fue director artístico y Oboe principal de la “Filharmònica de Cambra de Catalunya” y ha colaborado con diversas formaciones como: La Sinfónica del Valles, Orquesta de Cámara de Zúrich, La Orquesta Tonhalle de Zúrich, La Rias Jugend Orchester Berlín, Orquesta Sinfónica del Estado de México, La Orquesta del Gran Teatro del Liceo, Filarmónica de Querétaro, Orquesta Sinfónica de Sinaloa de las Artes, Orquesta de Cámara de Bellas Artes entre otras.
Ha realizado estudios de Oboe bajo la dirección de destacados Solistas Internacionales, como: Christoph Hartmann (Filarmonica de Berlin) Emmanuel Abbuehl y Louise Pellerin (Suiza) y Oboe barroco con Paolo Grazzi. Y en Mexico con Antonio Sanchiz, Robert Weiner y Marcia Yount.
Formo parte de la Academia del Gran Teatro del Liceo en donde recibió la asesoría de Oboístas como Francesc Castello y Emili Pascual. Su actividad profesional lo ha llevado a presentarse en diferentes países como: Alemania, México, Suiza, Polonia, Italia, Suecia y Noruega. Ha tocado como solista con la Filharmònica de Cambra de Catalunya, la Orquesta de Camara de los Pirineos Catalanes.
Rocio Yllescas Jacobo Fagotista
Actualmente forma parte de la Orquesta Sinfonica Sinaloa de las Artes en Culiacan, Mexico. En el año 2013 concluye sus estudios musicales Advance Music Studies and Performance Residency Program, en Carnegie Mellon University , EUA, bajo la tutela de la Profesora Nancy Goeres fagotista principal de la Orquesta Sinfónica de Pittsburgh.
En Mayo del 2012 fue aceptada en el Aspen Music Festival. En Abril del 2012, siendo Fagot principal de la Carnegie Mellon Philharmonic Orchestra se presentó en el Carnegie Hall en la ciudad de Nueva York, celebrando el aniversario 100 de la fundación de Carnegie Mellon School of Music. En Marzo del 2012, tocó como solista por primera vez en territorio norteamericano, con Carnegie Mellon Philharmonic Orchestra en su temporada 2011-12, interpretando el Concierto en Sib Mayor para Fagot y Orquesta de W. A. Mozart. En Abril del 2011, se presentó junto con la Carnegie Mellon Philharmonic Orchestra y como fagot principal en el Kennedy Center en Washington D.C.
En Marzo del 2011, ganó el 2do lugar en el Concerto Competition en Carnegie Mellon School of Music. En noviembre del 2010, ganó el 1er lugar en el Concurso Nacional de Fagot en México en su primera edición.En este mismo año pero en el mes de Julio, obtuvo su Licenciatura como Fagotista en la Escuela de Música Vida y Movimiento Ollin Yoliztli, bajo la Cátedra de la Maestra Wendy Holdaway Principal de la Orquesta Sinfónica Nacional de México. En 2009 ganó el concurso para tocar como solista con la Orquesta Sinfónica de la Ollin Yoliztli interpretando el Concierto en Mi menor para Fagot y Orquesta de A. Vivaldi.
Durante 2007- 2008 realizó un año de intercambio en el Conservatorio de Música de Róterdam en Holanda, bajo la Cátedra del Maestro Ronald Karten Principal de la Orquesta Sinfónica del Concertgebouw en Ámsterdam, Holanda. . Ha tomado clases magistrales con fagotistas de gran renombre musical como son Daniel Matsukawa en Estados Unidos, Dag Jensen en Alemania, Bram van Sanders en Holanda, David Tomas Realp en España, Whitney Crockett, Judith Farmer, Nancy Goeres, Robin O’Neill, Stephan Levesque, Andrea Merenzon y Fernando Traba.
Ha sido fagotista de diversas orquestas de México y el extranjero, y fagotista invitada por temporada enteras en algunas otras orquesta como son: Orquesta Sinfónica Nacional de México, la Orquesta Filarmónica de la Ciudad de México, Orquesta Sinfónica de Minería, Orquesta Sinfónica Carlos Chávez en México, Pittsburgh Philharmonic Orchestra, Pittsburgh Savoyards Orchestra, Carnegie Mellon Philharmonic Orchestra en Estados Unidos, Orquesta Sinfónica de CODARTS y el Rotterdam Young Ensemble en Holanda. Ha participado en dos de los festivales más importantes de México: Festival Internacional Cervantino en Guanajuato y Festival Internacional de Morelia en Michoacán, ambos con la Orquesta Sinfónica Nacional de México.
Héctor Eduardo Fernández Purata (Oboe)
Nacido en Ciudad Valles, S.L.P. este oboísta forma parte de la Orquesta Sinfónica de Aguascalientes como corno inglés y oboe co-principal de 1999 hasta el 2003. A partir de ese año se integra a la Orquesta Sinfónica de la Universidad de Guanajuato, además es invitado con el Ensamble Ehecalli en el Ciclo de Música Contemporánea del Festival Internacional Cervantino XXXI, XXXII y XXXVIII.
Durante el 2004 participa en el VII Festival Internacional de Órgano “Guillermo Pinto Reyes” y en el XI Festival Internacional “El Callejón del Ruido”. En el año 2006 participa con el cuarteto “Acaná” en el XXVIII Festival Internacional de Música de Cámara de San Miguel de Allende, así como en la gira “Vive la Magia”. Ha combinado su quehacer sinfónico con la música de cámara dando recitales en Zacatecas, Guanajuato, Puebla, Michoacán, Aguascalientes, Distrito Federal y San Luis Potosí.
En 2006 termina sus estudios de licenciatura en la Escuela de Música de la Universidad de Guanajuato con el maestro Gijsbertus de Graaf y recibe la mención “Suma Cum Laude”. Ha tomado clases de oboístas de fama internacional como Alex Klein, Hansjörg Schellenberger, Thomas Indermühle, Ingo Goritzki y Yeon-Hee Kwak. Durante los periodos 2007 y 2011 gana el apoyo que otorga el Fondo Nacional para la Cultura y las Artes a intérpretes. En 2009 participa en el XXXVII Festival Cervantino con el Ensamble Luum y con el Proyecto “Planetario Musical: Levantemos los Ojos al Cielo”. Ha tocado como invitado en orquestas como Sinfónica Nacional, Sinfónica de Minería, Filarmónica de la UNAM, Filarmónica de Jalisco, Sinfónica de Michoacán, entre otras.
Ha sido solista con la Orquesta Sinfónica de la Universidad de Guanajuato, Orquesta de Cámara de la Casa Municipal de Cultura de Mazatlán, Camerata de San Luis Potosí y con la Orquesta de Cámara de la Universidad Michoacana. Miembro fundador del Ensamble “Zephyrus” que ha participado en el Festival Internacional Cervantino 2011, 2012, 2013 y 2014, en el Festival “Alfonso Ortíz Tirado” 2014 en Álamos, Sonora además de tocar dos conciertos en el Festival de Música Clásica por los Caminos del Vino 2013 en Mendoza, Argentina. En 2014 fue invitado a participar con el Trío “San” en el Festival de Zacatecas.
María Silvera, Clavecinista
Tras obtener el Título de Pianista profesional con Matrícula de Honor, estudia Clavecín con el profesor Alejandra Casal en el Conservatorio Profesional de Sevilla y más tarde con Alberto Martínez Molina obteniendo la Licenciatura en el Real Conservatorio de Música de Madrid donde curso también pedagogía.
Con una intensa actividad Musical a sus espaldas, desde muy temprana edad. María ha sido integrante de coros profesionales, Pianista acompañante de los mismos, Concertista Solista y con grupos de Cámara y Orquestas. Abarcando un repertorio muy grande, desde el renacimiento hasta la Música Contemporanea. Su experiencia en el escenario incluye, entre otras muchas, su participación como clavecinista en la obra “Sainetes”(2007) de Ernesto Caballero, bajo la dirección musical de Alicia Lázaro en la Compañía Nacional de Teatro Clásico (Teatro Pavón de Madrid y Festival Internacional de Teatro de Almagro); conciertos con la Orquesta de Cuerdas del RCSMM en Radio Clásica, Radio Nacional de España, Gran Teatro de Burgos, Ilustre Colegio de Médicos de Madrid, grabando para el archivo de la Biblioteca del RCSMM.
Continuista e integrante del Coro de Cámara de Sevilla en el afamado ciclo “Bach y sus Cantatas” y la “Pasión Según San Mateo”.Clavecinista invitada en encuentros de la Joven Orquesta Nacional de España, en festivales como el de Música Antigua Iberoamericana “Domingo Marcos Durán” de Cáceres; organista en los Ciclos de Misas con Órganos Históricos de la provincia de Sevilla; cierre del VIII Ciclo Arquitectura y Música 2014 con su dúo de clavecín y viola da gamba “Euterpe’s Dream” (recibiendo excelentes críticas); pianista en el monográfico dedicado a la compositora Sonia Megías en Alcalá de Henares, estrenando su obra “Sonata para violín y piano”; “Las Cuatro Estaciones” con Ara Malikian y la orquesta OBAROQ, así como numerosos conciertos en el extranjero para otros festivales y ciclos. María Silvera se ha formado, tanto en música como en otras disciplinas, con maestros de la talla de Richard Egarr (Music Director of The Academy of Ancient Music), Andrés Cea Galán (Director de la Academia de Órgano de Andalucía), el pedagogo José Posada (Método Orff), el pianista Roland Pröll, Alfredo Mantovani (especialista en improvisación teatral), el pedagogo Jorge Rodrigo, el luthier Reinhardt von Nagel (cursos de afinación y temperamentos históricos), el musicólogo, clavecinista y organista Luigi Ferdinando Tagliavini (experto en música italiana para tecla), etc.
Asimismo, ha recibido formación en técnicas de lenguaje corporal, reeducación postural, improvisación, e instrucción pedagógica. Como coach, María lleva años impartiendo clases a todos los niveles como profesora invitada en conservatorios y otros centros, y ha trabajado en varias ocasiones dirigiendo orquestas juveniles, preparando programas específicos de repertorio barroco.
En la actualidad, María Silvera se encuentra inmersa en nuevos proyectos de música antigua y contemporánea con diversos artistas, como el proyecto que comparte con la joven y conocida cantaora Rocío Márquez (Primer premio en el Festival de Cante de las Minas de la Unión, la “Lámpara Minera”); su dúo de viola da gamba y clave con la violagambista Irene Gómez (Segundo Premio en el Concurso de Viola da Gamba del FEMÀS, 2009); sus dúos con los tenores Julio Agudo (Proyecto L) y Víctor Sordo (Capeia Reial de Catalunya –Jordi Savall-), y otros. Además, María es integrante y continuista estable del Coro de Cámara de Sevilla, y ocupa el cargo de Jefa de Estudios en la Escuela deMúsica Gavidia de Sevilla, combinando su carrera artística con su labor docente.
Penélope Luna, soprano
Originaria de Mazatlán, Sinaloa, actualmente es miembro de Solistas Ensamble de Bellas Artes. Concluyó sus estudios de Licenciatura en Canto en Mazatlán, teniendo como maestra de canto a la mezzosoprano Martha Félix.
Ha participado como solista con las orquestas más importantes del país como la Orquesta Sinfónica de Xalapa, la Orquesta Sinfónica Sinaloa de las Artes, Orquesta Filarmónica de Jalisco, Orquesta del Teatro de Bellas Artes, Orquesta Filarmónica de Sonora entre otras, actuando en diversos conciertos y festivales, como el Festival Internacional Cervantino y el Festival Alfonso Ortiz Tirado.
Ganadora del premio “Maria Callas” en el Concurso Nacional de Canto “Carlo Morelli” 2013, en el Palacio de Bellas Artes. Segundo lugar y ganadora del premio “Amigos de la Ópera” en el IV Concurso Internacional de Canto Sinaloa 2012. Finalista en el Primer Concurso Internacional de Canto “Rivelas” 2012 en la ciudad de Panamá.
Participó como seleccionada nacional en el Concurso “Competizione dell’opera” 2010 en Dresden, Alemania. Hizo su debut operístico como Gilda en la ópera Rigoletto en la ciudad de Oaxaca. Roles cantados: Lucia (Lucia di Lammermoor) en la Escuela Nacional de Música, Lucy (El teléfono) en el Teatro Degollado en Guadalajara, Jalisco; Adina (L’elisir d’amore), Monica (The Medium) y recientemente en el estreno mundial de la ópera “La Paloma y el Ruiseñor” (Roger Bourland), con el rol principal de Rosa. Ha tomado clases de técnica vocal y coaching con los maestros Álvaro Ramírez, Linus Lerner, Maureen O’Flynn, Graciela Araya, André dos Santos, Rogelio Riojas, Ángel Rodríguez, Andrés Sarre y Enrique Patrón de Rueda.
Michael Dallinger, Violoncello
Originario de Bregenz, Austria, Actualmente dirige una clase de Violoncello en la Universidad Anton Bruckner en Linz, así mismo es profesor de Música de Cámara y didáctica. Ha impartido cursos de Violoncello en diversos países como: México, la Republica Checa, Italia, Croacia y Austria.
Fue Solo Violoncello de las Orquestas de la Opera y Sinfónica de Verona, Italia y actualmente es miembro fundador y Violoncellista del Cuarteto Motus realizando una intensa actividad a nivel internacional y en Austria es miembro de diferentes ensambles y Orquestas como: Klangforum-Wien, Wiener Akademie, Orchester 1756, Vienna Art Orchestra, Wiener Streichorchester, Ensemble 2001, Cappella con durezza, Nouvelle Cuisine, Camerata Bregenz, Striped Roses, MidasDivas. Con el ensamble Cellivio lleva desde 1997 una intensa actividad.
Zayra Ruiz, mezzosoprano
Originaria de Zamora, Michoacán; ganadora del primer lugar en el Concurso Nacional de Canto de la Ópera de San Miguel de Allende 2012, ganadora del concurso para solista con la Orquesta Sinfónica de la Escuela Nacional de Música de la UNAM, reconocimiento con el premio Mérito de las Artes por ASPEVAZA y la administración Municipal de su ciudad natal 2013, así como ganadora del primer lugar premio del público en el marco del 11º Festival de Arte Vocal, Montréal 2014.
Ha tomado clases y master clases con prestigiados maestros, como lo son: Ruth Falcon, Mignon Dun n, Dunja Vejzovic, Graciela Aralla, Luisa Bezrokova, Pedro Lavirgen y Francisco Araiza, por mencion ar algunos; coaching con: Teresa Rodríguez, Joan Dornemann, Denise Massé y Vlad Iftinca, entre otr os grandes maestros. Fue becaria del Taller de Perfeccionamiento Vocal del Consejo Nacional para la Cultura y las Artes, b ajo la dirección de Raúl Falcó; becaria del Taller Lírico de Pro Ópera Verano-Otoño 2011, así como b ecaria por la Sociedad de Valores de Arte Mexicano para participar en el Programa Internacional de Arte Vocal Canadiense 2014.
Ha actuado con diferentes orquestas y ensambles en importantes recin tos dentro y fuera del país, lo cual le ha dado la fortuna de haber trabajado con destacados directore s concertantes y de escena de nivel internacional. Esta joven artista se ha presentado en varias producciones operísticas, destacando su debut en el P alacio de Bellas Artes en la ópera Manon de Massenet. Otros títulos en los cuales ha tenido una mag nífica participación, son: Die Zauberflüte, Le nozze di Figaro y Così fan tutte de Mozart; Alicia, El peq ueño Príncipe, así como Leoncio y Lena de Ibarra; Traviata y Rigoleto de Verdi, Il matrimonio segret o de Cimarosa, Don Gil de Alcalá de Penella, Gianni Schicchi de Puccini, Street Scene de Weill, Hänsel und Gretel de Humperdink y Carmen de Bizet.
Su repertorio de concierto comprende: Lieder, mélod ie, canción española, zarzuela, música mexicana, oratorio, entre otros géneros. Formó parte de Solistas Ensamble del Instituto Nacional de Bellas Artes y del sexteto vocal femenin o Túumben Paax, este último, ganador del primer lugar y ganador del David de Oro por mejor ensa mble en el Festival Internacional de Florencia, Italia 2012 y primer lugar de categoría, así como Medalla de Oro en el 6º Concurso de Ensambles Vocales de Fukushima, Japón 2013. En la actualidad es i ntegrante del ensamble de música de cámara Voz Adentro, es becaria por la Sociedad Internacional de Valores de Arte Mexicano A. C. y cursa la licenciatura en canto en la Escuela Nacional de Música d e la Universidad Nacional Autónoma de México, bajo la guía de la maestra Thusnelda Nieto.
Aunque se salgo de lo habitual, al sentirme orgulloso de mi mi hija María, he querido dejar aquí reflejada su tenacidad en el trabajo y su sacrifico al tratar de buscar su camino futuro. Ahora está en México y no deja de tener múltiples proyectos e intentar en diversas oporetunidades que aquí, en España, no existen para los jóvenes que comienzan y tienen que emigrar a otros Paises.
¡Qué todo le salga bien!
emilio silvera
Mar
2
¡Los materiales para la vida!
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en El Universo y la Vida ~
Clasificado en El Universo y la Vida ~
 Comments (1)
Comments (1)
¡La Física! Cuando se asocia a otras disciplinas ha dado siempre un resultado espectacular y, en el caso de la Astronomía, cuando se juntó con la Física, surgió esa otra disciplina que llamamos Astrofísica. La Astrofísica es esa nueva rama de la Astronomía que estudia los procesos físicos y químicos en los que intervienen los fenómenos astronómicos. La Astrofísica se ocupa de la estructura y evolución estelar (incluyendo la generación y transporte de energía en las estrellas), las propiedades del medio interestelar y sus interacciones en sus sistemas estelares y la estructura y dinámica de los sistemas de estrellas (como cúmulos y galaxias) y sistemas de galaxias. Se sigue con la Cosmología que estudia la naturaleza, el origen y la evolución del universo. Existen varias teorías sobre el origen y evolución del universo (big bang, teoría del estado estacionario, etc.

Las estrellas, como todo en el Universo, no son inmutables y, con el paso del Tiempo, cambian para convertirse en objetos diferenters de los que, en un principio eran. Por el largo trayecto de sus vidas, transforman los materiales simples en materiales complejos sobre los que se producen procesos biológico-químicos que, en algunos casos, pueden llegar hasta la vida.
Una de las cosas que siempre me han llamado poderosamente la atención, han sido las estrellas y las transformaciones que, dentro de ellas y los procesos que en su interior se procesan, dan lugar a las transiciones de materiales sencillos hacia materiales más complejos y, finalmente, cuando al final de sus vidas expulsan las capas exteriores al espacio interestelar dejando una extensa región del espacio interestelar sembrada de diversas sustancias que, siguiendo los procesos naturales e interacciones con todo lo que en el lugar está presente, da lugar a procesos químicos que transforman esas sustancias primeras en otras más complejas, sustancias orgánicas simples como, hidrocarburos y derivados que, finalmente, llegan a ser los materiales necesarios para que, mediante la química-biológica del espacio, den lugar a moléculas y sustancias que son las propicias para hacer posible el surgir de la vida.

La Química de los Carbohidratos es una parte de la Química Orgánica que ha tenido cierta entidad propia desde los comienzos del siglo XX, probablemente debido a la importancia química, biológica (inicialmente como sustancias de reserva energética) e industrial (industrias alimentaria y del papel) de estas sustancias. Ya muy avanzada la segunda mitad del siglo XX han ocurrido dos hechos que han potenciado a la Química de Carbohidratos como una de las áreas con más desarrollo dentro de la Química Orgánica actual.
Todos los animales, plantas y microbios están compuestos fundamentalmente, por las denominadas sustancias orgánicas. Sin ellas, la vida no tiene explicación (al menos que sepamos). De esta manera, en el primer período del origen de la vida tuvieron que formarse dichas sustancias, o sea, surgimiento de la materia prima que más tarde serviría para la formación de los seres vivos.
La característica principal que diferencia a las sustancias orgánicas de las inorgánicas, es que en el contenido de las primeras se encuentra como elemento fundamental el Carbono.
En las sustancias orgánicas, el carbono se combina con otros elementos: hidrógeno y oxígeno (ambos elementos juntos forman agua), nitrógeno (este se encuentra en grandes cantidades en el aire, azufre, fósforo, etc. Las distintas sustancias orgánicas no son más que las diferentes combinaciones de los elementos mencionados, pero en todas ellas, como elemento básico, siempre está el Carbono.

En el primer nivel (abajo) están los productores, o sea las plantas como maíz, frijol, papaya, cupesí, mora, yuca, árboles, hierbas, lianas, etc., que producen hojas, frutas, raíces, semillas, que comen varios animales y la gente.
En el segundo nivel están los primeros consumidores, que comen hierbas, hojas (herbívoros) y frutas (frugívoros). Estos primeros consumidores incluyen a insectos como hormigas, aves como loros y mamíferos como ratones, urina, chanchos, chivas, vacas.
En el tercer nivel están los segundos consumidores (carnívoros), es decir los que se comen a los animales del segundo nivel: por ejemplo el oso bandera come hormigas, el jausi come insectos y la culebra come ratones.
Nosotros, los humanos, somos omnívoros, es decir comemos de todo: plantas y animales. Algunos de los carnívoros comen, a veces, plantas también, como los perros. Otros, como el chancho, comen muchas plantas y a veces también carne.

Las sustancias orgánicas más sencillas y elementales son los llamados hidrocarburos o composiciones donde se combinan el Oxígeno y el Hidrógeno. El petróleo natural y otros derivados suyos, como la gasolina, el keroseno, etc., son mezcolanzas de varios hidrocarburos. Con todas estas sustancias como base, los químicos obtienen sin problemas, por síntesis, gran cantidad de combinados orgánicos, en ocasiones muy complejos y otras veces iguales a los que tomamos directamente los seres vivos, como azúcares, grasas, aceites esenciales y otros. Debemos preguntarnos como llegaron a formarse en nuestro planeta las sustancias orgánicas. Está claro que, para los iniciados en estos temas, la cosa puede parecer de una complejidad inalcanzable, nada menos que llegar a comprender ¡el origen primario de las sustancias orgánicas!
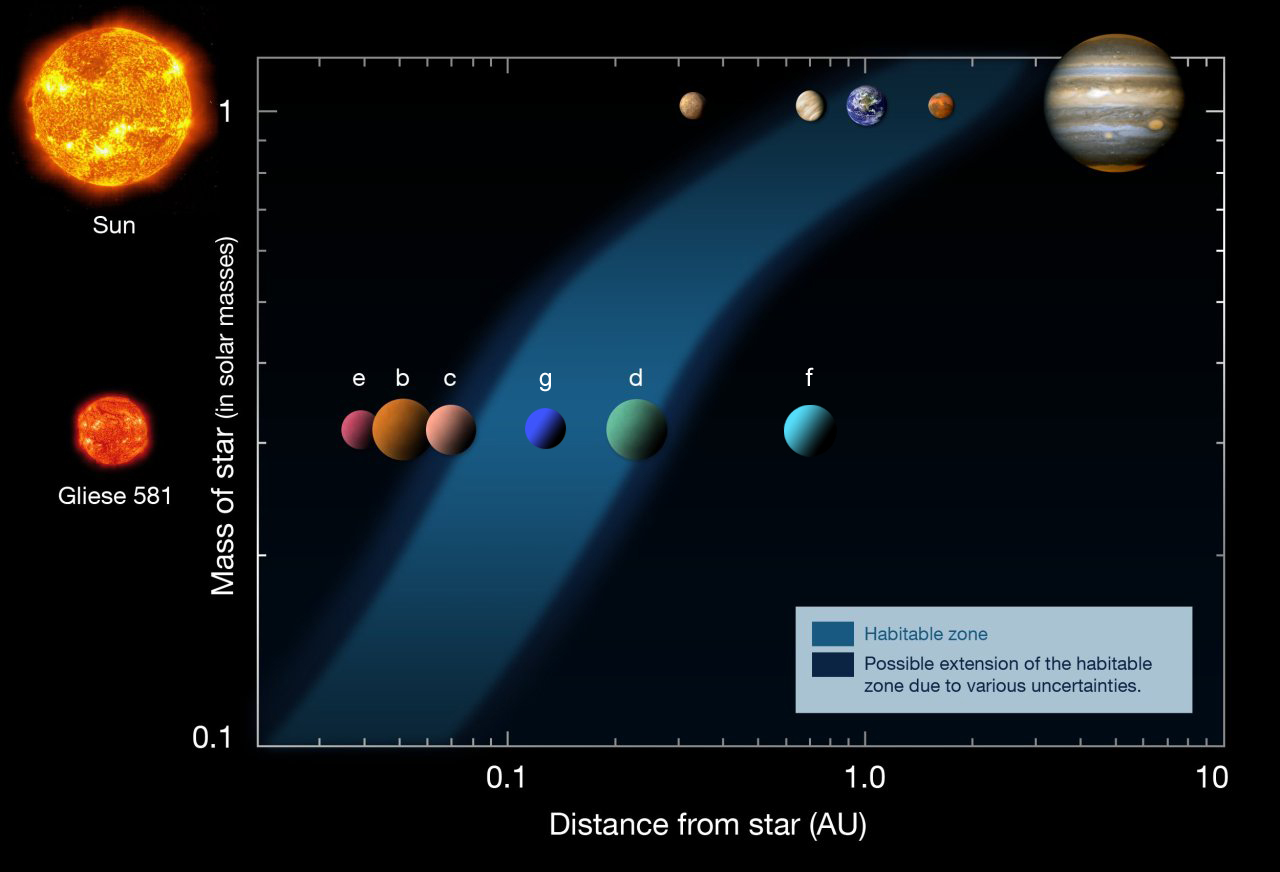
Es nuestro planeta y el único habitado (que se sepa hasta el momento). Está en la ecosfera, un espacio que rodea al Sol y que tiene las condiciones necesarias para que exista vida. Claro que, ¡son tantos los mundos! Cómo vamos a ser nosotros nos únicos que poblemos el Universo? ¡Que despercidicio de espacio!
La observación directa de la Naturaleza que nos rodea nos puede facilitar las respuestas que necesitamos. En realidad, si ahora comprobamos todas las sustancias orgánicas propias de nuestro mundo en relación a los seres vivos podemos ver que, todas, son producidas hoy día en la Tierra por efecto de la función activa y vital de los organismos.
Las plantas verdes absorben el carbono inorgánico del aire, en calidad de anhídrido carbónico, y con la energía de la luz crean, a partir de éste, sustancias orgánicas necesarias para ellas. Los animales, los hongos, también las bacterias y el resto de organismos, menos los de color verde, se alimentan de animales o vegetales vivos o descomponiendo estos mismos, una vez muertos, pueden proveerse de las sustancias orgánicas que necesitan. Con esto, podemos ver como todo el mundo actual de los seres vivos depende de los dos hechos análogos de fotosíntesis y quimiosíntesis, aplicados en las líneas anteriores.

Incluso las sustancias orgánicas que se encuentran bajo tierra como la turba, la hulla o el petróleo, han surgido, básicamente, por efecto de la acción de diferentes organismos que en un tiempo remoto se encontraban en el planeta Tierra y que con el transcurrir de los siglos quedaron ocultos bajo la maciza corteza terrestre. Nota: Hoy existen otras teorías sobre el origen del petróleo.
Todo esto fue causa de que muchos científicos de finales del siglo XIX y principios del XX, afirmaran que era imposible que las sustancias orgánicas produjeran en la Tierra, de forma natural, solamente mediante un proceso biogenético, o sea, con la única intervención de los organismos. Esta opinión predominante entre los científicos de hace algunas décadas, constituyó un obstáculo considerable para hallar una respuesta a la cuestión del origen de la vida.
Para tratar esta cuestión era indispensable saber cómo llegaron a constituirse las sustancias orgánicas; pero ocurría que éstas sólo podían ser sintetizadas por organismos vivos. Sin embargo, únicamente podemos llegar a esta síntesis si nuestras observaciones no van más allá de los límites del planeta Tierra. Si traspasamos esa frontera nos encontraremos con que en diferentes cuerpos celestes de nuestra Galaxia se están creando sustancias orgánicas de manera abiogenética, es decir, en un ambiente que excluye cualquier posibilidad de que existan seres orgánicos en aquel lugar.

Estrella de carbono (estrella gigante roja)
Con un espectroscopio podemos estudiar la fórmula química de las atmósferas estelares, y en ocasiones casi con la misma exactitud que si tuviéramos alguna muestra de éstas en el Laboratorio. El Carbono, por ejemplo, se manifiesta ya en las atmósferas de las estrellas tipo O, que son las que están a mayor temperatura, y su increíble brillo es lo que las diferencia de los demás astros (Ya os hablé aquí de R. Lepori, la estrella carmesí, o, también conocida como la Gota de Sangre, una estrella de Carbono de increíble belleza).
En la superficie de las estrellas de Carbono existe una temperatura que oscila los 20.000 y los 28.000 grados. Es comprensible, entonces, que en esa situación no pueda prevalecer aún alguna combinación química. La materia está aquí en forma relativamente simple, como átomos libres disgregados, sueltos como partículas minúsculas que conforman la atmósfera incandescente de estos cuerpos estelares.

La atmósfera de las estrellas tipo B, característica por su luz brillante blanco-azulada y cuya corteza tiene una temperatura que va de 15.000 a 20.000 grados, también tienen vapores incandescentes de carbono. Pero aquí este elemento tampoco puede formar cuerpos químicos compuestos, únicamente existe en forma atómica, o sea, en forma de pequeñísimas partículas sueltas de materia que se mueven a una velocidad de vértigo.
Sólo la visión espectral de las estrellas Blancas tipo A, en cuya superficie hay una temperatura de unos 12.000º, muestras unas franjas tenues, que indican, por primera vez, la presencia de hidrocarburos –las más primitiva combinaciones químicas de la atmósfera de estas estrellas. Aquí, sin que existan antecedentes, los átomos de dos elementos (el carbono y el hidrógeno) se combinan resultando un cuerpo más perfecto y complejo, una molécula química.
Observando las estrellas más frías, las franjas características de los hidrocarburos son más limpias cuando más baja es la temperatura y adquieren su máxima claridad en las estrellas rojas, en cuya superficie la temperatura nunca es superior a los 4.000º.
Es curioso el resultado obtenido de la medición de Carbono en algunos cuerpos estelares por su temperatura:
- Proción: 8.000º
- Betelgeuse: 2.600º
- Sirio: 11.000º
- Rigel: 20.000º
Como es lógico pensar, las distintas estrellas se encuentran en diferentes períodos de desarrollo. El Carbono se encuentra presente en todas ellas, pero en distintos estados del mismo. Las estrellas más jóvenes, de un color blanco-azulado son a la vez las más calientes. Éstas poseen una temperatura muy elevada, pues sólo en la superficie se alcanzan los 20.000 grados. Así todos los elementos que las componen, incluido el Carbono, están en forma de átomos, de diminutas partículas sueltas.

Existen estrellas de color amarillo y la temperatura en su superficie oscila entre los 6.000 y los 8.000º. En estas también encontramos Carbono en diferentes combinaciones.
El Sol, pertenece al grupo de las estrellas amarillas y en la superficie la temperatura es de 6.000º. El Carbono en la atmósfera incandescente del Sol, lo encontramos en forma de átomo, y además desarrollando diferentes combinaciones: Átomos de Carbono, Hidrógeno y Nitrógeno, Metino, Cianógeno, Dicaerbono, es decir:
- Átomos sueltos de Carbono, Hidrógeno y Nitrógeno.
- Miscibilidad combinada de carbono e hidrógeno (metano)
- Miscibilidad combinada de carbono y nitrógeno (cianógeno); y
- Dos átomos de Carbono en combinación (dicarbono).
En las atmósferas de las estrellas más calientes, el carbono únicamente se manifiesta mediante átomos libres y sueltos. Sin embargo, en el Sol, como sabemos, en parte, se presenta ya, formando combinaciones químicas en forma de moléculas de hidrocarburo de cianógeno y de dicarbono.

La tormenta interminable de Júpiter y su enrarecida atmósfera
Para hallar las respuestas que estamos buscando en el conocimiento de las sustancias y materiales presentes en los astros y planetas, ya se está realizando un estudio en profundidad de la atmósfera de los grandes planetas del Sistema solar. Y, de momento, dichos estudios han descubierto, por ejemplo, que la atmósfera de Júpiter está formada mayoritariamente por amoníaco y metano. Lo cual hace pensar en la existencia de otros hidrocarburos. Sin embargo, la masa que forma la base de esos hidrocarburos, en Júpiter permanece en estado líquido o sólido a causa de la abaja temperatura que hay en la superficie del planeta (135 grados bajo cero). En la atmósfera del resto de grandes planetas se manifiestan estas mismas combinaciones.
Ha sido especialmente importante el estudio de los meteoritos, esas “piedras celestes” que caen sobre la Tierra de vez en cuando, y que provienen del espacio interplanetario. Estos han representado para los estudiosos los únicos cuerpos extraterrestres que han podido someter a profundos análisis químico y mineralúrgico, de forma directa. Sin olvidar, en algunos casos, los posibles fósiles.
Estos meteoritos están compuestos del mismo material que encontramos en la parte más profunda de la corteza del planeta Tierra y en su núcleo central, tanto por el carácter de los elementos que los componen como por la base de su estructura. Es fácil entender la importancia capital que tiene el estudio de los materiales de estas piedras celestes para resolver la cuestión del origen de las primitivas composiciones durante el período de formación de nuestro planeta que, al fin y al cabo, es la misma que estará presente en la conformación de otros planetas rocosos similares al nuestro, ya que, no lo olvidemos, en todo el universo rigen las mismas leyes y, la mecánica de los mundos y de las estrellas se repiten una y otra vez aquí y allí, a miles de millones de años-luz de nosotros.
Así que, se forman hidrocarburos al contactar los carburos con el agua. Las moléculas de agua contienen oxígeno que, combinado con el metal, forman los hidróxidos metálicos, mientras que el hidrógeno del agua mezclado con el carbono forman los hidrocarburos.
Los hidrocarburos originados en la atmósfera terrestre se mezclaron con las partículas de agua y amoníaco que en ella existían, creando sustancias más complejas. Así, llegaron a hacerse presentes la formación de cuerpos químicos. Moléculas compuestas por partículas de oxígeno, hidrógeno y carbono.
Todo esto desembocó en el saber sobre los Elementos que hoy podemos conocer y, a partir de Mendeléiev (un eminente químico ruso) y otros muchos…se hizo posible que el estudio llegara muy lejos y, al día de hoy, podríamos decir que se conocen todos los elementos naturales y algunos artificiales que, nos llevan a tener unos valiosos datos de la materia que en el universo está presente y, en parte, de cómo funciona cuando, esas sustancias o átomos, llegan a ligarse los unos con los otros para formar, materiales más complejos que, aparte de los naturales, están los artificiales o transuránicos.
Aquí en la Tierra, las reacciones de hidrocarburos y sus derivados oxigenados más simples con el amoníaco generaron otros cuerpos con distintas combinaciones de átomos de carbono, hidrógeno, oxígeno y nitrógeno (CHON) en su moléculas llamadas paras la vida una vez que, más tarde, por distintos fenómenos de diversos tipos, llegaron las primeras sustancias proteínicas y grasas que, dieron lugar a los aminoácidos, las Proteínas y el ADN y RDN que, finalmente desembocó en eso que llamamos vida y que, evolucionado, ha resultado ser tan complejo y, a veces, en ciertas circunstancias, peligroso: ¡Nosotros!
emilio silvera
Mar
2
El Carbono y… ¡La Vida!
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Bioquímica ~
Clasificado en Bioquímica ~
 Comments (0)
Comments (0)
Los seres vivos están formados por átomos y moléculas. Pero mientras que en el mundo mineral abundan decenas de elementos distintos, que forman sustancias muy diversas, en los seres vivos las sustancias presentes son siempre las mismas que realizan las mismas funciones y están formadas por muy pocos tipos de átomos.
Esta variedad de sustancias presentes en el organismo vivo, está comprobado que todas ellas se formaron a partir de sencillas y similares reacciones. Las transmutaciones químicas sufridas por las sustancias orgánicas en la célula viva tienen como base fundamental tres clases de reacciones:
– La primera se trata de la condensación o alargamiento de la cadena de átomos de Carbono.
– La segunda es la combinanción de dos moléculas orgánicas a través de un puente de oxígeno o nitrógeno, y tambiénel proceso inverso (hidrólisis).
– La tercera, la oxidación y, ligada a ella, la reducción (reacciones de óxido-reducción).
Además en la célula viva, las reacciones son muy frecuentes, y mediante éstas, el ácido fosfórico, el nitrógeno amínico, el metilo y otros grupos químicos van de una molécula a otra. Todos los procesos químicos producidos en un organismo vivo, cualquier mutación de las sustancias que llevan a la creación de muy variados cuerpos, pueden, en último caso, reducirse a estas reacciones sencillas o a todas ellas en conjunto.

El estudio del quimismo de la respiración, de la fermentación, de la asimilación, de la síntesis y de la desintegración de las distintas sustancias indica que dichos fenómenos se producen a partir de largas cadenas de transmutaciones químicas, cuyos eslabones son distintos y están representados por las reacciones que acabamos de enumerar. Todo ello sólo dependen del orden en el que se sucedan las distintas clases de reacciones. Por ejemplo, si la primera reacción es la de condensación, inmediatamente después tiene lugar un proceso de oxidación y, de nuevo después, otra condensación, tendremos como resultado un cuerpo químico, es decir, un producto de la transmutación; y de forma opuesta, si a la reacción de condensación se une una polimerización y a ésta una oxidación o una reducción, se obtendrá, con toda seguridad, una nueva sustancia.

En los organismos se encuentran cuatro tipos diferentes de moléculas orgánicas en gran cantidad: caebohidratos , lipidos, proteinas y nucleotidos. Todas estas moléculas contienen carbono, hidrogeno y oxigeno. Además, las proteínas contienen nitrogeno y azufre, y los nucleótidos, así algunos lípidos, contienen nitrógeno y fosforo.
Los carbohidratos son la fuente primaria de energía química los sistemas vivos. Los más simples son los monosacáridos (“azúcares simples”). Los monosacáridos pueden combinarse para formar disacáridos (“dos azúcares”) y polisacáridos (cadenas de muchos monosacáridos).

Los lípidos son moléculas hidrofóbicas que, los carbohidratos, almacenan energía y son importantes componentes estructurales. Incluyen las grasas y los aceites, los fosfolípidos, los glucolípidos, los esfingolípidos, las ceras, y los esteroides como el colesterol.


Las proteínas son moléculas muy grandes compuestas de cadenas largas de aminoácidos, conocidas como cadenas polipeptídicas. A partir de sólo veinte aminoácidos diferentes se sintetizar una inmensa variedad de diferentes tipos de moléculas proteínicas, cada una de las cuales cumple una función altamente específica en los sistemas vivos.

Los nucleótidos son moléculas complejas formadas por un grupo fosfato, un azúcar de cinco carbonos y una base nitrogenada. Son los bloques estructurales de los ácidos desoxirribonucleico (ADN) y ribonucleico (ARN), que transmiten y traducen la información genética. Los nucleótidos desempeñan papeles centrales en los intercambios de energía que acompañan a las reacciones químicas dentro de los sistemas vivos. El principal portador de energía en la mayoría de las reacciones químicas que ocurren dentro de las células es un nucleótido que lleva tres fosfatos, el ATP.
La ribosa es el azúcar en los nucleótidos que forman ácido ribonucleico (RNA) y la desoxirribosa es el azúcar en los nucleótidos que forman ácido desoxirribonucleico (DNA). Hay cinco bases nitrogenadas diferentes en los nucleótidos, que son los sillares de construcción de los ácidos nucleicos.
Dos de ellas, la adenina y la guanina, se conocen purinas. Las otras tres, citosina, timina y uracilo se conocen como pirimidinas.

Todos los seres vivos estamos compuestos de los mismos elementos, que al unirse forman compuestos químicos y éstos, a su vez, forman móleculas. Pero es importante que no olvidemos que algo muy importante hace posible la vida tal la conocemos:

Una de las móleculas escenciales para la vida
FUNCIONES BIOLÓGICAS DEL AGUA
El agua es esencial apara todos los tipos de vida. Pueden resumirse en cinco las principales funciones biológicas del agua:
- Es un excelente disolvente, especialmente de las sustancias iónicas y de los compuestos polares. Incluso muchas moléculas orgánicas no solubles –como los lípidos o un buen Participante por sí misma, como agente químico reactivo, en las reacciones de hidratación, hidrólisis y oxidación/reducción, facilitando otras muchas.
- Permite el movimiento en su seno de las partículas disueltas (difusión) y constituye el principal agente de transporte de muchas sustancias nutritivas, reguladoras o de excreción.
- Gracias a sus notables características térmicas (elevados calor específico y calor de evaporación) constituye un excelente termorregulador, una propiedad que permite el mantenimiento de la vida de los organismos en una amplia gama de ambientes térmicos.
- Interviene, en especial en las plantas, en el mantenimiento de la estructura y la forma de las células y de los organismos.
- Muchas otras funciones que tratar de pormenorizar ahora aquí nos llevaría muchas págiinas y no es ese el sentido central del trabajpo-

Lo cierto es que, hemos podido observar que la complejidad y la diversidad de las sustancias creadas en los organismos vivos dependen únicamente de la complejidad y diversidad de las distintas combinaciones de las reacciones simples expuestas más arriba. Pero si prestamos atención a éstas reacciones, veremos que una gran mayoría poseen algo que las hace particularmente comunes, no es otra cosa que la participación inmediata de los elementos del agua.
Dichos elementos combinan con los átomos de Carbono de la molécula de la sustancia orgánica, o bien se desprenden, quedando separados de ella. La reacción entre los cuerpos orgánicos y los elementos del agua es la base fundamental de todo el proceso vital. Gracias a ella se dan gran cantidad de transmutaciones de sustancias orgánicas que actualmente ocurren de forma natural, en el interior de los organismos.
Todos estos conocimientos son fascinantes y nos puede maravillar como de dichas combinaciones se forman moñéculas más grandes y complejas. En 1861, ya demostró A. Butlerov que si se diluye formalina (cuya molécula está formada por un átomo de carbono, un átomo de oxígeno y dos átomos de hidrógeno) en agua calcárea y dicha solución es guardada en un lugar a temperatura templada, con el paso del tiempo, la solución adquiere un sabor dulce.

Cada día nos asombramos menos de las cosas que vamos pudiendo saber.
Mar
2
Las moléculas portadoras de información
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Cosas curiosas ~
Clasificado en Cosas curiosas ~
 Comments (0)
Comments (0)

Los organismos vivos somos sistemas extremadamente complejos, formados por un elevado de elementos interrelacionados que deben mantener sus características a lo largo del tiempo, de una generación a otra. Esto supone que debe existir algún mecanismo para que cada elemento de los organismos se elabore de acuerdo a un “plan”, a un modelo de organización establecido, y que ese modelo pueda ser transmitido de una célula a sus descendientes. Esta necesidad de los seres vivos nos acerca a la noción de información genética.
La información, cualquier tipo de información, es un conjunto organizado de que pueden ser utilizados en algún proceso. En el caso de los seres vivos, los datos se refieren, fundamentalmente, a cómo son las moléculas (en particular las proteínas y el ARN) que la célula necesita producir y a cuándo deben ser elaboradas. La información necesita siempre una memoria, es decir, un sistema físico en el que pueda registrarse, almacenarse y que permita su lectura. En los seres vivos, que somos máquinas químicas, el soporte de la información es un tipo de molécula, concretamente un ácido nucleico. La información que almacenan los organismos recibe el nombre de información genética.
Representación esquemática de la molécula de ADN, la molécula portadora de la información genética. Las moléculas se forman por la Asociación de dos o más átomos, que se mantienen juntas por medio de enlaces químicos. Podríamos decir que algunas moléculasd de vida serían:



– Agua.
– Hidratos de carbono.
– Lípidos.
– Proteínas.
– Acidos Nucleicos.



Principios inmediatos o biomoléculas: cada una de las sustancias que componen la materia viva.
– Simples: O2
– inorgánicos: agua…
– Compuestos:
– orgánicos: glúcidos, lípidos,
proteínas, ac. nucleicos
La enorme variedad de formas, colores, comportamientos, etc que acompaña a los objetos, incluidos los vivientes, sería una consecuencia de la riqueza en la información que soportan las moléculas (y sus agregados) que forman parte de dichos objetos. Ello explicaría que las moléculas de la vida sean en general de grandes dimensiones (macromoléculas). La inmensa mayoría de ellas contiene carbono. Debido a su tetravalencia y a la gran capacidad que posee dicho átomo para unirse consigo mismo, dichas moléculas pueden considerarse como un esqueleto formado por cadenas de esos átomos.

El carbono no es el único átomo con capacidad para formar los citados esqueletos. Próximos al carbono en la tabla periódica, el silicio, fósforo y boro comparten con dicho átomo esa característica, si bien en un grado mucho menor. Refiriéndonos al silicio, señalaremos que las “moléculas” que dicho átomo forma con el oxígeno y otros átomos, generalmente metálicos poseyendo gran nivel de información, difieren en varios aspectos de las moléculas orgánicas, es decir, de las que poseen un esqueleto de átomos de carbono.

El mundo de los silicatos es de una gran diversidad, existiendo centenares de especies minerológicas. Esas diferencias se refieren fundamentalmente a que el enlace químico en el caso de las moléculas orgánicas es covalente, y cuando se forma la sustancia correspondiente (cuatrillones de moléculas) o es un líquido, como es el caso de los aceites, o bien un sólido que funde fácilmente. Entre las moléculas que lo forman se ejercen unas fuerzas, llamadas de Van der Waals, que pueden considerarse como residuales de las fuerzas electromagnéticas, algo más débiles que éstas. En cambio, en los silicatos sólidos (como en el caso del topacio) el enlace covalente o iónico no se limita a una molécula, sino que se extiende en el espacio ocupado por el sólido, resultando un entramado particularmente fuerte.
Al igual que para los cristales de hielo, en la mayoría de los silicatos la información que soportan es pequeña, aunque conviene matizar este punto. Para un cristal ideal así sería en efecto, pero ocurre que en la realidad el cristal ideal es una abstracción, ya que en el cristal real existen aquí y allá los llamados defectos puntuales que trastocan la periodicidad espacial propia de las redes ideales. Precisamente esos defectos puntuales podían proporcionar una mayor información.
El cristal ideal no existe, en su natural, todos tienen inperfecciones y, sólo el elaborado, se podría decir que son cristales perfectos y, sin embargo, la mano del hombre lo que ha producido con tal intervención es perder una valiosa información inserta en ese cuerpo natural.
Si prescindimos de las orgánicas, el resto de las moléculas que resultan de la combinación entre los diferentes átomos no llega a 100.000, frente a los varios millones de las primeras. Resulta ranozable suponer que toda la enorme variedad de moléculas existentes, principalmente en los planetas rocosos, se haya formado por evolución de los átomos, como corresponde a un proceso evolutivo. La molécula poseería mayor orden que los átomos de donde procede, esto es, menor entropía. En su formación, el ambiente se habría desordenado al ganar entropía en una cierta cantidad tal, que arrojarse un balance total positivo.
No puedo dejar pasar la oportunidad, aunque sea de pasada, de mencionar las sustancias.



Las así llamadas, son cuerpos formados por moléculas idénticas, entre las cuales pueden o no existir enlaces químicos. Veremos varios ejemplos. Las sustancias como el oxígeno, cloro, metano, amoníaco, etc, se presentan en estado gaseoso en ordinarias de presión y temperatura. Para su confinamiento se embotellan, aunque existen casos en que se encuentran mezcladas en el aire (os podéis dar una vueltecita por el polo químico de Huelva en España).
En cualquier caso, un gas como los citados consiste en un enjambre de las moléculas correspondientes. Entre ellas no se ejercen fuerzas, salvo cuando colisionan, lo que hacen con una frecuencia que depende de la concentración, es decir, del de ellas que están concentradas en la unidad de volumen; número que podemos calcular conociendo la presión y temperatura de la masa de gas confinada en un volumen conocido.

Nubes moleculares en Orión
Decía que no existen fuerzas entre las moléculas de un gas. En realidad es más exacto que el valor de esas fuerzas es insignificante porque las fuerzas residuales de las electromagnéticas, a las que antes me referí, disminuyen más rápidamente con la distancia que las fuerzas de Coulomb; y esta distancia es ordinariamente de varios diámetros moleculares.
Podemos conseguir que la intensidad de esas fuerzas aumente tratando de disminuir la distancia media entre las moléculas. Esto se puede lograr haciendo descender la temperatura, aumentando la presión o ambas cosas. Alcanzada una determinada temperatura, las moléculas comienzan a sentir las fuerzas de Van der Waals y aparece el estado líquido; si se sigue enfriando aparece el sólido. El orden crece el gas al líquido, siendo el sólido el más ordenado. Se trata de una red tridimensional en la que los nudos o vértices del entramado están ocupados por moléculas.
Todas las sustancias conocidas pueden presentarse en cualquiera de los tres estados de la materia (estados ordinarios y cotidianos en nuestras vidas del día a día).
El Plasma de las estrellas y otros cuerpos estelares forman el estado más común de la materia en nuestro Universo -al menos la que podemos observar-. El esado de la materia más común que conocemos es el plasma que es la forma que adopta en aquellos estados de altas energías como los que están presentes en las estrellas de las galaxias, los remanentes de supernovas, estrellas de neutrones y otros objetos celestes que adoptan ese estado material que emite una alta radiación.
Si las temperaturas reinantes, son de miles de millones de grados, el estado de la materia es el plasma, el material más común del universo, el de las estrellas (aparte de la materia oscura, que no sabemos ni lo que es, ni donde está, ni que “estado” es el suyo).
En condiciones ordinarias de presión, la temperatura por debajo de la cual existe el líquido y/o sólido depende del tipo de sustancia. Se denomina temperatura de ebullición o fusión la que corresponde a los sucesivos equilibrios (a presión dada) de fases: vapor ↔ líquido ↔ sólido. Estas temperaturas son muy variadas, por ejemplo, para los gases nobles son muy bajas; también para el oxígeno (O2) e hidrógeno (H2). En cambio, la mayoría de las sustancias son sólidos en condiciones ordinarias (grasas, ceras, etc).
Sustancias Compuestas y simples:
Las sustancias pueden ser simples y compuestas, según que la molécula correspondiente tenga átomos iguales o diferentes. El número de las primeras es enormemente inferior al de las segundas.
El concepto de molécula, como individuo físico y químico, pierde su significado en ciertas sustancias que no hemos considerado aún. Entre ellas figuran las llamadas sales, el paradigma de las cuales es la sal de cocina.


Es requerida por el organismo para mantener la volemia y procurar el adecuado equilibrio electrolítico. Además, conserva isotonicidad entre plasma e intersticio, así como también mantiene equilibrio con la célula. Implicada directa en el mantenimiento de la presión arterial media y en el equilibrio osmolar. Su disociación en sangre es parcial (sólo un 93 porciento).
Se trata de cloruro de sodio, por lo que cualquier estudiante de E.G.B. escribiría sin titubear su fórmula: Cl Na. Sin embargo, le podríamos poner en un aprieto si le preguntásemos dónde se puede encontrar aisladamente individuos moleculares que respondan a esa composición. Le podemos orientar diciéndole que en el gas Cl H o en el vapor de agua existen moléculas como individualidades. En realidad y salvo casos especiales, por ejemplo, a temperaturas elevadas, no existen moléculas aisladas de sal, sino una especie de molécula gigante que se extiende por todo el cristal. Este edificio de cristal de sal consiste en una red o entramado, como un tablero de ajedrez de tres dimensiones, en cuyos nudos o vértices se encuentran, alternativamente, las constituyentes, que no son los átomos de Cl y Na sino los iones Cl– y Na+. El primero es un átomo de Cl que ha ganado un electrón, completándose todos los orbitales de valencia; el segundo, un átomo de Na que ha perdido el electrón del orbital s.


Por esta zona de Huelva, conocida como Marismas del Odiel, llevaba con frecuencia a mis hijos pequeños que, jugando por aquellos parajes, se lo pasaban estupendamente, y, de camino, tenía la oportunidad de despertarles la curiosidad de cómo se producía la Sal en el medio natural dejando que se evapore el agua del Mar por los efectos del calor radiado por el Sol que dejaba, finalmente, la Sal al descubierto para ser refinada y vendida comercialmente.
Cuando los átomos de Cl y Na interaccionan por aproximarse suficientemente sus nubes electrónicas, existe un reajuste de cargas, porque el núcleo de Cl atrae con más fuerza los electrones que el de Na, así uno pierde un electrón que gana el otro. El resultado es que la colectividad de átomos se transforma en colectividad de iones, positivos los de Na y negativos los de Cl. Las fuerzas electromagnéticas entre esos iones determinan su ordenación en un cristal, el Cl Na. Por consiguiente, en los nudos de la red existen, de manera alternativa, iones de Na e iones de Cl, resultando una red mucho más fuerte que en el caso de que las fuerzas actuantes fueran de Van der Waals. Por ello, las sales poseen puntos de fusión elevados en relación con los de las redes moleculares.
emilio silvera
















 Totales: 75.437.625
Totales: 75.437.625 Conectados: 44
Conectados: 44