May
15
Caprichos de la Naturaleza
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Estrellas ~
Clasificado en Estrellas ~
 Comments (2)
Comments (2)
El concepto de vecindad es relativo e indefinido. Su valor puede variar según sean las distintas medidas de celeridad de los medios habituales de comunicación y según sea la extensión dentro de la cual sirva de medida de relación.

Con el empleo de la expresión “vecina” va siempre implícita o sugerida la idea de que existe una región que no es vecina. La vecina persistente de la Tierra es la Luna; los cometas son sólo visitantes ocasionales. Podemos considerar vecinas del Sol a las estrellas situadas a una distancia comprendida entre los cincuenta y cien años-luz, dejando excluidos a los miles de millones de estrellas de la Vía Láctea. Los planetas y los cometas no son vecinos del Sol, sino miembros de su familia, y los bólidos serían una especie de parásitos cósmicos.
Pero mi intención al comenzar este comentario, era el de exponer aquí alguno de los muchos caprichos cósmicos que en el Universo podemos contemplar y, en este caso concreto, me he decidido por contaros lo siguiente:
R LEPORI

Aquí tenemos a R Leporis, una estrella de Carbono a la que se puso el nombre de la “Estrella Carmesí”, o, la “Gota de Sangre”. R Leporis (R Lep / HD 31996 / HR 1607) es una estrella variable de la constelación de Lepus, cerca del límite con Eridanus. Visualmente es una estrella de un color rojo vívido, cuyo brillo varía entre magnitud aparente +5,5 y +11,7. Descubierta por John Russell Hind en 1845, es también conocida como Estrella carmesí de Hind. A una distancia aproximada de 1100 años luz, R Leporis pertenece a la rara clase de estrellas de carbono, siendo su tipo espectral C6. En estas estrellas, los compuestos de carbono no permiten pasar la luz azul, por lo que tienen un color rojo intenso. En R Leporis la relación carbono–oxígeno estimada es 1,2, más del doble que la existente en el Sol. Tiene un radio entre 480 y 535 veces más grande que el radio solar, equivalente a 2,2 – 2,5 UA. Si estuviese en el centro del Sistema Solar, su superficie se extendería más allá de la órbita de Marte. Su temperatura superficial, extremadamente baja para una estrella, está comprendida entre 2050 y 2290 K. Brilla con una luminosidad entre 5200 y 7000 veces superior a la del Sol, siendo la mayor parte de la energía radiada como radiación infrarroja.

Como nos dice más arriba Wilipedia, cerca de la famosa estrella Rigel (Beta Orionis), la débil constelación de Lupus (la Liebre) es escenario cada catorce meses de un prodigio de la evolución estelar: R Leporis, la estrella carmesí, cobra vida y regala a los astrónomos toda su belleza al encender en la oscuridad del cielo el resplandor de color rojo más acentuado que puede observarse a través de un telescopio. La encontró el astrónomo inglés John Russell Hind en el año 1845 y dijo de ella, estupefacto, que era como una “gota de sangre”. Desde aquel día, el espectáculo celeste se repite periódicamente cada año y dos meses, cuando R Leporis abandona la oscuridad y resplandece como un candil en un área del firmamento casi vacía de estrellas que contrasta con el fulgor de los soles azules que forman la constelación de Orión.
R Leporis es una estrella de Carbono y constituye uno de esos caprichos cósmicos a los que antes me refería y que han permitido al hombre percibir la magia de los cielos y buscar en ellos la belleza de sus orígenes. La ausencia de colores intensos de las que adolece el firmamento se rompe aquí para deleite del observador nocturno, que asistía a un acontecimiento de la Naturaleza extensivo a miles de millones de estrellas y que en el siglo XVII asombró al científico alemán Johannes Hevelius.


A diferencia del Sol y de las estrellas de su clase, que permanecen estables, el brillo de una gran parte de la población estelar es variable, y en algunos casos su ciclo hace oscilar espectacularmente su intensidad lumínica ante nuestros ojos. En R Leporis, más que sus cambios de brillo, la faceta más hermosa es su tonalidad roja, una de las más intensas que puede observarse en todo el cielo, pero otras variables tienen un ciclo que las hace apagarse y encenderse como si fueran faros en la Vía Láctea. Ese es el caso de Mira, a la que Hevelius llamó “la estrella maravillosa” después de que apareciera en el cielo como por arte de magia.
Mira es el nombre propio que Hevelius le puso a esta estrella, cuya denominación original en el catálogo de Johann Bayer, basado en el alfabeto griego, era Omicrón Ceti, es decir, la estrella omicrón de la constelación de Cetus, la Ballena. Su variabilidad fue descubierta en 1596 por David Fabricius, pero Hevelius se sintió tan atraído por ella que le dedicó un libro, que tituló Historia de la estrella maravillosa. Realmente lo es; el brillo de Mira disminuye hasta la magnitud 11, invisible a ojo desnudo y sólo observable con telescopio como un débil punto de luz, pero al cabo de un tiempo su gigantesca máquina nuclear la hincha vertiginosamente y se convierte en una estrella de segunda magnitud, alcanzando un brillo notable, similar al de la estrella polar. Por eso, cuando está en la parte inferior del ciclo, Mira no puede verse sin ayuda óptica, pero después surge entre las demás estrellas de su constelación, como si se hubiera encendido de repente.

Imagen de Mira obtenida con el Telescopio Espacial Hubble
Mira pertenece a la clase espectral M, la misma que Antares y Betelgeuse. Las tres son estrellas muy frías en comparación con el Sol, ya que su temperatura es del orden de los 3000 grados. Sin embargo, Mira, Betelgeuse y Antares son decenas de miles de veces más luminosas que el Sol, puesto que figuran entre las estrellas más grandes conocidas, alcanzando diámetros de unos ochocientos millones de kilómetros, equivalentes a la distancia a la que se halla Júpiter del Sol. Estas tres gigantes, sin embargo, comparten sus atributos relativos a la clase espectral con las estrellas representativas del polo opuesto: las enanas rojas, como la estrella de Barnard y Próxima Centauri. Todas se muestran ante nosotros con el bello color rojizo, pero la gigante Betelgeuse es una estrella inestable a la que los astrónomos consideran una de las mejores candidatas de la Vía Láctea para estallar en cualquier momento en forma de supernova; puede ocurrir mañana o dentro de mil años, pero Betelgeuse está destinada a un final cataclísmico que se observará alguna vez. En cambio Barnard y Próxima, dos diminutos soles rojos, viven en la eternidad, al ser tan frías y pequeñas podrían permanecer en sus condiciones actuales en torno a doscientos mil millones de años, de acuerdo con la teoría aceptada de la evolución estelar para este tipo de bajo consumo de material nuclear.

Mucho antes de que Russell descubriera la estrella carmesí y Johannes Hevelius quedara fascinado por Mira, la estrella maravillosa, los astrónomos árabes se fijaron en una estrella de la constelación de Perseo que cambiaba de brillo cada tres días, con una pauta muy regular y acentuada. Los árabes escribieron una de las escasas páginas destacadas de la astronomía medieval, paliando de alguna manera la importante decadencia que sufrió esta ciencia en ese período en Europa y el Mediterráneo en el periodo comprendido entre Ptolomeo y Copérnico, que duró un milenio y medio.

Bueno, hablar aquí de las estrellas que conocemos bien y de sus historias resulta entretenido y nos enseña un poco de la Historia estelar en objetos individuales y determinados que, por una u otra razón tienen destacadas razones para que los astrónomos se fijaran en ellos. Alguno de estos días, tendremos que hablar de Eta Carinae, otra variable irregular hipergigante, que llegó a ser la segunda estrella más brillante del cielo. Es una variable azul luminosa con magnitud absoluta de -10, y es clasificada oficialmente como una estrella S Doradus. Se encuentra dentro de un cúmulo de estrellas masivas y una masa estimada en 100 masas solares, es probablemente la estrella más masiva de la Galaxia. El único espectro visible es el de la Nebulosa del Homúnculo que la rodea. Eta Carinae es una intensa fuente infrarroja y su importante pérdida se masa (alrededor de 0,1 masas solares por año) tiene asociadas energías próximas a las de algunas supernovas y, teniéndola a unos 8000 años-luz, lo mejor será estar vigilante, ya que, aunque son distancias inmensas…Nunca se sabe lo que un monstruo de ese calibre nos podría enviar.
emilio silvera
May
15
Breve comentario sobre bosques y praderas.
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Naturaleza ~
Clasificado en Naturaleza ~
 Comments (3)
Comments (3)

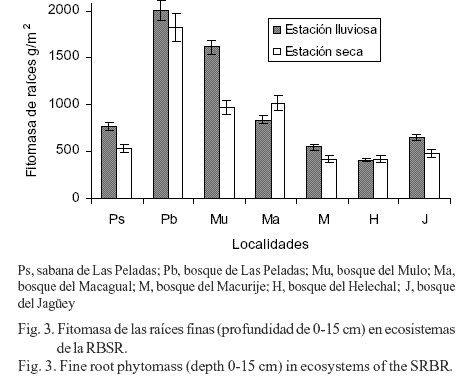
Los bosques almacenan la mayor parte de la fitomasa terrestre, entre tres cuartos y nueve décimos del total. La razón de tanta incertidumbre en esta estimación se debe a la rápida deforestación tropical, la falta de una clasificación uniforme de los bosques y a su alta variabilidad.
Los bosques cerrados (en contraste con los bosques abiertos) se pueden definir como ecosistemas cuya cubierta ocupa entre el 20 y el 40 por ciento del suelo. Nuestro escaso conocimiento de los bosques tropicales implica que tengamos que extrapolar almacenamientos típicos de un número inadecuado de terrenos bien estudiados. El mejor inventario disponible establece que, a principios de los noventa, el área total de bosques cerrados era de aproximadamente 25 millones de Km2, dos quintas partes de los cuales estaban situados en los trópicos. La superficie total de todos los bosques es aproximadamente el doble; almacenan cerca de nueve décimas partes de la fitomasa del planeta y están casi equitativamente repartidos entre los biomas tropicales, templaros y boreales.

Lluvias abundantes y altas temperatruras durante todo el año
En el bosque tropical se encuentra el máximo almacenamiento medio de fitomasa. Desde el aire, las copas de los árboles muestran una decepcionante uniformidad, vistas desde aviones a reacción y de un rojo intenso en las imágenes con falso color de los satélites. Desde el suelo umbrío, frecuentemente con escasa maleza, se elevan los troncos de los árboles, unos rectos, otros delgados, algunos enormes y también apuntalados; luego un revoltijo de ramas superpuestas, lianas y epifitos. Un claro del bosque o la orilla de una corriente muestran la estructura en capas de esta selva.
Los bosques tropicales más espesos de la Amazonia albergan en cada hectárea casi 100.000 plantas de más de seiscientas especies vegetales diferentes. Pero al menos tres cuartas partes de la fitomasa almacenada (unas 600 toneladas por hectárea) se encuentran en las copas de unos pocos cientos de árboles que sobresalen.



Debido a la alta biodiversidad de la selva, ningún árbol almacena más de un pequeño porcentaje de toda la fitomasa. Ésta es una estrategia evasiva que ha incrementado las posibilidades de supervivencia en un ambiente rebosante de predadores de semillas y agentes patógenos. Otras defensas activas son sus finas cortezas o la simbiosis con hormigas guardianas.
Por el contrario, en los bosques templados y en los boreales domina una sola especie de árbol, y sin embargo, su almacenamiento de fitomasa supera a los bosques tropicales más espesos. Los máximos del planeta se dan en las costas del noroeste del océano Pacífico, donde los bosques de secuoyas pueden llegar a almacenar, por encima del suelo, hasta 3.500 toneladas de fitomasa por hectárea, lo que representa una cantidad cinco veces mayor que en la Amazonia central. Estos árboles son los seres vivos más altos (más de 100 metros) y más pesados (más de 300 toneladas) del planeta (las ballenas azules adultas pesan alrededor de las 100 tonelas).
En todos los bosques, los tejidos leñosos por encima del nivel del suelo (tronco, corteza, ramas) contienen la mayor parte de la fitomasa (70 – 80 por ciento) del árbol; las raíces almacenan entre el 10 y el 35 por ciento, las acículas un 1’5 – 8 por ciento y las hojas sólo el 1 – 2 por ciento.
El tronco cortado en la forma tradicional para su comercialización contiene solamente la mitad de toda la fitomasa, mientras que los troncos demasiados delgados, el tocón, ramas, corteza, artículos y hojas suman la otra mitad.
En un buen bosque en crecimiento, templado o boreal, se obtienen entre 85 y 100 m3/ha (35 – 50 t/ha en seco, dependiendo de la clase de árbol); en los bosques tropicales pueden llegar hasta 180 m3/ha. Con los nuevos métodos de corta, para obtener pulpa se utiliza todo el árbol (a menudo hasta el tocón), recuperándose prácticamente toda la fitomasa.
Para producir un kilogramo de fitomasa nueva, los árboles tropicales requieren hasta 12 g de nitrógeno, mientras que un bosque de coníferas necesita menos de 4 g. Los bosques templados, con unas tasas relativamente altas de crecimiento y un uso económico de los nutrientes, son productores relativamente eficientes de fitomasa.

Todas la civilizaciones preindustriales cortaron madera, no sólo como material de construcción indispensable, sino también como combustible, bien quemado directamente o transformándolo previamente en carbón. La contribución de los bosques a la energía global primaria ha ido declinando según ha aumentado el consumo de combustibles fósiles, pero su presencia ha seguido creciendo, tanto como suministradores de madera y pulpa como por su función de albergues de alta biodiversidad y por sus servicios como ecosistemas insustituibles.
El ámbito de las praderas

Las praderas naturales proporcionan sustento a muchos grandes mamíferos que pastan como el bisonte, los antílopes y los canguros. Como en la pradera hay pocos lugares que sirvan de escondite, algunos mamíferos son veloces corredores, mientras que otros, incluidos los topos y las ardillas se refugian en las galerías subterráneas que cavan en el suelo.
La extensión global de las praderas ha cambiado profundamente desde la mitad del siglo XIX. El principal motivo de este cambio es el de transformar las praderas en tierras de cultivo, lo que ha provocado la disminución, en superficie, de este bioma, pero por otra parte, según avanza la deforestación han surgido praderas secundarias.
Aunque la extensión de las praderas es casi igual a la de los bosques cerrados, la diferencia entre sus respectivos promedios de fitomasa almacenada sobre el nivel del suelo por unidad de superficie (20 t/ha en hierba, 250 t/ha en fitomasa leñosa) es de un orden de magnitud. Hay, sin embargo, más fitomasa en las praderas de lo que parece a simple vista, porque salvo en las hierbas altas tropicales, la fitomasa subterránea es varias veces mayor que en los árboles en lo que se refiere a los brotes en su cubierta.
La cantidad de fitomasa contenida en los renuevos está comprendida entre menos de 1 t/ha, en regiones semidesérticas, hasta más de 20 t/ha en algunas praderas tropicales. Si se incluyen los tallos secos, la fitomasa aérea llega a alcanzar las 35 t/ha. En regiones con clima semihúmedo tropical, y en climas templados con irrigación natural, las mayores acumulaciones de fitomasa se encuentran en los renuevos. En general, es indiscutible la correlación entre la cantidad de fitomasa y la de lluvia, aunque esta relación pierde importancia en condiciones de humedad elevadas.
El total de la fitomasa subterránea varía entre menos de 0’5 t/ha en los trópicos, hasta casi 50 t/ha en las praderas templadas (media de 20 t/ha). Con cerca de 10 t/ha al año, la productividad media de las praderas templadas iguala la de los bosques en latitudes medias.
Una gran cantidad de herbívoros se alimentan de las praderas. Solamente las hojas tiernas tienen un alto contenido en proteínas y son relativamente digestibles. Los tallos y los troncos son peores en ambos aspectos, pero componen la mayor parte de la dieta de algunas especies que comparten las praderas con otros animales. En la estación seca del Serengueti, la dieta de los ñus se compone aproximadamente de un 20 por ciento de hojas y un 30 por ciento de tallos, mientras que para las cebras los correspondientes valores son de menos del 1 por ciento y de más del 50 por ciento respectivamente.

La mayor parte de la fitomasa la consumen los grandes vertebrados
Una sola especie numerosa de invertebrados puede consumir una pequeña fracción de la producción anual de fitomasa, y el consumo total de todos los invertebrados está comprendido entre el 10 y el 20 por ciento. Los ungulados consumen hasta el 60 por ciento de la producción de fitomasa aérea de las fértiles praderas del este de África. Algunas hierbas se adaptan para evitar su excesivo consumo incorporando a su composición sustancias que disminuyen su digestibilidad, y compuestos tóxicos; otras reaccionan con un rápido crecimiento cuando son dañadas por los animales que pastan.




En el Serengueti, donde las praderas sirven de alimento a la mayor concentración de grandes herbívoros del mundo, así como a muchos otros animales de menos tamaño y a numerosos invertebrados, un moderado consumo de hierba aumenta la producción de la misma hasta el doble de la que se produce en terrenos donde no se pace. El césped es la prueba más asequible de la productividad, no siempre deseada, de la pradera.
emilio silvera
May
15
De materiales y radiaciones
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Física ~
Clasificado en Física ~
 Comments (0)
Comments (0)

Uranio 238
Al pensar en la desintegración me ha traído a la memoria otros materiales que también se desintegran de manera natural y que son materiales fértiles, o que sin serlo, se pueden transformar en otros que sí lo son.
Al hablar de material fértil me estoy refiriendo a núclidos que pueden absorber neutrones para formar material fisible. El uranio-238, por ejemplo, absorbe un neutrón para formar uranio-239, que se desintegra en plutonio-239. Este es el tipo de conversión que la imaginación del hombre hace que ocurra en un reactor reproductor.
Isaac Asimov lo explicaba así::


El uranio-235 es un combustible práctico, es decir, los neutrones lentos son capaces de hacer que el uranio-235 se fisione, o lo que es lo mismo, se rompan sus átomos en dos, produciendo neutrones lentos, que a su vez inducen otras fisiones atómicas. El uranio-233 y el plutonio-239 son también combustibles nucleares prácticos por las mismas razones.
Desgraciadamente, el uranio-233 y el plutonio-239 no existen en estado natural sino en trazas mínimas, y el uranio-235, aunque existe en cantidades apreciables, no deja de ser raro. En cualquier muestra de uranio natural, sólo siete de cada mil átomos son de uranio-235, el resto es uranio-238.

Científicos chinos han logrado extraer uranio y plutonio de combustible gastado tras la obtención de energía nuclear, un avance que según los expertos podría multiplicar por 60 la duración de estas fuentes de energía atómica,

El uranio-238, la variedad común de uranio, no es un combustible nuclear práctico. Así que, el uranio que más abunda en la naturaleza no sirve como combustible nuclear. Podemos conseguir que se fisione, pero sólo con neutrones rápidos. Los átomos de uranio-238 que se rompen en dos, producen neutrones lentos, que no bastan para producir o inducir nuevas fisiones. El uranio-238 cabría compararlo a la madera húmeda: es posible hacer que arda, pero acabará por apagarse.
Supongamos, sin embargo, que se separa el uranio-235 del uranio-238 (trabajo más bien difícil) y que se utiliza aquel para hacer funcionar un reactor nuclear. Los átomos de uranio-235 que forman el combustible del reactor se fisionan y esparcen miríadas de neutrones lentos en todas direcciones. Si el reactor está rodeado por una capa de uranio ordinario (que en su mayor parte es uranio-238), los neutrones que van a parar allí son absorbidos por el uranio-238 y, aunque no pueden hacer que el uranio-238 se fisione, sí pueden provocar otros cambios que finalmente, producirán plutonio-239. Separando este plutonio-239 del uranio (tarea muy fácil), puede ser utilizado como combustible nuclear practico para la fisión.
De esta manera, el reactor nuclear genera nuevo combustible a partir de un material (uranio-238) que no lo es. Este es el motivo de que al reactor nuclear que hace posible la transformación se le llame “reactor generador”.

El Reactor Generador TR10 permite convertir uranio-238 en plutonio-239 dentro de su mismo núcleo
Un reactor generador bien diseñado puede producir más plutonio-239 que el uranio-234 consumido para ello. De este modo, las reservas totales de uranio de la Tierra (y no sólo las de uranio-235) se convierten en potenciales de combustible nuclear.
El torio, tal como se da en la naturaleza, consiste todo él en torio-232, que al igual que el uranio-238, no es un combustible nuclear práctico, porque requiere neutrones rápidos para fisionarse. Pero si se coloca torio-232 alrededor de un reactor nuclear, sus átomos absorberán los neutrones y, sin experimentar fisión alguna, se convertirán en átomos de uranio-233. Como el uranio-233 es un combustible práctico que se puede separar fácilmente del torio, el resultado es otra variedad del reactor generador, que convierte las reservas de torio en un combustible nuclear en potencia.

El torio es un elemento naturalmente radiactivo de símbolo Th y número atómico 90. Descubierto en noruega por el minerólogo Thrane Esmark e identificado y nombrado por el químico sueco Jons Berzelius en 1828. El Torio fue nombrado en honor al dios nordico del trueno Thor.
Se encuentra en 13 lugares más arriba en la lista de elementos más abundantes de la tierra que todos los isótopos del uranio. Esto se debe a que cierto isótopo del torio, el 232Th decae más lentamente que el uranio, de hecho lo hace tan lento que su vida media es comparable con la edad del universo.
La cantidad total de uranio y de torio que hay en la Tierra es unas 800 veces mayor que las reservas de uranio-235, lo que significa que el buen uso de los reactores generadores podría multiplicar por 800 la oferta potencia de energía extraída de plantas de fisión nuclear.
En este punto, sin dejar de elogiar la inteligencia del hombre que ha sabido encontrar la manera de transformar una materia inservible en otra practica, hay que decir que la energía de fisión nuclear genera también muchos problemas.

Isaac Asimov
Como estará comprobando al lector de este trabajo, el autor ha querido esta vez diversificar los temas y plasmar una variedad múltiple que facilite el conocimiento de distintas cosas que ocurren en la naturaleza, o que la mano del hombre hace que ocurran, y todas estas cuestiones tratadas aquí van encaminadas a resolver preguntas que en alguna ocasión nos hemos podido hacer, tales como:
¿Por qué al calentar un metal se pone primero rojo, luego naranja, después amarillo, pero a continuación blanco en lugar de seguir el espectro y ponerse verde?
Cualquier objeto, a cualquier energía superior al cero absoluto, radia ondas electromagnéticas. Si su temperatura es muy baja, emite sólo ondas de radio largas, muy pobres en energías. Al aumentar la temperatura, radia una cantidad mayor de ondas, pero también empieza a radiar ondas de radio más cortas (y más energéticas). Si la temperatura sigue subiendo, empiezan a radiarse microondas aún más energéticas y después radiaciones infrarrojas.

Esto no quiere decir que a una temperatura dada sólo se emitan ondas de radio largas, un poco más arriba sólo ondas de radio cortas, luego sólo microondas y después sólo infrarrojos. En realidad, se emite toda la gama de radiaciones, pero siempre hay una radiación máxima, es decir, una gama de longitudes de onda que son las más radiadas, flanqueadas por cantidades menores en el lado de las energías bajas y por cantidades todavía más pequeñas en el de las altas.
Cuando un objeto alcanza la temperatura del cuerpo humano (37°C), el máximo de radiación se encuentra en los infrarrojos largos. El cuerpo humano también radia ondas de radio, pero las longitudes de ondas más cortas y más energéticas son siempre las más fáciles de detectar por ser los más potentes.
Cuando la temperatura alcanza aproximadamente los 600°C, el máximo de radiación se halla en el infrarrojo corto. Pero a estas alturas la pequeña cantidad de radiación que se halla en el lado de las energías altas adquiere una importancia especial, porque entra ya en la región de la luz visible roja. El objeto reluce entonces con un rojo intenso.
Este rojo constituye sólo un pequeño porcentaje de la radiación total, pero como da la casualidad de que nuestro ojo lo percibe, le otorgamos toda nuestra atención y decimos que el objeto está al “rojo vivo”.
Si la temperatura sigue subiendo, el máximo de radiación continúa desplazándose hacia las longitudes de ondas cortas y cada vez se emite más luz visible de longitudes cada vez menores. Aunque el objeto radia más luz roja, se van agregando poco a poco luz anaranjada y luz amarilla en cantidades menores pero significativas. Al llegar a los 1.000°C la mezcla de colores la percibimos como naranja, y a los 2.000°C como amarilla. Lo cual no significa que a los 1.000°C sólo se radie luz naranja y a los 2.000°C sólo se radie luz amarilla, porque si fuese así, habría efectivamente que esperar que lo siguiente fuese “color verde”. Lo que en realidad vemos son mezclas de colores.

Al llegar a los 6.000°C (la temperatura superficial del Sol), el máximo de radiación está en el amarillo visible y lo que llega a nuestros ojos son grandes cantidades de luz visible, desde el violeta hasta el rojo. La incidencia simultánea de toda la gama de luz visible sobre nuestra retina nos da la sensación de blanco, y de ahí el color del Sol.
Los objetos más calientes aún que el Sol radian todas las longitudes de ondas de luz visible y en cantidades todavía mayores, pero el máximo de radiación se desplaza al azul, de modo que la mezcla se desequilibra y el blanco adquiere un tinte azulado.
Toda esta travesía se produce para objetos calientes que emiten “espectros continuos”, es decir, que radian luz en la forma de una ancha banda de longitudes de ondas. Ciertas sustancias en condiciones adecuadas, radian sólo luz de determinadas longitudes de onda. El nitrato de bario radia luz verde cuando se calienta, y con ese fin se lo utiliza en los fuegos de artificio, “calor verde”, podríamos decir.
¡Qué bonito es saber!

Tubos de descarga conteniendo gases nobles, excitados eléctricamente, mostrando la luz emitida.
En alguna ocasión todos hemos oído mencionar la palabra “gases nobles”, y sin embargo no siempre sabemos lo que son y el por qué le llaman así.
Los elementos que reaccionan difícilmente o que no reaccionan en absoluto con otros elementos se denominan “inertes”. El nitrógeno y el platino son ejemplos de elementos inertes.
En la última década del siglo pasado se descubrieron en la atmósfera una serie de gases que no parecían intervenir en ninguna reacción química. Estos nuevos gases (helio, neón, argón, kripton, xenón y radón) son más inertes que cualquier otro elemento y se agrupan bajo el nombre de gases inertes.
Los elementos inertes reciben a veces el calificativo de “nobles” porque esa resistencia a reaccionar con otros elementos recordaba un poco a la altanería de la aristocracia. El oro y el platino son ejemplos de “metales nobles”, y por la misma razón se llaman a veces “gases nobles” a los gases inertes. Hasta 1.962, el nombre más común era el de gases inertes, quizá porque lo de nobles parecía poco apropiados en sociedades democráticas.

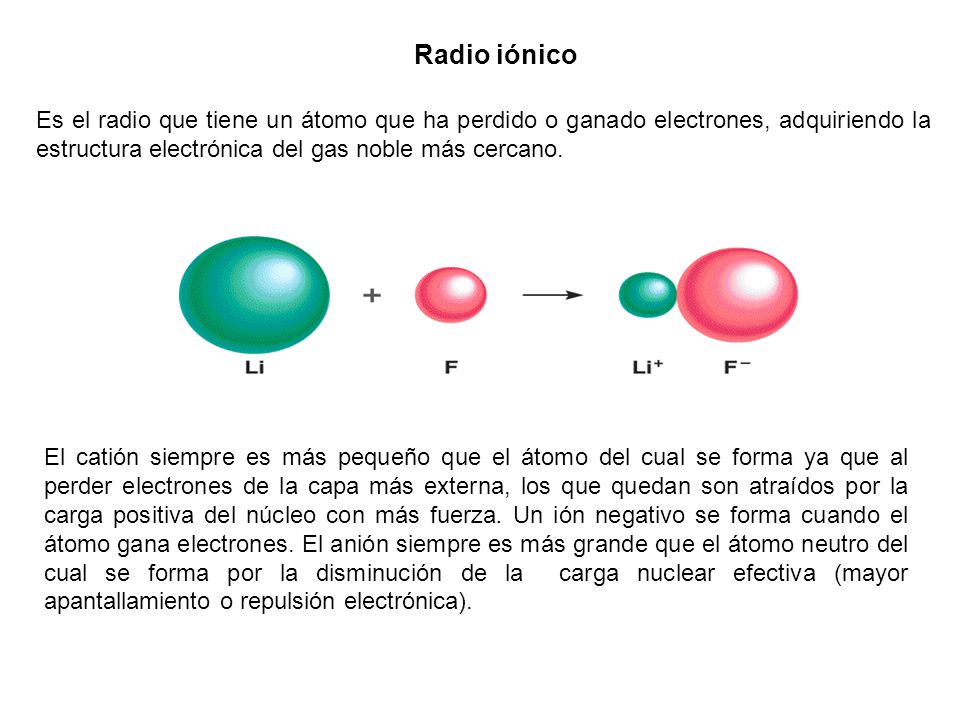
La razón de que los gases inertes sean inertes es que el conjunto de electrones de cada uno de sus átomos está distribuido en capas especialmente estables. La más exterior, en concreto, tiene 8 electrones. Así la distribución electrónica del neón es (2,8) y la del argón (2,8,8). Como la adición o sustracción de electrones rompe esta distribución estable, no pueden producirse cambios electrónicos. Lo cual significa que no pueden producirse reacciones químicas y que estos elementos son inertes.
Ahora bien, el grado de inercia depende de la fuerza con que el núcleo, cargado positivamente y situado en el centro del átomo sujeta a los 8 electrones de la capa exterior. Cuantas más capas electrónicas haya entre la exterior y el centro, más débil será la atracción del núcleo central sobre los electrones de esa última capa de electrones.

Quiere esto decir que el gas inerte más complejo es también el menos inerte. El gas inerte de estructura atómica más complicada es el radón. Sus átomos tienen una distribución electrónica de (2,8,18,32,18,8). El radón, sin embargo está sólo constituido por isótopos radiactivos y es un elemento con el que difícilmente se pueden hacer experimentos químicos. El siguiente en orden de complejidad es el xenón, que es estable. Sus átomos tienen una distribución electrónica de (2,8,18,18,8).
Los electrones más exteriores de los átomos de xenón y radón están bastante alejados del núcleo y, por consiguiente, muy sueltos. En presencia de átomos que tienen una gran apetencia de electrones, son cedidos rápidamente. El átomo con mayor apetencia de electrones es el flúor, y así fue como en 1.962 el químico canadiense Neil Bartlett consiguió formar compuestos de xenón y flúor.
Desde entonces se han conseguido formar también compuestos de radón y kriptón. Por eso los químicos rehúyen el nombre de gases inertes, porque a fin de cuentas, esos gases no son completamente inertes. Hoy día se ha impuesto la denominación de “gases nobles”, y existe toda una rama de la química que se ocupa de los “compuestos de gases nobles”.
Naturalmente, cuanto más pequeño es el átomo de un gas noble, más inerte es, y no se ha encontrado nada que sea capaz de arrancarles algún electrón. El argón, cuya distribución electrónica es de 2,8,8 y el neón, con 2,8 electrones respectivamente, sigue siendo completamente inerte. Y el más inerte de todos es el helio, cuyos átomos contienen una sola capa electrónica con dos electrones (que es lo máximo que puede alojar esta primera capa) que al estar en la primera linea cerca del núcleo positivo, están fuertemente atraídos al tener su carga eléctrica el signo negativo.
Para finalizar diré que los gases nobles (gases inertes, gases raros) están clasificados en el grupo 18 (antiguamente 0) de la tabla periódica de dos elementos y se definen por símbolos que responden a: helio (He), neón (Ne), argón (Ar), kriptón (Kr), xenón (Xe) y radón (Rn).

Ya se dijo antes la configuración electrónica de cada uno de ellos y todas las capas internas están completamente ocupadas, lo que hace que estos elementos, por tanto, constituyan la terminación de un periodo y posean configuración de capa completa, por lo que sus energías de ionización son muy elevadas y su reactividad química escasa.
Como son monoatómicos, las moléculas de los gases nobles poseen simetría esférica, y las fuerzas intermoleculares son muy débiles, por lo que sus entalpías de vaporización son muy bajas.
Con todo lo anteriormente expuesto sobre los gases nobles, espero que el lector del trabajo aquí reflejado pueda tener una idea más amplia y un conocimiento más certero sobre lo que en realidad son los denominados como “gases nobles”.
En comparación con la inmensidad del universo, nos queda aún muchísimo que aprender. Si nos limitamos a nuestro entorno más cercano, la Tierra, ¿cómo hemos podido llegar tan lejos?
¡La curiosidad! y ¡La necesidad! ¡El Instinto!
Fuente: Isaac Asimov
emilio silvera
















 Totales: 83.328.154
Totales: 83.328.154 Conectados: 12
Conectados: 12






















