Jul
2
Dilvurgar la Cienca siempre será positivo
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Física-química ~
Clasificado en Física-química ~
 Comments (0)
Comments (0)

Historia F+Q
Enseñando física y química a través de su historia. Un blog colaborativo de los alumnos del Master de Secundaria


Tal y como comentan Vollhardt y Schore (2007),

En 1985, Curl, Kroto y Smalley efectuaron un sorprendente descubrimiento, que les valió el premio Nobel de Química en 1996: el buckminsterfullereno, de fórmula molecular C60, una nueva forma alotrópica de carbono, de estructura semejante a una pelota de fútbol. Concretamente, observaron que la evaporación del grafito por acción del láser originaba diversos agregados de carbono en fase vapor, entre los que abundaban especies de 60 átomos. La estructura que mejor explica este agregado y que respeta la tetravalencia de carbono es la que forman 20 anillos de benceno fusionados, combándose sobre sí mismos hasta adoptar una disposición esférica con las valencias “sobrantes” definiendo 12 pentágonos: una especie de icosaedro truncado de 60 vértices equivalentes. La molécula fue bautizada como buckminsterfullereno, en honor a Buckminster Fuller, ya que su forma recuerda a las bóvedas geodésicas que él diseñaba(Bellapart, 2016). (…)

El enorme interés que suscitó el hallazgo del C60 condujo rápidamente a varios descubrimientos interesantes y al desarrollo de numerosas aplicaciones, de entre las que destacan, por su potencial utilidad, los nanotubos (Silvera, 2017), moléculas cilíndricas basadas en el motivo estructural de los fullereno.> (p. 680)
Pero este acercamiento a los alótropos del Carbono por parte del mundo del arte, representado en este caso por la arquitectura, no es, ni mucho menos, el primero del que se tiene constancia. De hecho, no hay más que recordar cómo Supermán, con solo la fuerza de su puño, era capaz de convertir el carbón en diamante. (Salkind, Salkind y Lester, R., 1983)…

¿Cómo es posible que algo tan pequeño como el Carbono esconda tantas posibilidades? La respuesta la sabíais antes de que os preguntase… ¡Gracias a la química!:)
A partir de este texto y del clip de vídeo, la actividad que se le plantearía a los alumnos sería un trabajo por grupos de 4 personas. El trabajo duraría tres días: en el primero se repartiría el texto y se empezarían a trabajar las cuestiones más prácticas. En el segundo juntarían y cribarían la información recabada en su casa, y prepararían la exposición de los apartados, uno de los cuales (elegido al azar por la profesora) tendrían que presentar al resto de la clase al día siguiente.
Las cuestiones que se les plantearían en el trabajo serían las siguientes:
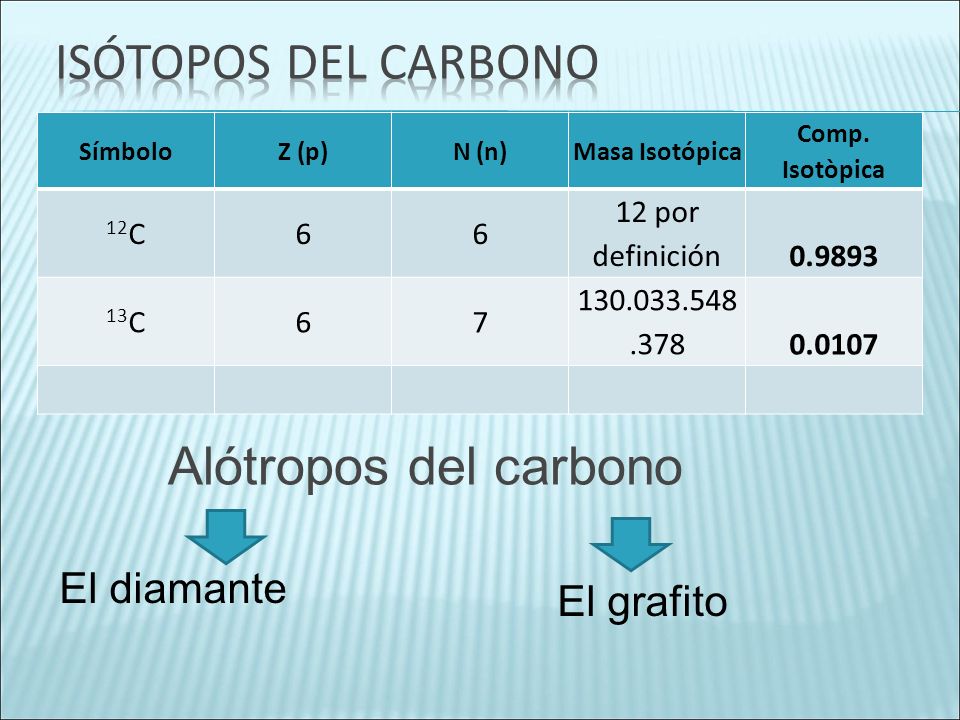
A) El año pasado estudiasteis el concepto de alótropo. Definidlo y nombrad al menos tres alótropos más de los más significativos para el Carbono (hay más de 40).
B) Si sumamos la os conocimientos del año pasado lo que habéis recordado que hacía Supermán, podréis completarsin problemas los recuadros del siguiente diagrama extraído de Nóguez (2013).
Si os fijáis, debajo del diagrama aparece el valor de la energía libre de la reacción para el paso de diamante a grafito. ¿Qué os sugiere este dato? ¿Cómo lo explicaríais, sabiendo que viene dado a temperatura y presión ambientales? ¿Qué consecuencias tiene y cómo lo justificaríais, considerando vuestra experiencia.
C) Justificad y esquematizad, según la teoría de enlace de valencia y de los orbitales híbridos, los enlaces covalentes existentes entre los átomos de los dos alótropos del Carbono mencionados en el texto, diamante y fullereno, así como de al menos otro del que conozcáis las características estructurales.
D) En vuestra casa, buscad información acerca de las aplicaciones potenciales del fullereno, y de su relevancia tecnológica. Además, buscad al menos otro ejemplo representativo de elemento con formas alotrópicas cuyas propiedades sean muy diferentes entre sí.

Objetivos de la actividad:
-Recordar y ampliar el concepto de alótropo, ya visto en Física y Química de 1º de Bachillerato.
-Entender el diagrama de fases que relaciona los alótropos cristalinos del carbono, así como sus distintas propiedades y aplicaciones.
-Recordar y aplicar el concepto de variación de entalpía, variación de entropía y Energía Libre de Gibbs en una reacción química, que se verá en mayor detalle en el siguiente bloque.
-Afianzar la teoría de enlace de valencia y la teoría de orbitales híbridos, que se habría explicado los días previos en clase. Aplicar dicha teoría correctamente al ejemplo de los alótropos del carbono.
-Familiarizarse con la búsqueda de información científica.
-Desarrollar las competencias de trabajo en equipo y de comunicación y expresión oral.
![]()
Un nuevo alótropo del silicio promete revolucionar la industria fotovoltaica
Criterios de evaluación:
-Entiende y define adecuadamente el concepto de alotropía química. Está ampliamente familiarizado con el ejemplo del Carbono: conoce y nombra a sus alótropos más significativos, sabe cómo se relacionan en el diagrama de fases, qué estructura tiene cada uno y cuáles son sus propiedades y aplicaciones más relevantes. (30%)
-Es capaz explicar el enlace covalente y la geometría de distintas moléculas sencillas empleando la teoría de hibridación. (40%)
-Recuerda el concepto de Energía Libre de Gibbs, Es capaz de justificar la espontaneidad de una reacción química considerando tanto sus factores entálpicos como entrópicos. (5%)
-Encuentra información adecuada, que evalúa e integra crítica y justificadamente en el contexto que se le pide. (5%)
-Trabaja en equipo de forma cooperativa. (5%)
-Expone de forma clara y crítica sus resultados al resto de la clase, al igual que escucha y participa en los expuestos por sus compañeros. (15%)
Referencias
-Bellapart (2016). Magic Badalona Mall. Bellapart. Recuperado en : http://www.bellapart.com/en/projects/estructura-prueba/magic-badalona-mall.html
-Nóguez, Á. (2013). Elementos no metálicos y sus compuestos. Slide Share. Recuperado de: https://es.slideshare.net/Angelnoguez/elementos-no-metlicos-y-suscompuestos.
-Salkind, Salkind (productores) y Lester, R. (director). (1983). Superman III [Cinta cinematográfica]. EU.: Warner Bros Pictures.
-Silvera, V. (2017) El grafeno es uno de los materiales del futuro. España: Blog de Emilio Silvera V. Dedicado al Universo, la Mente y la Ciencia en general. Recuperado de: http://www.emiliosilveravazquez.com/blog/2017/03/19/%C2%A1la-fisica-%C2%BFhasta-donde-nos-llevara-5/-Villatoro, F. R. (2014) Supermán y la cristalografía en el cine. La ciencia de la Mula Francis. Recuperado de: http://francis.naukas.com/2014/06/16/superman-y-la-cristalografia-en-el-cine/
-Vollhardt, K. P., Schore, N. E., (2007) Química Orgánica, Estructura y función (Martínez, D.A., trad.). Universidad de California , E.U.: Ediciones Omega.
















 Totales: 75.488.639
Totales: 75.488.639 Conectados: 54
Conectados: 54






















