Feb
5
¡Materia inerte! ¿Pero es inerte la materia?
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Química ~
Clasificado en Química ~
 Comments (4)
Comments (4)
¿No os hace pensar que nosotros estemos hechos, precisamente, de lo que llamamos materia inerte evolucionada hasta el nivel de la consciencia? La materia adopta múltiples personajes y se viste con distintos ropajes según requiera la ocasión: Ahora está como plasma constituyendo estrellas, o, se comprime hasta límites inimaginables en lo que conocemos como estrellas de neutrones o las singularidades de agujeros negros, se pueden formar moléculas de H2O y constituirse en el preciado líquido tan necesario para la vida como el Agua, o,
Todo es materia que, en cada momento, adopta la forma y las funciones que la Naturaleza le ha encomendado. No importa que adopte la forma de inanimada o moviente, de todas las maneras materia es
“El mundo está hecho de diversos materiales. Algunos materiales existen desde el principio, cuando el mundo se formó y no existían seres vivos en él. Estos se llaman MATERIALES INORGÁNICOS. Otros materiales son o fueron producidos por los seres vivos (bacterias, algas, hongos, plantas, insectos y otros animales).”
Pero el mundo inorgánico es sólo una parte del inmenso mundo molecular. El resto lo constituye el mundo orgánico, que es el de las moléculas que contienen carbono y otros átomos y del que quedan excluidos, por convenio y características especiales, los carbonatos, bicarbonatos y carburos metálicos, los cuales se incluyen en el mundo inorgánico.
Según he dicho muchas veces, los quarks u y d se hallan en el seno de los nucleones (protones y neutrones) y, por tanto, en los núcleos atómicos. Hoy día, éstos se consideran como una subclase de los hadrones.
La composición de los núcleos (lo que en química se llama análisis cualitativo) es extraordinariamente sencilla, ya que como es sabido, constan de neutrones y protones que se pueden considerar como unidades que dentro del núcleo mantienen su identidad. Tal simplicidad cualitativa recuerda, por ejemplo, el caso de las series orgánicas, siendo la de los hidrocarburos saturados la más conocida. Recordad que su fórmula general es , lo que significa que una molécula de hidrocarburo contiene n átomos de carbono (símbolo C) y (2n+2) átomos de hidrógeno (símbolo H).
El número de protones y neutrones determina al elemento, desde el hidrógeno (el más simple), al uranio (el más complejo), siempre referido a elementos naturales que son 92; el resto son artificiales, los conocidos transuránidos en cuyo grupo están el einstenio o el plutonio, artificiales todos ellos.
Los núcleos, como sistemas dinámicos de nucleones, pertenecen obviamente a la microfísica y, por consiguiente, para su descripción es necesario acudir a la mecánica cuántica. La materia, en general, aunque presumimos de conocerla, en realidad, nos queda mucho por aprender de ella.
El número de especímenes atómicos es finito, existiendo ciertas razones para suponer que hacia el número atómico 173 los correspondientes núcleos serían inestables, no por razones intrínsecas de inestabilidad “radiactiva” nuclear, sino por razones relativistas. Ya antes me referiría a las especies atómicas, naturales y artificiales que son de unos pocos millares; en cambio, el número de moléculas conocidas hasta ahora comprende varios millones de especímenes, aumentando continuamente el número de ellas gracias a las síntesis que se llevan a cabo en numerosos laboratorios repartidos por todo el mundo.
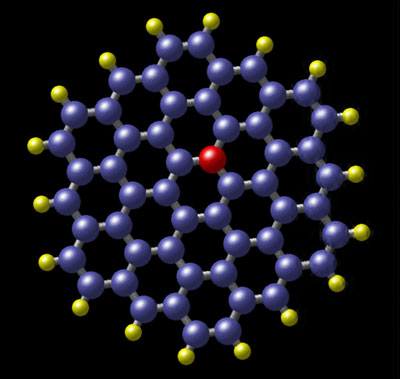
Una molécula es una estructura con individualidad propia, constituida por núcleos y electrones. Obviamente, en una molécula las interacciones deben tener lugar entre núcleos y electrones, núcleos y núcleos y electrones y electrones, siendo del tipo electromagnético.
Debido al confinamiento de los núcleos, el papel que desempeñan, aparte del de proporcionar la casi totalidad de la masa de la molécula, es poco relevante, a no ser que se trate de moléculas livianas, como la del hidrógeno. De una manera gráfica podríamos decir que los núcleos en una molécula constituyen el armazón de la misma, el esqueleto, cuya misión sería proporcionar el soporte del edificio. El papel más relevante lo proporcionan los electrones y en particular los llamados de valencia, que son los que de modo mayoritario intervienen en los enlaces, debido a que su energía es comparativamente inferior a la de los demás, lo que desempeña un importante papel en la evolución.
Desde las moléculas más sencilla, como la del hidrógeno con un total de 2 electrones, hasta las más complejas, como las de las proteínas con muchos miles de ellos, existe toda una gama, según decía, de varios millones. Esta extraordinaria variedad de especies moleculares contrasta con la de las especies nucleares e incluso atómicas.
Sin entrar en las posibles diferencias interpretativas de estas notables divergencias, señalaré que desde el punto de vista de la información, las especies moleculares la poseen en mucho mayor grado que las nucleares y atómicas.
Dejando aparte los núcleos, la información que soportan los átomos se podría atribuir a la distribución de su carga eléctrica, y en particular a la de los electrones más débilmente ligados. Concretando un poco se podría admitir que la citada información la soportan los orbitales atómicos, pues son precisamente estos orbitales las que introducen diferencias “geométricas” entre los diferentes electrones corticales.
Justamente esa información es la que va a determinar las capacidades de unión de unos átomos con otros, previo el “reconocimiento” entre los orbitales correspondientes. De acuerdo con la mecánica cuántica, el número de orbitales se reduce a unos pocos. Se individualizan por unas letras, hablándose de orbitales s, p, d, f, g, h. Este pequeño número nos proporciona una gran diversidad.
La llamada hibridación (una especie de mezcla) de orbitales es un modo de aumentar el número de mensajes, esto es, la información, bien entendido que esta hibridación ocurre en tanto y en cuanto dos átomos se preparan para enlazarse y formar una molécula. En las moléculas, la información, obviamente, debe abarcar todo el edificio, por lo que en principio parece que debería ser más rica que en los átomos. La ganancia de información equivale a una disminución de entropía; por esta razón, a la información se la llama también negantropía.
En términos electrónicos, la información se podría considerar proporcionada por un campo de densidad eléctrica, con valles, cimas, collados, etc, es decir, curvas isoelectrónicas equivalentes formalmente a las de nivel en topografía. Parece razonable suponer que cuanto más diverso sean los átomos de una molécula, más rica y variada podrá ser su información, la información que pueda soportar.
Todo tiene su propio colorido, sin importar donde se pueda encontrar en el Espacio, en la Tierra, el el Aire o en el Mar. La materia adopta mil formas u colores y también varían sus funciones. Sin embargo, todas esas formas y lo que representan, finalmente son Quarks y Leptones.
La enorme variedad de formas, colores, comportamientos, etc., que acompaña a los objetos, incluidos los vivientes, sería una consecuencia de la riqueza en la información que soportan las moléculas (y sus agregados) que forman parte de dichos objetos. Ello explicaría que las moléculas de la vida sean en general de grandes dimensiones (macromoléculas). La inmensa mayoría de ellas contiene carbono. Debido a su tetravalencia y a la gran capacidad que posee dicho átomo para unirse consigo mismo, dichas moléculas pueden considerarse como un esqueleto formado por cadenas de esos átomos.
“Los investigadores de la Universidad de California han estudiado la teoría de 1973 y tras varias comprobaciones, han afirmado que en realidad sí existe el hexametilbenceno, lo que significa que una única molécula de carbono puede tener asociados hasta un máximo de seis átomos.”
“Moléculas cargadas eléctricamente en forma de pelotas de fútbol, arrojan luz sobre el enigmático contenido del Medio Interestelar (ISM), el gas y el polvo que llena el espacio interestelar.
La vida como la conocemos se basa en moléculas que contienen carbono, y este descubrimiento muestra que las moléculas de carbono complejas pueden formarse y sobrevivir en el entorno hostil del espacio interestelar.
Dado que las estrellas y los planetas se forman a partir de nubes colapsantes de gas y polvo en el espacio, “el ISM difuso puede considerarse como el punto de partida de los procesos químicos que en última instancia dan origen a los planetas y la vida”, dijo Martin Cordiner de la Universidad Católica de América, Washington.
“La identificación completa de sus contenidos proporciona información sobre los ingredientes disponibles para crear estrellas y planetas”. Cordiner, adscrito al Centro de Vuelo Espacial Goddard de la NASA, es el autor principal de un artículo sobre esta investigación, realizada mediante observaciones con el telescopio espacial Hubble y publicado en Astrophysical Journal Letters.
Las moléculas identificadas por Cordiner y su equipo son una forma de carbono llamada “Buckminsterfullerene”, también conocida como “Buckyballs” –en honor de Buckminster Fuller, diseñador del domo geodésico parecido a la molécula–, que consta de 60 átomos de carbono (C60) dispuestos en una esfera hueca. Se ha encontrado C60 en algunos casos raros en la Tierra en rocas y minerales, y también puede aparecer en hollín de combustión a alta temperatura.”
Aquí se han detectado moléculas Interestelares Prebióticas
El carbono no es el único átomo con capacidad para formar los citados esqueletos. Próximos al carbono en la tabla periódica, el silicio, fósforo y boro comparten con dicho átomo esa característica, si bien en un grado mucho menor.
Refiriéndonos al silicio, que para nosotros es el más importante, señalaremos que las “moléculas” que dicho átomo forma con el oxígeno y otros átomos, generalmente metálicos poseyendo gran nivel de información, difieren en varios aspectos de las moléculas orgánicas, es decir, de las que poseen un esqueleto de átomos de carbono.
El mundo de los silicatos es de una gran diversidad, existiendo centenares de especies minerológicas. Esas diferencias se refieren fundamentalmente a que el enlace químico en el caso de las moléculas orgánicas es covalente, y cuando se forma la sustancia correspondiente (cuatrillones de moléculas) o es un líquido, como es el caso de los aceites, o bien un sólido que funde fácilmente. Entre las moléculas que lo forman se ejercen unas fuerzas, llamadas de Van der Waals, que pueden considerarse como residuales de las fuerzas electromagnéticas, algo más débiles que éstas. En cambio, en los silicatos sólidos (como en el caso del topacio) el enlace covalente o iónico no se limita a una molécula, sino que se extiende en el espacio ocupado por el sólido, resultando un entramado particularmente fuerte.
Al igual que para los cristales de hielo, en la mayoría de los silicatos la información que soportan es pequeña, aunque conviene matizar este punto. Para un cristal ideal así sería en efecto, pero ocurre que en la realidad el cristal ideal es una abstracción, ya que en el cristal real existen aquí y allá los llamados defectos puntuales que trastocan la periodicidad espacial propia de las redes ideales. Precisamente esos defectos puntuales podían proporcionar una mayor información.
Como decimos más abajo… ¡serían millones!
Si prescindimos de las orgánicas, el resto de las moléculas que resultan de la combinación entre los diferentes átomos no llega a 100.000, frente a los varios millones de las primeras. Resulta razonable suponer que toda la enorme variedad de moléculas existentes, principalmente en los planetas rocosos, se haya formado por evolución de los átomos, como corresponde a un proceso evolutivo. La molécula poseería mayor orden que los átomos de donde procede, esto es, menor entropía. En su formación, el ambiente se habría desordenado al ganar entropía en una cierta cantidad tal, que arrojarse un balance total positivo.
No puedo dejar pasar la oportunidad, aunque sea de pasada, de mencionar las sustancias.
Las así llamadas, son cuerpos formados por moléculas idénticas, entre las cuales pueden o no existir enlaces químicos. Veremos varios ejemplos. Las sustancias como el oxígeno, cloro, metano, amoníaco, etc,, se presentan en estado gaseoso en condiciones ordinarias de presión y temperatura. Para su confinamiento se embotellan, aunque existen casos en que se encuentran mezcladas en el aire (os podéis dar una vueltecita por el polo químico de Huelva).
En cualquier caso, un gas como los citados consiste en un enjambre de las moléculas correspondientes. Entre ellas no se ejercen fuerzas, salvo cuando colisionan, lo que hacen con una frecuencia que depende de la concentración, es decir, del número de ellas que están concentradas en la unidad de volumen; número que podemos calcular conociendo la presión y temperatura de la masa de gas confinada en un volumen conocido.
Decía que no existen fuerzas entre las moléculas de un gas. En realidad es más exacto que el valor de esas fuerzas es insignificante porque las fuerzas residuales de las electromagnéticas, a las que antes me referí, disminuyen más rápidamente con la distancia que las fuerzas de Coulomb; y esta distancia es ordinariamente de varios diámetros moleculares.
Podemos conseguir que la intensidad de esas fuerzas aumente tratando de disminuir la distancia media entre las moléculas. Esto se puede lograr haciendo descender la temperatura, aumentando la presión o ambas cosas. Alcanzada una determinada temperatura, las moléculas comienzan a sentir las fuerzas de Van der Waals y aparece el estado líquido; si se sigue enfriando aparece el sólido. El orden crece desde el gas al líquido, siendo el sólido el más ordenado. Se trata de una red tridimensional en la que los nudos o vértices del entramado están ocupados por moléculas.
Todas las sustancias conocidas pueden presentarse en cualquiera de los tres estados de la materia (estados ordinarios y cotidianos en nuestras vidas del día a día).
El Plasma es el material del que están hechas las estrellas debido a su alta temperatura
Si las temperaturas reinantes, como decíamos en páginas anteriores, es de miles de millones de grados, el estado de la materia es el plasma, el material más común del universo, el de las estrellas (aparte de la materia oscura, que no sabemos ni lo que es, ni donde está, ni que “estado” es el suyo).
El estado de la materia más abundante del Universo es el Plasma
En condiciones ordinarias de presión, la temperatura por debajo de la cual existe el líquido y/o sólido depende del tipo de sustancia. Se denomina temperatura de ebullición o fusión la que corresponde a los sucesivos equilibrios (a presión dada) de fases: vapor ↔ líquido ↔ sólido. Estas temperaturas son muy variadas, por ejemplo, para los gases nobles son muy bajas; también para el oxígeno (O2) e hidrógeno (H2). En cambio, la mayoría de las sustancias son sólidos en condiciones ordinarias (grasas, ceras, etc).
Las sustancias pueden ser simples y compuestas, según que la molécula correspondiente tenga átomos iguales o diferentes. El número de las primeras es enormemente inferior al de las segundas. Una estrella, por ejemplo, está conformada por sustancias compuestas y, nosotros también.
emilio silvera
















 Totales: 75.557.314
Totales: 75.557.314 Conectados: 43
Conectados: 43
























el 2 de marzo del 2010 a las 21:27
Mis conocimientos de química son casi nulos por lo que con mayor razon me interesan estadas entradas en que se trata de sustancias químicas. Pero me surgen varias preguntas básicas.
Se dice allí que bajando la temperatura de un gas la intensidad de fuerzas entre sus moléculas aumenta llegando la sustancia al estado líquido y luego al sólido. Tambien se dijo que dicha intensidad de fuerza se puede incrementar tambien aumentando la presión. Pregunto, ¿tambien aumentando la presión lo suficiente una sustancia pasará del estado gaseoso al líquido y luego al sólido? Yo tenía entendido que el aumento en la presión de un gas tenía como consecuencia el incremento de la temperatura y no su descenso. ¿Esto es así? Si fuera así, ¿una y otra afirmación no se están contradiciendo?
el 3 de marzo del 2010 a las 0:33
Hola estimado Javier.
Si buscas “Ley de Boyle” tal vez eches luz a tu duda que ahora es mía.
Yo tengo entendido que los cuerpos en (cualquier estado) se contraen si baja la temperatura y se dilatan cuando aumenta.
Si no entiendo mal, cuando se abre un “bomberito” (un tubo de gas comprimido), el gas se dilata rápidamente absorbiendo el calor circundante, lo que provoca el congelamiento del pico y la sublimación de la humedad del ambiente en la superficie del metal. Creo que en algo de eso se basa la refrigeración, pero ya parece que me metí en camisa de once varas y vamos a necesitar ayuda de los compañeros para rescatarnos.
Un saludo desde Montevideo.
el 5 de febrero del 2021 a las 19:26
Acerca de las distintas propiedades de la materia:
De un simple su unica consecuencia otro simple, asi como una parte no puede concebir mas que otra parte o bien una parte nunca prodra concebir un todo.
Lo complejo es consecuencia de un sumatorio de distintas partes muy dispares.
El todo como cada una de sus partes, es un hablar eufemisticamente sin mas.
Hasta aqui estaremos todos de acuerdo.
Lo que caracteriza toda propiedad quimica material es el binomio electron-orbital y una metodologia explicita, esto es un compendio de perpectiva a cual mas suspicaz.
Llamamos materia : hacer aspavientos ofuscando nuestro intelecto.
Conclusion:”El universo, un giño que hace la materia, para que nuestro precario intelecto pergeñe un sueño”.
el 6 de febrero del 2021 a las 7:34