May
7
El “universo” fascinante de lo muy pequeño
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en General ~
Clasificado en General ~
 Comments (0)
Comments (0)
« Matemáticas que describen la Naturaleza

Muchas veces hemos hablado del electrón que rodea el núcleo, de su carga eléctrica negativa que complementa la positiva de los protones y hace estable al átomo; tiene una masa de 1/1.836 de la del núcleo más ligero (el del hidrógeno). La importancia del electrón es vital en el .

El núcleo atómico es la parte central de un átomo tiene carga positiva, y concentra más del 99.99% de la masa total del átomo. fuerza es la responsable de mantener unidos a los nucleones (protón y neutrón) que coexisten en el núcleo atómico venciendo a la repulsión electromagnética los protones que poseen carga eléctrica del mismo signo (positiva) y haciendo que los neutrones, que no tienen carga eléctrica, permanezcan unidos entre sí y también a los protones.
Hasta ahí, lo que es el núcleo. Sin embargo, la existencia de los átomos que las moléculas y los cuerpos -grandes y pequeños- que conforman los objetos del universo, es posible gracias a los electrones que, rodean el núcleo atómico y, al tener carga negativa similar a la positiva de los protones, crean la estabilidad necesaria que todo nuestro mundo sea como lo podemos observar.

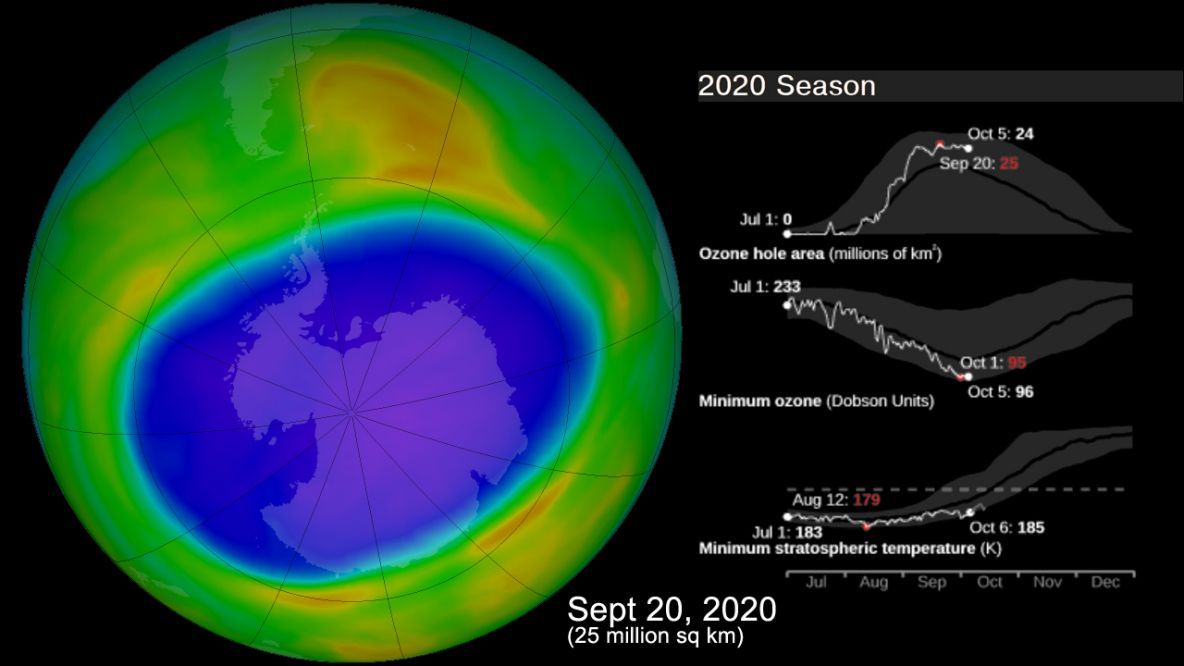
Los cuantos cosas bellas y útiles como el ozono atmosférico
Pero busquemos los “cuantos”. La física del siglo XX empezó exactamente en el año 1900, cuando el físico alemán Max Planck propuso una posible solución a un problema que había estado intrigando a los físicos durante años. Es el problema de la luz que emiten los cuerpos a una cierta temperatura, y también la radiación infrarroja emitida, con menor intensidad, por los objetos más fríos (radiación de cuerpo negro).
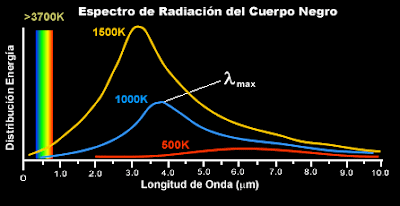
Según la física clásica, la energía radiada debería ser igual todas las longitudes de onda, y al aumentar la temperatura, la radiación debería ser uniformemente más intensa. Para explicar esto, Planck supuso que cada una de las partículas que constituyen la materia, está oscilando y emitiendo energía en forma de radiación electromagnética; esta energía emitida no tomar un valor cualquiera, sino que debe ser múltiplo entero de un valor mínimo llamado cuanto o paquete de energía.
Estaba bien aceptado entonces que esta radiación tenía un origen electromagnético y que se conocían las leyes de la naturaleza que regían estas ondas electromagnéticas. También se conocían las leyes para el frío y el calor, la así llamada “termodinámica”, o al menos eso parecía. Pero si utilizamos las leyes de la termodinámica para calcular la intensidad de una radiación, el resultado no tiene ningún sentido. Los cálculos nos dicen que se emitiría una cantidad infinita de radiación en el ultravioleta más lejano y, desde luego, esto no es lo que sucede. Lo que se observa es que la intensidad de la radiación muestra un pico a una cierta longitud de onda característica, y que la intensidad disminuye tanto para longitudes mayores como para menores. Esta longitud de onda característica es inversamente proporcional a la temperatura absoluta de objeto radiante (la temperatura absoluta se define por una escala de temperatura que empieza a 273º cero). Cuando a 1.000º C un objeto se pone al “rojo vivo”, el objeto está radiando en la zona de luz visible.
Lo que Planck propuso fue simplemente que la radiación podía ser emitida en paquetes de un tamaño dado. La cantidad de energía de uno de esos paquetes, o cuantos, es inversamente proporcional a la longitud de onda, y por tanto, proporcional a la frecuencia de radiación emitida. La fórmula es E = hν, donde E es la energía del paquete, ν es la frecuencia y h es una constante fundamental de la naturaleza, la constante de Planck. Cuando Planck calculó la intensidad de la radiación térmica imponiendo esta nueva , el resultado coincidió perfectamente con las observaciones.
Sabemos que la corriente eléctrica es el movimiento de electrones, siendo éstos portadores de cargas eléctricas negativas. Cuando los electrones se mueven, se origina una corriente eléctrica. La corriente es igual al de cargas en movimiento entre un intervalo de tiempo.

Poco tiempo después, en 1905, Einstein formuló teoría de una manera mucho más tajante: él sugirió que los objetos calientes no son los únicos que emiten radiación en paquetes de energía, sino que toda la radiación consiste en múltiplos del paquete de energía de Planck. El príncipe francés Louis-Victor de Broglie, dándole otra vuelta a la teoría, propuso que no sólo cualquier cosa que oscila tiene energía, sino que cualquier cosa con energía se debe comportar como una “onda” que se extiende en una cierta región del espacio, y que la frecuencia ν de la oscilación verifica la ecuación de Planck. Por lo tanto, los cuantos asociados con los de luz deberían verse como una clase de partículas elementales: el fotón. Todas demás clases de partículas llevan asociadas diferentes ondas oscilantes de campos de fuerza.
También en el movimiento de los átomos dentro del núcleo, presente la simetría y la belleza de la Naturaleza.

El curioso comportamiento de los electrones en el interior del átomo, descubierto y explicado por el famoso físico danés Niels Bohr, se pudo atribuir a las ondas de de Broglie. Poco después, en 1926, Edwin Schrödinger cómo escribir la teoría ondulatoria de de Broglie con ecuaciones matemáticas exactas. La precisión con la cual se podían realizar cálculos era asombrosa, y pronto quedó claro que el comportamiento de todos los objetos pequeños quedaba exactamente determinado por las recién descubiertas “ecuaciones de ondas cuánticas”.
Está bien comprobado que la mecánica cuántica funciona de maravilla…, pero, sin embargo, surge una pregunta muy formal: ¿qué significan realmente estas ecuaciones?, ¿qué es lo que están describiendo? Cuando Isaac Newton, allá en 1867 formuló cómo debían moverse los planetas alrededor del Sol, estaba claro todo el mundo qué significaban sus ecuaciones: que los planetas estaban siempre en una posición bien definida des espacio y que sus posiciones y sus velocidades en un momento concreto determinan inequívocamente cómo evolucionarán las posiciones y las velocidades en el tiempo.

Pero los electrones todo es diferente. Su comportamiento parece estar envuelto en misterio. Es como si pudieran “existir” en diferentes lugares simultáneamente, como si fueran una nube o una onda, y esto no es un efecto pequeño. Si se realizan experimentos con suficiente precisión, se determinar que el electrón parece capaz de moverse simultáneamente a lo largo de trayectorias muy separadas unas de otras. ¿Qué puede significar todo esto?
Niels Bohr consiguió responder a esta pregunta de forma tal que con su explicación se pudo seguir , y muchos físicos siguen considerando su respuesta satisfactoria. Se conoce como la interpretación de Copenhague de la mecánica cuántica que, dicho sea de paso, con la que no todos están de acuerdo.

En mecánica cuántica, la relación de indeterminación de Heisenberg o principio de incertidumbre establece la imposibilidad de que determinados pares de magnitudes físicas observables y complementarias sean conocidas con precisión arbitraria
leyes de la mecánica cuántica han sido establecidas con mucha precisión; permite cómo calcular cualquier cosa que queramos saber. Pero si queremos “interpretar” el resultado, nos encontramos con una curiosa incertidumbre fundamental: que varias propiedades de las partículas pequeñas no pueden estar bien definidas de manera simultánea. Por ejemplo, podemos determinar la velocidad de una partícula con mucha precisión, pero entonces no sabremos exactamente dónde se encuentra; o a la inversa, podemos determinar la posición con precisión, pero entonces su velocidad queda mal definida. Si una partícula tiene espín (rotación alrededor de su eje), la dirección alrededor de la cual rotando (la orientación del eje) no puede ser definida con gran precisión.
No es fácil explicar de forma sencilla de dónde viene esta incertidumbre, pero existen ejemplos en la vida cotidiana que tienen algo parecido. La altura de un tono y la duración en el tiempo durante el cual oímos el tono tienen una incertidumbre mutua similar. Para afinar un instrumento musical se debe escuchar una nota durante un cierto intervalo de tiempo y , por ejemplo, con un diapasón que debe vibrar también durante un tiempo. Notas muy breves no tienen bien definido el tono.



Para que las reglas de la mecánica cuántica funcionen, es necesario que todos los fenómenos naturales en el mundo de las cosas pequeñas estén regidos por las mismas reglas. Esto incluye a los virus, bacterias e incluso a las personas. Sin embargo, cuando más grande y más pesado es un objeto, más difícil es observar las desviaciones de las leyes del movimiento “clásicas” debidas a la mecánica cuántica. Me gustaría referirme a exigencia tan importante y tan peculiar de la teoría con la palabra “holismo”. Esto no es exactamente lo mismo que entienden algunos filósofos por holismo, y que podría definir como “el todo es más que la suma de sus partes”. Si la física nos ha enseñado algo es justo lo contrario. Un objeto compuesto de un gran de partículas puede ser entendido exactamente si se conocen las propiedades de sus partes (partículas); basta que sepamos sumar correctamente (¡y esto no es nada fácil en mecánica cuántica!). Lo que entiendo por holismo es que, efectivamente, el todo es la suma de las partes, pero sólo se puede hacer la suma si todas las partes obedecen a las mismas leyes. Por ejemplo, la constante de Planck, h, que es igual a 6’626075… × 10-34 Julios segundo, debe ser exactamente la misma cualquier objeto en cualquier sitio, es decir, debe ser una constante universal, no importa en qué galaxia la podamos medir.
Einstein y otros pioneros de la Mecánica Cuántica, tales como Edwin Schrödinger…, creían que hay más de lo que se ve…
reglas de la mecánica cuántica funcionan tan bien que refutarlas resulta realmente difícil. Los trucos ingeniosos descubiertos por Werner Heisemberg, Paul Dirac y muchos otros mejoraron y completaron las reglas generales. Pero Einstein y otros pioneros como Erwin Schrödinger siempre presentaron serias objeciones a interpretación. Quizá funcione bien, pero ¿Dónde está exactamente el electrón?, ¿en el punto x o en el punto y? En pocas palabras, ¿Dónde está en realidad?, y ¿Cuál es la realidad que hay detrás de nuestras fórmulas? Si tenemos que creer a Bohr, no tiene sentido buscar tal realidad. Las reglas de la mecánica cuántica, por sí mismas, y las observaciones realizadas con detectores son las únicas realidades de las que podemos hablar.

La mecánica cuántica puede ser definida o resumida así: en principio, con las leyes de la naturaleza que conocemos se puede predecir el resultado de cualquier experimento, en el sentido que la predicción consiste en dos factores: el primer factor es un cálculo definido con exactitud del efecto de las fuerzas y estructuras, tan riguroso como las leyes de Isaac Newton para el movimiento de los planetas en el Sistema Solar; el segundo factor es una arbitrariedad estadística e incontrolable definida matemáticamente de forma estricta.
Las partículas seguirán una distribución de probabilidades dadas, primero de una forma y luego de otra. Las probabilidades se calcular utilizando la ecuación de Schrödinger de función de onda (Ψ) que, con muchas probabilidades nos indicará el lugar probable donde se encuentra una partícula en un momento dado.
Muchos estiman que esta teoría de las probabilidades desaparecerá cuando se consiga la teoría que explique, de completa, todas las fuerzas; la buscada teoría del todo, lo que implica que nuestra descripción actual incluye variables y fuerzas que (aún) no conocemos o no entendemos. Esta interpretación se conoce como hipótesis de las variables ocultas.
Albert Einstein, Nathan Rosen y Boris Podolski idearon un “Gedankenexperiment”, un experimento hipotético, realizado sobre el papel, el cual la mecánica cuántica predecía como resultado algo que es imposible de reproducir en ninguna teoría razonable de variables ocultas. Más tarde, el físico irlandés John Stewar Bell consiguió convertir este resultado en un teorema matemático; el teorema de imposibilidad.
emilio silvera
















 Totales: 72.913.071
Totales: 72.913.071 Conectados: 92
Conectados: 92
























