Sep
12
Los átomos… Las estrellas… ¡Nuestra curiosidad!
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en General ~
Clasificado en General ~
 Comments (0)
Comments (0)
James Clerk Maxwell, el hombre sintiéndose poeta de la Naturaleza, inspirado escribió:
“En tiempos y lugares totalmente inciertos,
Los átomos dejaron su camino celeste,
Y mediante abrazos fortuitos,
Engendraron todo lo que existe.”
Y, al menos en lo que conocemos y que esté hecho de materia bariónica (la que emite radiación), así resulta ser. En la materia, de una u otra manera, están presentes las fuerzas fundamentales que rigen en el Universo, como por ejemplo, la radiactividad, la fuerza nuclear débil, la Gravedad y, en los átomos la fuerza nuclear fuerte.
- Radiación electromagnética.
- Radiación ionizante.
- Radiación térmica.
- Radiación corpuscular.
- Radiación solar.
- Radiación nuclear.
- Radiación de cuerpo negro.
- Radiación no ionizante.
TIPOS DE RADIACIÓN
- ALFA:
núcleos de Helio ( = 2 protones + 2 neutrones) - BETA: electrones
- GAMMA: ondas electromagnéticas
En los albores del siglo XX se hacía cada vez más evidente que alguna clase de energía “atómica” tenía que ser responsable de la potencia del Sol y las otras estrellas del cielo. Ya por 1898, sólo dos años después del descubrimiento de la radiactividad por Becquerel, el geólogo norteamericano Thomas Chrowder Chamberlin especulaba que los átomos eran “complejas organizaciones y centros de enormes energías”, y que “las extraordinarias condiciones que hay en el centro del Sol pueden… liberar una parte de su energía”. Pero nadie sabía cuál era ese mecanismo, ni cómo podía operar, hasta que no se llegó a saber mucho más sobre los átomos y las estrellas.
El intento de lograr tal comprensión exigió una colaboración cada vez mayor entre los astrónomos y los físicos nucleares. Su trabajo llevaría, no sólo a resolver la cuestión de la energía estelar, sino también al descubrimiento de una trenza dorada en la que la evolución cósmica se entrelazaba con la historia atómica y la estelar.
Todo está hecho de átomos… ¡También nosotros!
La clave para comprender la energía estelar fue, como previó Chamberlin, conocer la estructura del átomo. Que el átomo tenía una estructura interna podía inferirse de varias líneas de investigación, entre ellas, el estudio de la radiactividad: para que los átomos emitiesen partículas, como se había hallado que lo hacían en los laboratorios de Becquerel y los Curie, y para que esas emisiones los transformasen de unos elementos en otros, como habían demostrado Rutherford y el químico inglés Frederick Soddy, los átomos debían de ser algo más que simples unidades indivisibles, como implicaba su nombre (de la voz griega que significa “imposible de cortar”). Pero la física atómica aún debía recorrer un largo camino para llegar a comprender su estructura.
Becquerel y los Curie
De los tres principales constituyentes del átomo -el protón, el neutrón y el electrón-, sólo el electrón había sido identificado (por J.J. Thomson, en los últimos años del siglo XIX). Nadie hablaba de energía “nuclear”, pues ni siquiera se había demostrado la existencia del núcleo atómico, y mucho menos de sus partículas constituyentes, el protón y el neutrón, que serían identificados respectivamente, por Thomson en 1913 y James Chadwick en 1932. Desvelar la fuerza nuclear fuerte y los Bosones emisarios, los Gluones, tuvo que esperar algún tiempo.
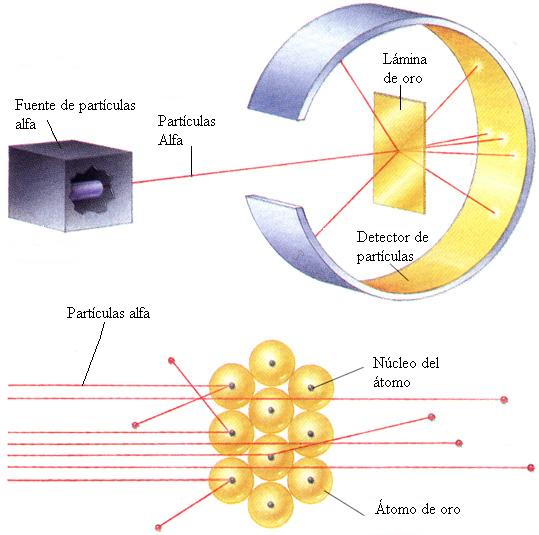
Rutherford, Hans Geiger y Ernest Marsden se contaban entre los más expertos entendidos sobre la cartografía atómica. En Manchester, de 1909 a 1911, sondearon el átomo lanzando corrientes de “partículas alfa” subatómicas -núcleos de helio- contra delgadas laminillas de oro, plata, estaño y otros metales. La mayoría de las partículas alfa se escapaban a través de las laminillas, pero, para asombro de los experimentadores, algunas rebotaban hacia atrás, Rutherford pensó durante largo tiempo e intensamente en este extraño resultado; era tan sorprendente, señalaba, como si una bala rebotase contra un pañuelo de papel. Finalmente, en una cena en casa en 1911, anunció a unos pocos amigos que había dado con una expliación: que la mayoría de la masa de un átomo reside un un diminuto núcleo masivo. Midiendo las tasas de dispersión hacia atrás obtenida de laminillas compuestas de varios elementos, Rutherford pudo calcular la carga y el diámetro máximo del núcleo atómico del blanco. Esa era, pues, una explicación atómica de los pesos de los elementos. Los elementos pesados son más pesados que los elementos ligeros porque los núcleos de sus átomos tienen mayor masa.

El ámbito de los electrones fue explorado luego por el físico danés Niels Bohr, quien demostró que los electrones ocupan órbitas, o capas, discretas que rodean el núcleo. (Durante un tiempo Bohr concibió el átomo como un sistema solar en miniatura, pero este análisis pronto demostró ser inadecuado; el átomo no está regido por la mecánica newtoniana sino por la mecánica cuántica.) Entre sus muchos otros éxitos, el modelo de Bohr revelaba la base física de la espectroscopia. El número de electrones de un átomo está determinado por la carga eléctrica del núcleo, la que a su vez se debe al número de protones del núcleo, que es la clave de la identidad química del átomo.
Cuando un electrón cae de una órbita externa a una órbita interior emite un fotón. La longitud de onda de ese fotón está determinada por las órbitas partículas entre las que el electrón efectúa la transición. Y esta es la razón de que un espectro, que registra las longitudes de onda de los fotones, revele los elementos químicos que forman la estrella u otro objeto que estudie el espectros-copista. En palabras de Max Planck, el fundador de la mecánica cuántica, el modelo de Bohr del átomo proporciona “la llave largamente buscada de la puerta de entrada al maravilloso mundo de la espectroscopia, que desde el descubrimiento del análisis espectral había desafiado obstinadamente todos los itentos de conocerlo”.

Las estrellas son enormes aglomeraciones de gas, principalmente Hidrogeno, cuya temperatura es tan alta debido a la fusión de este elemento, que irradian luz a lo largo de todo el espectro electromagnético. Poseen diferentes temperaturas que varían desde los 2000 grados Celsius hasta los 50000.

El color es cambiante en razón de la temperatura
De la misma forma que al calentar una pieza de metal cambia de color, al principio rojo, luego amarillo hasta llegar al blanco, el color de una estrella varia según su temperatura superficial. Las estrellas más frías son las rojas, y las mas calientes las azules. Estos colores suelen percibirse a simple vista, como por ejemplo Antares (la estrella principal de Scorpius) que es de color rojo, o Rigel (en Orion) de color azul. En astronomía se utiliza la escala Kelvin para indicar temperaturas, donde el cero absoluto es -273 grados Celsius.
Para definir el color de una estrella, Johnson y Morgan (1950), crearon el sistema UBV (del inglés Ultravioleta, Azul, Visible). Las mediciones se realizaban mediante un fotómetro fotoeléctrico para medir la intensidad de la radiación el longitudes de onda específicas:
















 Totales: 74.984.793
Totales: 74.984.793 Conectados: 43
Conectados: 43























