Ene
12
¿Puede existir la vida basada en el silicio?
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en General ~
Clasificado en General ~
 Comments (7)
Comments (7)
Todos sabemos que la vida está esencialmente basada en el carbono y quizá alguna vez te hayas sentido tentado a preguntarte: pero ¿por qué la vida no pudo evolucionar de un elemento diferente? Se dice que el carbono es la base de la vida porque se encuentra presente en las estructuras biológicas de todos los seres vivos. Vemos carbono en moléculas como la glucosa, que es aquella que encontramos en alimentos como frutas y verduras, y al incorporarlas nos dan energía, por ejemplo; En las proteínas que nos permiten transportar el oxígeno que inspiramos.
Una vida de carbono
El carbono es el elemento químico que sustenta toda la vida en la Tierra. En la naturaleza existen 92 elementos químicos en estado natural. Es decir, 92 tipos distintos de átomos. Son las pequeñas piezas que se combinan entre sí para formar toda la materia conocida. Los átomos se combinan para formar moléculas, y las moléculas se unen para formar la materia. Todo lo que vemos a nuestro alrededor se forma con sólo esos 92 elementos. Incluidos nosotros mismos.
El 95% del cuerpo de los seres vivos se compone por sólo cuatro elementos: carbono, oxígeno, hidrógeno y nitrógeno. De ellos, el carbono es el más importante. Sin él, no podría formarse el ADN. Las proteínas, glúcidos, vitaminas y grasas también son compuestos de carbono.

¿Qué elemento de la tabla periódica sería un buen candidato para reemplazar al carbono?, pues recordemos cómo se organizan los elementos en la tabla. Los elementos en un mismo grupo tienden a mostrar propiedades similares. El carbono pertenece al grupo IV, y el elemento más cercano a este en ese grupo es el silicio. Ambos tienen 4 electrones de valencia, lo que hace posible que ambos puedan formar hasta cuatro enlaces covalentes.
El primero en proponer en serio la vida basada en el silicio como una alternativa a la vida basada en el carbono en la comunidad científica fue el astrofísico alemán Julius Schneider. El usó esta teoría en 1891 para predecir la vida en los planetas rocosos de nuestro sistema solar. Luego en 1893, James Emerson Reynolds propuso que la vida basada en el silicio podría existir, pero a temperaturas extremadamente altas, porque los compuestos de silicio conocidos en ese momento eran estables, incluso a altas temperaturas.
Treinta años después, J.B.S Haldane sugirió que la vida basada en el silicio podría existir en las rocas fundidas en el interior de la Tierra. El manto de la Tierra contiene suficiente silicio y, como se dijo antes, los compuestos de silicio son muy estables a altas temperaturas. En años recientes el Dr. Thomas Gold, un renombrado astrofísico austríaco (ahora fallecido), escribió un libro sobre la posibilidad de la vida basada en el silicio en el interior de la Tierra: The Deep Hot Biosphere, un libro ciertamente muy controversial y que valdría la pena leer.
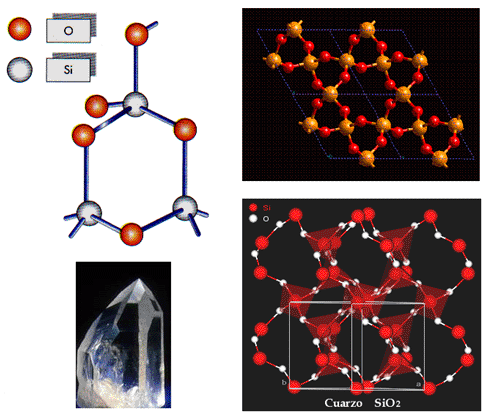
Con el conocimiento de que el carbono y el silicio tiene propiedades químicas similares y que el silicio es el segundo elemento más abundante en la corteza terrestre (mucho más abundante que el carbono), hay que preguntarse no sólo si la vida de silicio puede existir sino también por qué no existe ya, al menos en nuestras condiciones ambientales. La respuesta según Nicholas Linn se encuentra principalmente en el tamaño y la diferencia entre la energía de los orbitales de los átomos de carbono y los átomos de silicio.
¿Podría la vida de Silicio estar entre nosotros y no la hemos sabido percibir?
Un átomo de silicio tiene 8 electrones más que un átomo de carbono y el tamaño de enlace homogéneo es de 235 pm a comparación de los 77 pm del carbono. La nube electrónica más grande del silicio hace que los electrones de valencia tengan mayor energía, así los enlaces del silicio generalmente son más débiles que los del carbono. Esta diferencia por sí sola es suficiente para explicar por qué el carbono crea vida y el silicio crea rocas, al menos en las condiciones estándares de la Tierra.
Usando el software de modelamiento molecular y química computacional PC Spartan Pro v5.1, Nicholas Linn de la Universidad de Carolina del Norte realizó experimentos para determinar que o bien las diferencias entre el carbono y el silicio se pueden superar o que las propiedades químicas del silicio simplemente no son aptas para la formación de cualquier vida.
Molécula de Carbono
Una comparación de carbono y el silicio se elaboró y las propiedades de cada uno fueron probados. Ejecutando un alto nivel de cálculo (densidad funcional), la aplicación Spartan optimizó las geometrías de las moléculas, calculados energías totales y rastreando las superficies de densidad de los enlaces en isovalores estándar (.08 electrones / ų ). A través de estos métodos, la estabilidad y las interacciones del silicio y el carbono en las moléculas de tipo orgánico puede ser investigado empíricamente y la viabilidad de la vida a base de silicio puede ser determinada.
Los Resultados de Linn
Linn realizó diferentes experimentos comparando las moléculas de carbono reales con las moléculas de sílicio teóricas de la misma estructura. El primero tenía que ver con el modelamiento de la molécula de etino más conocida como acetileno, el alquino más sencillo.

C2H2 es una molécula de carbono simple con un enlace triple, la molécula de carbono más simple conteniendo un triple enlace. La versión de silicio produjo una molécula con mas de una sexta parte de la energía de la molécula de carbono y con una densidad electrónica baja en la región del enlace triple, sugiriendo un compuesto altamente inestable y débilmente enlazado. Un ensayo similar realizó con el eteno o etileno.

El compuesto de silicio tenía una muy alta energía y una baja densidad electrónica en el área de enlace, lo que sugiere que los enlaces dobles de silicio son muy débiles y que probablemente el silicio no forma dobles enlaces.
El tercer experimento consistía en modelar un anillo de benceno (C6H6), con átomos de silicio. Los anillos de benceno se producen en casi todas las grandes moléculas orgánicas no polimerizadas como los grupos fenilo y alteran a nivel crítico las propiedades moleculares.
Nuevamente, los resultados indican que el silicio no puede formar estructuras como lo hace el carbono. El ángulo del enlace Si-Si-H es demasiado agudo y es muy probable que no sea estable. Debido a que el átomo de silicio es mayor que el de carbono, no puede duplicar la unión π del carbono, que es necesaria para estabilizar los electrones deslocalizados en C6H6 y mantener la estructura de resonancia del anillo. Los resultados sugieren que el silicio no puede formar un anillo estable de seis miembros.
Otro experimento realizado ponía a prueba la creación de productos del proceso de respiración. En la respiración normal, la reacción
C6H12O6 + 6O2 —> 6CO2 + 6H2O + energía
ocurre. El CO2 producido es una sustancia de desecho gaseosa que es fácil de excretar. Si esta reacción ocurriera con el silicio, se produciiía SiO2 . Cuando fue modelado, el SiO2 formaba un sólido en vez de un gas, cosa que no es fácil de remover de un organismo.
Como el silicio tiene una alta afinidad por el oxígeno, estos sólidos se producirían con frecuencia, creando a una criatura bastante frágil. Ambos detalles complicarían severamente la fisiología de un organismo.
Otros anillos podrían sustituir al benceno, tales como las estructuras heterogéneas modelados a continuación, aunque tampoco se forman bien. Estas moléculas tenían altas energías y baja densidad en torno a los átomos de silicio, sin embargo las densidades individuales de los enlaces eran lo suficientemente altas como para que una molécula puede ser sostenida en condiciones apropiadas (anillo de densidad de C4O de comparación).
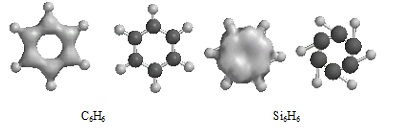
La incapacidad del silicio para formar cadenas mas largas se evidencia abajo.
La densidad del enlace en las cadenas de silicio son muy bajas para sustentar el polímero. Sin este tipo de cadenas, algunas moléculas indispensables como la glucosa y varios ácidos grasos no existirían para que un organismo las utilice.
Pero algo de evidencia empírica existente sustenta la posibilidad de que exista la vida basada en el silicio:

El silicio puede formar cadenas estables con un híbrido de silicio y carbono.
El siliciotambién interacciona con ácido fluorhídrico (un ácido débil), una sustancia que podría ser usada como solvente para separar moléculas específicas; el agua actúa de manera similar en la vida de plantas y animales ordenando varias vitaminas basadas en su solubilidad.

Estructuras porosas llamadas “zeolitas”, que son combinaciones de metaloides tipo minerales, como el silicio, pueden actuar como membranas semipermeables (como paredes de las células), lo que permite que ciertas moléculas pasen a través mientras que otras no. La zeolita en la parte inferior izquierda está transportando una molécula de xileno.

Después de revisar las propiedades del sílicio, es muy poco probable que exista vida basada en el silicio, al menos en las condiciones terrestres en las que hay vida como la conocemos. Simplemente el silicio no puede formar tanta diversidad de moléculas como lo hace el carbono bajo las condiciones naturales actuales, sin embargo el silicio tiene algunas propiedades que el carbono no posee. Tal vez en algún recóndito lugar del Universo es probable que pueda haberse desarrollado alguna forma de vida basada en el silicio. Como propuso el Dr. Thomas Gold, tal vez sea bajo condiciones de temperatura extrema, o quién sabe. Espero que un día seamos lo suficientemente afortunados como para encontrarla, si no es aquí en la Tierra, en otro lugar.
Por mi parte me alegro de estar compuesto de carbono, un organismo compuesto de silicio se vería masomenos así según Dickinson y Schaller:
![]()
|
La vida basada en el silicio podría ser como cristales animados, como en este dibujo de Dickinson y Schaller. Los elementos estructurales, como fibra de vidrio, conectadas por elementos tensores para crear estructuras flexibles y delicadas. |
Sinceramente creo que se vería bien como mascota.
Bueno, hasta aquí el post, algo largo, pero creo que interesante.
A darle Biotecnología!
Hasta la próxima!
Referencias bibliográficas
- Linn, N. 2001. Can Silicon based life exist?. Summer Ventures in Science and Mathematics. UNC, Charlotte.
- ATS. 2004. Silicon-based life. Is silicon-based life similar to terrestrial life possible?
- Silicon-based life. En: http://www.daviddarling.info/encyclopedia/S/siliconlife.html (14/02/13)
















 Totales: 84.818.585
Totales: 84.818.585 Conectados: 103
Conectados: 103























el 24 de enero del 2015 a las 7:49
Esta podría ser una buena respuesta a tal dilema de si existe o no la vida de silicio.
Autor: Biól. Nasif Nahle
el 24 de enero del 2015 a las 18:22
¡Hola, Emilio..!
Para resolver los interrogantes que has planteado como objeciones a una vida basada en el silicio, pienso, que aquí es donde el exhorto “¡¡¡TO THINK OUT THE BOX!!!“ cobra especial importancia.
¿Qué te hace pensar que organismos basados en el silicio han de tener que vérselas con procesos tan tediosos como el digestivo (con todos sus subprocesos), reproductivo, etc.? ¿Por qué, en su estructura deberían disponer, quizá de un Sistema Nervioso Central y otro Periférico? ¿Y otro respiratorio? etc.
Por ejemplo, por cuanto se refiere al sistema de reproducción, supongamos que tenemos una criatura cristalina que crece como cualquier cristal haría (incorporando moléculas flotantes en el entorno en el cual viviera). Para reproducirse podría (de alguna manera) en su medio ambiente inducir una diferencia de potencial que condujera a la producción de un rayo y ese rayo partiera el cristal a la mitad ó en varios (n > 2) trozos. Cada trozo podría vivir, crecer y reproducirse a su antojo.
Atentamente…
el 25 de enero del 2015 a las 7:42
Sí, amigo Adolfo, tal como hemos podido constatar más de una vez (cientos y miles), debemos elegir la tendencia a !Pensar fuera de la Caja! Descubir nuevos caminos, nuevas formas de entender las cosas y, sobre todo, ser cauto y no decir que no a nada, cualquier cosa podría suceder, ser cierta o existir aunque, en nuestro mundo, no la podamos contemplar. Sin embargo, mi reflexión sobre el Carbono y el Silicio en relación a la vida, es simplemente, una deducción lógica que se deriva del conocimiento que lo que de esos dos elementos se puede esperar, de sus comportamientos y posibilidades físicas a la hora de hacer una u otra cosa. En el caso de la vida, veo que el Silicio está muy limitado pero… ¡Negar que pudiera ser… no lo niego!
Entre otrtas razones porque no tengo la sabiduría suficiente para afirmar nada en tal sentido y, en ese caso, sólo me queda exponer lo que pienso al respecto que, no niego que tal reflexión la esté emitiendo desde “Dentro de la Caja” y, precisamente, por tal razón, me sale como me sale, es decir, arraigada en el pensamiento clásico y sin dejar que el futuro se haga dueño de la situación.
¿Quién nos diría que podían existir planetas de diamantes? Te acuerdas de aquella noticias:
Allápor el mes de Octubre de 2012 los medios anunciaron la existencia de un planeta, 55 Cancri que era un planeta de diamante que orbitaba una estrella como el Sol. Son planetas muy ricos en Carbono y muy pobres en oxígeno. Así, la Naturaleza nos puede dar sorpresas continuamente y, siendo el Universo para nosotros “casi infinito”, ¿quién sabe lo por ahí fuera nos podremos encontrar? Es arriegado negar nada, después de haber descubiertos púlsares, agujeros negros y lo que hacen las estrellas en sus núcleos atómicos con la materia… ¡Todo podría ser posible!
Claro que, no podemos perder de vista en el Universo en el que estamos y las leyes que lo rigen que, como nos dijo el amigo Einstein, son iguales en todas partes y, si eso es así (como parece que es), lo que pasa aquí pasará allí y en cualquier otro lugar y, si la vida de Silicio existe en el Universo, seguro que está aquí con nosotros pero, es una clase de vida que ni podemos dertectar.
Un saludo cordial amigo mío.
el 7 de abril del 2017 a las 2:19
Pero diganme si pongo la interrogante de existe vida en otros planetas ademas del silicio digamos q si es que hay seres con capacidades de poder sobrevivir sin este elemento o el carbono cual podría ser dicho elemento
el 7 de abril del 2017 a las 5:01
Amigo mío, no tengo ni la menor idea de qué otro elemento podría ser idóneo para conformar otras clases de vida. Lo único que sabemos (por tenerlo aquí en la Tierra –todos los seres vivos que conocemos están basados en el carbono-), es que otros elementos no tienen las propiedades del carbono para que puedan formar la vida. En nuestro Universo, cualquier cosa que imaginemos podría estar en él presente. Simplemente con mirar en nuestro propio mundo y ver el dominio de los extremófilos y ver cómo pueden vivir… Ya es maravilla más que suficiente como para no negar nada de lo que podamos imaginar.
Saludos.
el 7 de octubre del 2024 a las 10:12
Que gozo encontrar un analisis tan serio respecto de este tema.
Y leyendo y pensando me surge una pregunta.
Suponiendo que la humanidad estuviera destinada a evolucionar hacia organismos basados en Silicio, o mas facil aun: si nos encontráramos con otra civilización cuya vida esté basada en Silicio, ¿cuales deberían ser las condiciones ambientales para que este tipo de estructuras proliferaran naturalmente?
Estaríamos hablando de un planeta muy caliente y con presiones muy bajas, por ejemplo? O de una atmósfera muy densa? Etc…
Saludos
el 7 de octubre del 2024 a las 18:57
Si realmente existe algún mundo que de cobijo a una biología de Carbono, como bien apuntas, debe ser especial, tendría condiciones diferentes a la de nuestro planeta que, siendo rico en Silicio, no contiene ninguna clase de vida de este elemento.
Para más abundancia en el tema:
“Si hay un rey que gobierna sobre toda la vida en la Tierra es el carbono. Todos los organismos del planeta construyen todas y cada una de las partes de sus células con moléculas cuyo armazón es este átomo. Somos, como decía los alienígenas en la primera película de la serie Star Trek, ‘unidades de carbono’. Ahora bien, ¿se puede construir vida sin él?
Como dice el astroquímico de la NASA Max Bernstein, no hay en toda la tabla periódica un elemento con una química más parecida a la suya que el silicio: “Está en el lugar correcto en la tabla periódica, justo debajo del carbono. Puede formar cuatro enlaces, como el carbono y moléculas tan parecidas que es posible que se pueda construir toda un química paralela”. Por desgracia, no todo el monte es orégano; el silicio también presenta sus inconvenientes. “No conocemos que la química entre el hidrógeno y el silicio sea estable como sucede con el carbono; así, mientras que los hidrocarburos son estables, los análogos de silicio no lo son. Y con el oxígeno pasa algo similar: mientras que los enlaces carbono-oxígeno se pueden hacer y deshacer, con el silicio son eternos. Esto limita fuertemente la capacidad del silicio para ser base de la vida, pero eso no quita que en la bioquímica pueda desempeñar un papel más importante que el que ahora tiene, que es prácticamente nulo”.
El misterio del silicio
Sea como fuere, hay un tema sobre el que aún no se tiene una respuesta clara: el papel del silicio en la aparición de la vida en la Tierra y por qué ésta ha evitado completamente su uso.
Si hay algo que caracteriza a la naturaleza viva es el empleo de prácticamente todo lo que tiene a su alcance: metales como el hierro, componente fundamental de la sangre, el magnesio en la clorofila o el raro molibdeno en procesos metabólicos. Por eso, lo que llama la atención es que le haya dado la espalda al silicio, un elemento abundante que posee tanto propiedades características de los metales como de los no-metales. Contra todo pronóstico este elemento solo aparece en algunos compuestos bio-inorgánicos, como las conchas de silicio de las algas diatomeas. Nunca ha encontrado un hueco en la química del carbono.
Ahora bien, hay algunos científicos piensan que el silicio ha desempeñado un papel oscuro y poco conocido y es quien está detrás de uno de los enigmas más peculiares de la química de la vida: la quiralidad de moléculas como los carbohidratos o los aminoácidos.
La extraña la quiralidad
La quiralidad es una propiedad geométrica que tienen algunas moléculas y viene a decir que no se pueden superponer con su imagen especular. El ejemplo clásico son nuestras manos: es imposible superponer la izquierda con su imagen reflejada en un espejo, que es la derecha. En el caso de los compuestos de la vida encontramos que carbohidratos y aminoácidos presentan esta peculiar propiedad. Y aquí aparece el enigma: los primeros son de mano derecha mientras que los segundos son zurdos. ¿Por qué es así si cuando se producen de manera espontánea aparece la misma cantidad de ambas manos? No hay una respuesta válida a este misterio pero es aquí donde nuestro silicio tenga algo que decir.
Una de las hipótesis mas llamativas de cómo pudo aparecer la primera molécula autorreproductora la propuso el químico británico Alexander Graham Cairns-Smith en 1985. Según él, la famosa sopa primordial donde se cocinó el origen de la vida en nuestro planeta necesitó de un puchero en forma de cristales de arcilla. La idea es que, antes de cualquier primitivo ADN o ARN, pudieron haber existido otros sistemas que almacenasen y copiaran la información genética. Para Cairns-Smith estos sistemas fueron microcristales de arcilla, cuya unidad de construcción básica son los silicatos. Entre sus propiedades más importantes se encuentra que poseen una gran reactividad; de hecho, los agricultores saben que es bueno que haya arcilla en los campos de cultivo pues favorece reacciones químicas que benefician a las plantas. Cairns-Smith propuso que las moléculas orgánicas vivían pegadas a las arcillas, que actuaban como catalizadores de sus reacciones, hasta que un día se produjo un “relevo genético”: en aquellas primitivas moléculas apareció la capacidad de replicarse y evolucionar por su cuenta. Si realmente sucedió así -y eso es algo que está por demostrar- el silicio de las arcillas podría explicar la existencia de esa quiralidad de las moléculas orgánicas: bastó una ligera desviación en la posición de este átomo en el compuesto para definir la preferencia por un tipo de orientación en aminoácidos y carbohidratos.
Evidentemente se trata de una idea altamente especulativa, pero no más que la de aquellos científicos que creen posible una vida de silicio. Lo cierto es que todo apunta a que es, cuando menos, improbable. La prueba la tenemos en nuestro propio planeta: aunque el silicio es uno de los elementos más abundantes de la corteza terrestre (representa el 28% frente al 0,03% para el carbono) está completamente ausente de la química de la vida. Si fuera posible la vida en silicio, solamente por la abundancia de este elemento habría aparecido aquí. Tampoco se han encontrado pruebas observacionales que sugieran la existencia de una biología basada en el silicio, o tan solo de productos prebióticos de silicio. Nada en meteoritos, cometas, medio interestelar, atmósferas de los planetas gigantes… en todos ellos se han encontrado óxidos de silicio pero no sustancias como silanos o siliconas, que podrían ser los precursores de una bioquímica de silicio.
Los problemas del silicio
El atractivo del silicio como alternativa al carbono se encuentra en que, por su posición en la tabla periódica, gran parte de su química básica es similar. Por ejemplo, el carbono se combina con cuatro átomos de hidrógeno para formar metano, CH4, y el silicio produce silano, SiH4, los silicatos son análogos de carbonatos, ambos elementos forman largas cadenas, o polímeros, en los que se alternan con el oxígeno. Pero el problema fundamental del silicio es la poderosa afinidad que tiene por el oxígeno. Cuando respiramos, el carbono se oxida creando dióxido de carbono, que es un gas y resulta fácil de eliminar del cuerpo. Sin embargo, con el silicio lo que se produce es dióxido de silicio o sílice, arena, un sólido, a todas luces un compuesto muy complicado de eliminar.
Otro de los inconvenientes del silicio es que carece de la necesaria versatilidad química a la hora de formar las moléculas que requiere el metabolismo de un ser vivo. Sí puede construir cadenas largas pero la capacidad del silicio para unirse a átomos como el hidrógeno, oxígeno, nitrógeno, fósforo, azufre y metales como el hierro, magnesio y zinc es sensiblemente inferior a la del carbono. Es más, cuando interacciona con otros átomos, el silicio crea moléculas que el químico Norman Pace de la Universidad de Colorado define como “monótonas comparadas con las del universo de las macromoléculas orgánicas”. La razón se encuentra en el propio átomo de silicio, que es mucho más grande que el carbono -tiene una mayor masa y radio atómico-, lo que hace que sea complicado formar dobles enlaces, algo fundamental en gran cantidad de moléculas orgánicas, como cetonas, ésteres, ácidos carboxílicos… Por otro lado los silanos, que serían los compuestos de silicio e hidrógeno análogos a los alcanos del carbono, son muy reactivos con el agua y cuando forman largas cadenas se descomponen espontáneamente. Todo son inconvenientes.
La mayoría de los científicos comparten lo que el astrónomo y apasionado de la vida extraterrestre Carl Sagan llamó “chovinismo del carbono”: la vida pide este elemento químico y ningún otro. Claro que a esto algunos le responden diciendo que ese chovinismo es, en realidad, el humo que ciega nuestros ojos.”
Referencias:
Delsemme, A. (1998) Our cosmic origins, Cambridge University Press
Dick, S. J. (1996) The biological universe, Cambridge University Press
Goldsmith, D. y Owen, T. (1993) The search for life in the universe, Addison-Wesley