Jun
2
Conociendo la Materia I
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en General ~
Clasificado en General ~
 Comments (0)
Comments (0)
Entre 1.906 y 1.908 (hace ahora un siglo) Rutherford realizó constantes experimentos disparando partículas alfa contra una lámina sutil de metal (como oro o platino), para analizar sus átomos. La mayor parte de los proyectiles atravesaron la barrera sin desviarse (como balas a través de las hojas de un árbol). Pero no todos. En la placa fotográfica que le sirvió de blanco tras el metal, Rutherford descubrió varios impactos dispersos e insospechados alrededor del punto central. Comprobó que algunas partículas habían rebotado. Era como si en vez de atravesar las hojas, algunos proyectiles hubiesen chocado contra algo más sólido.
Rutherford supuso que aquellas “balas” habían chocado contra una especie de núcleo denso, que ocupaba sólo una parte mínima del volumen atómico y ese núcleo de intensa densidad, desviaban los proyectiles que acertaban a chocar contra él. Ello ocurría en muy raras ocasiones, lo cual demostraba que los núcleos atómicos debían ser realmente ínfimos, porque un proyectil había de encontrar por fuerza muchos millones de átomos al atravesar la lámina metálica.
Era lógico suponer, pues, que los protones constituían ese núcleo duro. Rutherford representó los protones atómicos como elementos apiñados alrededor de un minúsculo “núcleo atómico” que servía de centro (después de todo eso, hemos podido saber que el diámetro de ese núcleo equivale a algo más de una cienmilésima del volumen total del átomo.).
En 1.908 se concedió a Rutherfor el premio Nóbel de Química, por su extraordinaria labor de investigación sobre la naturaleza de la materia. El fue el responsable de importantes descubrimientos que permitieron conocer la estructura de los átomos en esa primera avanzadilla.
Desde entonces se pueden descubrir con términos más concretos los átomos específicos y sus diversos comportamientos. Por ejemplo, el átomo de hidrógeno posee un solo electrón. Si se elimina, el protón restante se asocia inmediatamente a alguna molécula vecina; y cuando el núcleo desnudo de hidrógeno no encuentra por este medio un electrón que participe, actúa como un protón -es decir, una partícula subatómica-, lo cual le permite penetrar en la materia y reaccionar con otros núcleos si conserva la suficiente energía.

El helio, que posee dos electrones, no cede uno con tanta facilidad. Sus dos electrones forman un caparazón hermético, por lo cual el átomo es inerte. No obstante, si se despoja al helio de ambos electrones, se convierte en una partícula alfa, es decir, una partícula subatómica portadora de dos unidades de carga positiva.
Hay un tercer elemento, el litio, cuyo átomo tiene tres electrones. Si se despoja de uno o dos, se transforma en ion. Y si pierde los tres, queda reducida a un núcleo desnudo, con una carga positiva de tres unidades.
Las unidades de una carga positiva en el núcleo atómico deben ser numéricamente idéntica a los electrones que contiene como norma, pues el átomo suele ser un cuerpo neutro y esta igualdad de lo positivo con lo negativo, es el equilibrio. Y, de hecho, los números atómicos de sus elementos se basan en sus unidades de carga positiva, no en las de carga negativa, porque resulta fácil hacer variar el número de electrones atómicos dentro de la formación iónica, pero, en cambio, se encuentran grandes dificultades si se desea alterar el número de sus protones.
Apenas esbozado este esquema de la construcción atómica, surgieron nuevos enigmas. El número de unidades con carga positiva en un núcleo no equilibró, en ningún caso, el peso nuclear ni la masa, exceptuando el caso del átomo de hidrógeno. Para citar un ejemplo, se averiguó que el núcleo de helio tenía una carga positiva dos veces mayor que la del núcleo de hidrógeno; pero, como ya se sabía, su masa era cuatro veces mayor que la de este último. Y la situación empeoró progresivamente a medida que se descendía por la tabla de elementos, e incluso cuando se alcanzó el uranio, se encontró un núcleo con una masa igual a 238 protones, pero una carga que equivalía sólo a 92.
¿Cómo era posible que un núcleo que contenía cuatro protones (según se suponía del núcleo de helio) tuviera sólo dos unidades de carga positiva? Según la más simple y primera conjetura emitida, la presencia en el núcleo de partículas cargadas negativamente y con peso despreciable, neutralizaba dos unidades de su carga. Como es natural, se pensó también –en el electrón-. Se podría componer el rompecabezas si se suponía que el núcleo de helio estaba integrado por cuatro protones y dos electrones neutralizadores, lo cual deja libre una carga positiva neta de dos, y así sucesivamente, hasta llegar al uranio, cuyo núcleo tendría, pues, 238 protones y 146 electrones, con 92 unidades libres de carga positiva.
El hecho de que los núcleos radiactivos emitieran electrones (según se había comprobado ya, por ejemplo, en el caso de las partículas beta) reforzó esta idea general.
Dicha teoría prevaleció durante más de una década, hasta que, por caminos indirectos, llegó una respuesta mejor, como resultado de otras investigaciones.
Pero entretanto se había presentado algunas objeciones rigurosas contra dicha hipótesis. Por lo pronto, si el núcleo estaba constituido esencialmente de protones, mientras que los ligeros electrones no aportaban prácticamente ninguna contribución a la masa, ¿Cómo se explicaba que las masas relativas de varios núcleos no estuvieran representadas por números enteros? Según los pesos atómicos conocidos, el núcleo del átomo cloro, por ejemplo, tenía una masa 35’5 veces mayor que la del núcleo del hidrógeno. ¿Acaso significaba esto que contenía 35’5 protones? Ningún científico (ni entonces ni ahora) podía aceptar la existencia de medio protón.
Este singular interrogante encontró una respuesta incluso antes de solventar el problema principal. Y ello dio lugar a una interesante historia.
ÍSOTOPOS
Construcción de bloques uniformes
Allá por 1.816, el físico inglés William Prout había insinuado ya que el átomo de hidrógeno debía de entrar en la constitución de todos los átomos. Con el tiempo se fueron desvelando los pesos atómicos, y la teoría de Prout quedó arrinconada, pues se comprobó que muchos elementos tenían pesos fraccionarios (para lo cual se tomó el oxígeno, tipificado a 16). El cloro (según dije antes) tiene un peso atómico aproximado de 35’5, o para ser exactos, de 35’457. Otros ejemplos son el antimonio, con un peso atómico de 121’75; el bario, con 127’34; el boro, con 10’811, y el cadmio, con 112’40.
Hacia principios de siglo se hizo una serie de observaciones desconcertantes, que condujeron al esclarecimiento. El inglés William Crookes (el del “tubo Crookes) logró disociar del uranio una sustancia cuya ínfima cantidad resultó ser mucho más radiactiva que el propio uranio. Apoyándose en su experimento, afirmó que el uranio no tenía radiactividad, y que esta procedía exclusivamente de dicha impureza, que él denomino “uranio X”. Por otra parte, Henri Becquerel descubrió que el uranio purificado y ligeramente radiactivo adquiría mayor radiactividad con el tiempo, por causas desconocidas. Si se dejan reposar durante algún tiempo, se podía extraer de él repetidas veces uranio activo X. Para decirlo de otra manera: por su propia radiactividad, el uranio se convertía en el uranio X, más activo aún.
Por entonces, Rutherfor, a su vez, separó del torio un “torio X” muy radiactivo, y comprobó también que el torio seguía produciendo más torio X. Hacia aquellas fechas se sabía ya que el más famoso de los elementos radiactivos, el radio, emitía un gas radiactivo, denominado radón. Por tanto, Rutherford y su ayudante, el químico Frederick Soddy, dedujeron que, durante la emisión de sus partículas, los átomos radiactivos de transformaban en otras variedades de átomos radiactivos.
Varios químicos, que investigaron tales transformaciones, lograron obtener un surtido muy variado de nuevas sustancias, a los que dieron nombres tales como radio A, radio B, mesotorio I, mesotorio II y Actinio C. Luego los agruparon todos en tres series, de acuerdo con sus historiales atómicos. Una serie de originó del uranio disociado; otra, del torio, y la tercera, del actinio (si bien más tarde se encontró un predecesor del actinio, llamado “protactinio”).
En total se identificaron unos cuarenta miembros de esas series, y cada uno se distinguió por su peculiar esquema de radiación. Pero los productos finales de las tres series fueron idénticos: en último término, todas las cadenas de sustancias conducían al mismo elemento, estable: PLOMO.
Ahora bien, esas cuarenta sustancias no podían ser, sin excepción, elementos disociados, entre el uranio (92) y el plomo (82) había sólo diez lugares en la tabla periódica, y todos ellos, salvo dos, pertenecían a elementos conocidos.
En realidad, los químicos descubrieron que aunque las sustancias diferían entre sí por su radiactividad, algunas tenían propiedades químicas idénticas. Por ejemplo, ya en 1.907, los químicos americanos Herbert Newby Mc Coy y W.H. Ross descubrieron que el “radio-torio” (uno entre los varios productos de la desintegración del torio) mostraba el mismo comportamiento químico que el torio, y el “radio D”, el mismo que el del plomo; tanto, que era llamado a veces “radio plomo”. De todo lo cual se infirió que tales sustancias eran en realidad variedades del mismo elemento: el radio-torio, una forma de torio; el radio-plomo, un miembro de una familia de plomos, y así sucesivamente.
En 1.913, Soddy esclareció esa idea y le dio más amplitud. Demostró que cuándo un átomo emitía una partícula alfa, se transformaba en un elemento que ocupaba dos lugares más abajo en la lista de elementos, y que cuando emitía una partícula beta, ocupaba, después de su transformación, el lugar inmediatamente superior. Con arreglo a tal norma, el “radio-torio” descendería en la tabla hasta el lugar del torio, y lo mismo ocurría con las sustancias denominadas “uranio X” y “uranio Y”, es decir, que los tres serían variedades del elemento 90. Así mismo, el “radio D”, el “radio B” el “torio B” y el “actinio B” compartirían el lugar del plomo como variedades del elemento 82.
Soddy dio el nombre de “isótopos” (del griego iso y topos, “el mismo lugar”) a todos los miembros de una familia de sustancias que ocupaban el mismo lugar en la tabla periódica. En 1.921 se le concedió el premio Nóbel de Química.
El modelo protón-electrón del núcleo concordó perfectamente con la teoría de Soddy sobre los isótopos. Al retirar una partícula de dicho núcleo, exactamente lo que necesitaba para bajar dos lugares en la tabla periódica. Por otra parte, cuando el núcleo expulsaba un electrón (partícula beta), quedaba sin neutralizar un protón adicional, y ello incrementaba en una unidad la carga positiva del núcleo, lo cual era como agregar una unidad al número atómico, y, por tanto, el elemento pasaba a ocupar la posición inmediatamente superior en la tabla periódica de elementos.
¿Cómo se explica que cuando el torio se descompone en “radio-torio” después de sufrir no una, sino tres desintegraciones, el producto siga siendo torio? Pues bien, en este proceso el átomo de torio pierde una partícula alfa, luego una partícula beta y, más tarde, una segunda partícula beta. Si aceptamos la teoría sobre el bloque constitutivo de los protones, ello significa que el átomo ha perdido cuatro electrones (dos de ellos, contenidos presuntamente en la partícula alfa) y cuatro protones. (La situación actual difiere bastante de este cuadro, aunque, en cierto modo, esto no afecta al resultado.)

El núcleo de torio constaba inicialmente (según se suponía) de 232 protones y 142 electrones. Al haber perdido cuatro protones y otros cuatro electrones, quedaba reducido a 228 protones y 138 electrones. No obstante, conservaba todavía y el número atómico 90, es decir, el mismo antes.
Así, pues, el “radiotorio”, a semejanza del torio, posee 90 electrones planetarios, que giran alrededor del núcleo. Puesto que las propiedades químicas de átomo están sujetas al número de sus electrones planetarios, el torio y el “radiotorio” tienen el mismo comportamiento químico, sea cual fuere su diferencia en peso atómico (232 y 228, respectivamente).
Los isótopos de un elemento se identifican por su peso atómico, o “número másico”. Así, el torio corriente se denomina torio 232, y el “radiotorio”, torio 228. Los isótopos radiactivos del plomo se distinguen también por estas denominaciones:
Plomo 210 – Plomo 214-Plomo 212 y Plomo 211
“radio D” – “radio B” – “Torio B” y “Actinio B”
Se descubrió que la noción de isótopos podía aplicarse indistintamente tanto a los elementos estables como a los radiactivos. Por ejemplo, se comprobó que las tres series radiactivas anteriormente mencionadas terminaban en tres formas distintas de plomo. La serie del uranio acababa en plomo 206; la del torio, en el plomo 208, y la del actinio, en el plomo 207. Cada uno de estos era un isótopo estable y “corriente” del plomo, pero los tres plomos diferían por su peso atómico.
emilio silvera
Jun
2
Conociendo la materia
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en General ~
Clasificado en General ~
 Comments (0)
Comments (0)
Mediante un dispositivo inventado por cierto ayudante de J. J. Thomson, llamado Francis William Aston, se demostró la existencia de los isótopos estables. En 1.919, Thomson, empleando la versión primitiva de aquel artilugio, demostró que el neón estaba constituido por dos variedades de átomos: una cuyo número de masa era 20, y otra, 22.

Representación gráfica de la abundancia isotópica de los tres isótopos naturales del neón.

“Algunos isótopos de los elementos níquel (Ni), cobre (Cu) y zinc (Zn). Como en la mayoría de las tablas de isótopos, los elementos se organizan de abajo hacia arriba según su número atómico creciente, y los isótopos de izquierda a derecha según su masa creciente. Color negro: isótopos estables; azul: isótopos emisores de partículas beta negativo; rojo: isótopos emisores de partículas beta positivo.”
El neón 20 era el isótopo común; el neón 22 lo acompañaba en la proporción de un átomo por cada diez. (Mas tarde se descubrió un tercer isótopo, el neón 21, cuyo porcentaje en el neón atmosférico era de un átomo por cada 400.)
Entonces fue posible, al fin, razonar el peso atómico fraccionario de los elementos. El peso atómico del neón (20, 183) representaba el peso conjunto de los tres isótopos, de pesos diferentes, que integraban, el elemento en su estado natural. Cada átomo individual tenía un número másico entero, pero el promedio de sus masas –el peso atómico- era un número fraccionario.
Aston procedió a mostrar que varios elementos estables comunes eran, en realidad, mezclas de isótopos. Descubrió que el cloro, con un peso atómico fraccionario de 35’453, estaba constituido por el cloro 35 y el cloro 37, en la “proporción” de cuatro a uno. En 1.922 se le otorgó el premio Nóbel de Química.
En el discurso pronunciado al recibir el premio, Aston predijo la posibilidad de aprovechar la energía almacenada en el núcleo atómico, vislumbrando ya las futuras y nefastas bombas y centrales nucleares.
Allá por 1.935, el físico canadiense Arthur Jeffrey Dempster empleó el instrumento de Aston para avanzar sensiblemente en esa dirección. Demostró que, si bien 993 de cada 1.000 átomos de uranio grande uranio 238 (no válido para combustible nuclear), los siete restantes eran uranio 235 (buen combustible nuclear). Y, muy pronto se haría evidente el profundo significado de tal descubrimiento.
Así, después de esta siguiendo huellas falsas durante un siglo, se reivindicó definitivamente la teoría de Prout. Los elementes estaban constituidos por bloques estructurales uniformes; si no átomos de hidrógeno, sí, por lo menos, unidades con masa de hidrógeno.

¿Qué no será capaz de inventar el hombre para descubrir los misterios de la naturaleza?
Ha pasado mucho tiempo desde que Rutherford identificara la primera partícula nuclear (la partícula alfa). El camino ha sido largo y muy duro, con muchos intentos fallidos antes de ir consiguiendo los triunfos (los únicos que suenan), y muchos han sido los nombres que contribuyeron para conseguir llegar al conocimiento del átomo y del núcleo actual: Los electrones circulando alrededor del núcleo, en sus distintos niveles, con un núcleo compuesto de protones y neutrones que, a su vez, son constituidos por los quarks allí confinados por los gluones, las partículas mediadoras de la fuerza nuclear fuente.
Pero ¿Qué habrá más allá de los quarks?
¿Las supercuerdas vibrantes?
¡Algún día se sabrá!
Partículas
El Universo de las partículas es fascinante. Cuando las partículas primarias chocan con átomos y moléculas en el aire, aplastan sus núcleos y producen toda clase de partículas secundaria. En esta radiación secundaria (aún muy energética) la que detectamos cerca de la Tierra, por los globos enviados a la atmósfera superior han registrado la radiación primaria.

Las partículas en los rayos cósmicos
El físico estadounidense Robert Andrews Millikan, que recogió una gran cantidad de información acerca de esta radiación (y que le dio el nombre de rayos cósmicos), decidió que debería haber una clase de radiación electromagnética. Su poder de penetración era tal que, parte del mismo, atravesaba muchos centímetros de plomo. Para Millikan, esto sugería que la radiación se parecía a la de los penetrantes rayos gamma, pero con la longitud de onda más corta.
Otros, sobre todo el físico norteamericano Holly Compton, no estaban de acuerdo en que los rayos cósmicos fuesen partículas. Había un medio para investigar este asunto. Si se trataba de partículas cargadas, deberían ser rechazadas por el campo magnético de la Tierra al aproximarse a nuestro planeta desde el espacio exterior. Compton estudió las mediciones de la radiación cósmica en varias latitudes y descubrió que en realidad se curvaban con el campo magnético: era más débil cerca del ecuador magnético y más fuerte cerca de los polos, donde las líneas de fuerza magnética se hundían más en la Tierra.
Las partículas cósmicas primarias, cuando entran en nuestra atmósfera llevan consigo unas energías fantásticas, muy elevadas. En general, cuanto más pesado es el núcleo, más raro resulta entre las partículas cósmicas. Núcleos tan complejos como los que forman los átomos de hierro se detectaron con rapidez, en 1.968, otros núcleos tan complejos como los del uranio. Los núcleos de uranio constituyen sólo una partícula entre 10 millones. También se incluirán aquí electrones de muy elevada energía.
Ahora bien, la siguiente partícula inédita –después del neutrón- se descubrió en los rayos cósmicos. A decir verdad, cierto físico teórico había predicho ya este descubrimiento.
Paul Adrien Maurice Dirac había aducido, fundándose en un análisis matemático de las propiedades inherentes a las partículas subatómicas, que cada partícula debería tener su “antipartícula”. (Los científicos desean no sólo que la Naturaleza sea simple, sino también simétrica.) Así pues, debería haber un “antielectron”, salvo por su carga, que sería positiva, y no negativa, idéntico al electrón, y un “antiprotón” con carga negativa en vez de positiva.
En 1.930, cuando Dirac expuso su teoría, no llamó demasiado la atención en el mundo de la ciencia. Pero, fiel a la cita, dos años después apareció el “anti-electrón”. Por entonces, el físico americano Carl David Anderson trabajaba con Millikan, en un intento por averiguar si los rayos cósmicos eran radiación electromagnética o partículas. Por aquellas fechas, casi todo el mundo estaba dispuesto a aceptar las pruebas presentadas por Compton, según las cuales, se trataría de partículas cargadas; pero Millikan no acababa de darse por satisfecho con tal solución.
Cámara de experimentación de Curie
Anderson se propuso averiguar si los rayos cósmicos que penetraban en una cámara de ionización se curvaban bajo la acción de un potente campo magnético. Al objeto de frenar dichos rayos lo suficiente como para detectar la curvatura, si la había, puso en la cámara una barrera de plomo de 6’35 mm de espesor. Descubrió que, cuando causaba el plomo, la radiación cósmica trazaba una estela curva a través de la cámara. Y descubrió algo más. A su paso por el plomo, los rayos cósmicos energéticos arrancaban partículas de los átomos de plomo. Una de esas partículas dejó una estela similar a la del electrón. ¡Allí estaba, pues, el “antie-lectrón” de Dirac! Anderson le dio el nombre de “positrón”. Tenemos aquí un ejemplo de radiación secundaria producida por rayos cósmicos. Pero aún había más, pues en 1.963 se descubrió que los positrones figuraban también entre las radiaciones primarias.
Abandonado a sus propios medios, el positrón es tan estable como el electrón (¿y por qué no habría de serlo, si es idéntico al electrón, excepto en su carga eléctrica?). Además, su existencia puede ser indefinida. Ahora bien, en realidad no queda abandonado nunca a sus propios medios, ya que se mueve en un universo repleto de electrones. Apenas inicia su veloz carrera (cuya duración ronda la millonésima de segundo), se encuentra ya con uno.
Así, durante un momento relampagueante quedaran asociados el electrón y el positrón; ambas partículas girarán en torno a un centro de fuerza común. En 1.945, el físico americano Arthur Edwed Ruaark sugirió que se diera el nombre de “positronio” a este sistema de dos partículas, y en 1.951, el físico americano de origen austriaco Martín Deutch consiguió detectarlo guiándose por los rayos gamma característicos del conjunto.
Pero no nos confundamos, aunque se forme un sistema positronio, su existencia durará, como máximo, una diezmillonésima de segundo. El encuentro de electrón-positrón=aniquilamiento mutuo, solo queda energía en forma de radiación gamma. Ocurre pues, tal como había sugerido Einstein: la materia puede convertirse en energía y viceversa. Por cierto que Anderson consiguió detectar muy pronto el fenómeno inverso: desaparición súbita de los rayos gamma, para dar origen a una pareja electrón-positrón. Este fenómeno se llama “producción en pareja.” Anderson compartió con Hess el premio Nóbel de Física de 1.936.
Poco después, los Joliot-Curie detectaron el positrón por otros medios, y, al hacerlo así, realizaron, de paso, un importante descubrimiento. Al bombardear los átomos de aluminio con partículas alfa, descubrieron que con tal sistema no solo se obtenían protones, sino también positrones. Cuando suspendieron el bombardeo, el aluminio siguió emitiendo positrones, emisión que sólo con el tiempo se debilitó.
Aparentemente habían creado, sin proponérselo, una nueva sustancia radiactiva.
He aquí la interpretación de lo ocurrido, según los Joliot-Curie: Cuando un núcleo de aluminio absorbe una partícula alfa, la adición de los dos protones transforma el aluminio (nº atómico 13 en fósforo (nº atómico 15). Puesto que las partículas alfa contienen cuatro nucleones en total, el número masivo se eleva 4 unidades, es decir, del aluminio 27, al fósforo 31. Ahora bien, si al reaccionar se expulsa un protón de ese núcleo, la reducción en una unidad de sus números atómicos y masivos hará surgir otro elemento, o sea, el silicio 30.
Puesto que la partícula alfa es el núcleo del helio, y un protón es el núcleo del hidrógeno, podemos escribir la siguiente ecuación de esta “reacción nuclear”:
aluminio 27+helio4®silicio30+hidrogeno1
Nótese que los números másicos de equilibran:
27+4= a 30+1
Adentrarse en el Universo de las partículas que componen los elementos de la Tabla periódica, y, en definitiva, la materia conocida, es verdaderamente fantástico.
emilio silvera
Jun
2
En verdad, ¿conocemos el Universo?
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en General ~
Clasificado en General ~
 Comments (0)
Comments (0)
Presentado en la XIX Edición del

Es sorprendente ver como “doctos” licenciados dicen que ellos conocen lo que es el Universo, por ejemplo, o lo que pasó en los primeros tres minutos a partir de lo que llamamos Big Bang. En realidad, se están refiriendo a que tienen un modelo del Universo temprano, y que este modelo encaja con los resultados que hasta el momento hemos obtenido mediante experimentos y observaciones.
No siempre este modelo científico es una fiel imagen de la realidad. Los átomos y las moléculas que componen el aire que respiramos, por ejemplo, se pueden describir en términos de un modelo en el que imaginamos cada partícula como si fuera una pequeña esfera perfectamente elástica, con todas las pequeñas esferas rebotando unas contra otras y contra las paredes del recipiente que las contiene.

Esa es la imagen mental, pero es sólo la mitad del modelo; lo que lo hace modelo científico es describir el modo como se mueven las esferas y rebotan unas contra otras mediante un grupo de leyes físicas, escritas en términos de ecuaciones matemáticas. En este caso, éstas son esencialmente las leyes del movimiento descubiertas por Newton hace más de trescientos años. Utilizando estas leyes matemáticas es posible predecir, por ejemplo, que le pasará a la presión ejercida por un gas si se aplasta hasta la mitad de su volumen inicial. Si hacemos el experimento, y, el resultado que se obtiene encaja con la predicción del modelo, este será un buen modelo.


De hecho, todos los modelos científicos tienen aplicabilidad limitada. Ninguno de ellos es “la verdad”. Cuando un científico afirma, por ejemplo, que el núcleo de un átomo está compuesto por partículas denominadas protones y neutrones, lo que en realidad debería decir es que el núcleo de un átomo se comporta, bajo determinadas circunstancias, como si estuviera formado de protones y neutrones. Los mejores científicos toman el “como sí “, pero entienden que sus modelos son, efectivamente, sólo modelos; científicos menores a menudo olvidan esta diferencia crucial.

Los científicos menores, y muchos no-científicos, tienen otra idea equivocada. A menudo piensan que el papel de los científicos hoy en día es llevar a cabo experimentos que probarán la exactitud de sus modelos con una precisión cada vez mayor (hacia posiciones con más y más decimales). ¡En absoluto! La razón para llevar a cabo experimentos que demuestren predicciones previas no comprobadas es descubrir dónde fallan los modelos. Encontrar defectos en sus modelos es la esperanza abrigada por los mejores científicos, porque esos defectos destacarán los lugares donde necesitamos una nueva comprensión, con modelos mejores, para progresar.

El arquetípico ejemplo de esto es la gravedad. La ley de la gravedad de Isaac Newton se consideró la pieza clave de la física durante más de doscientos años, desde la década de 1680 hasta comienzos del siglo XX. Pero había unas pocas, aparentemente insignificantes, cosas que el modelo newtoniano no podía explicar o predecir, referente a la órbita del planeta mercurio y al modo como la luz se curva cuando pasa cerca del Sol. El modelo de gravedad de Albert Einstein, basado en su teoría general explica lo mismo que el modelo de Newton pero también explica esos detalles sutiles de órbitas planetarias y curvatura de la luz. En ese sentido, es un modelo mejor que el anterior, y hace predicciones correctas (en particular, sobre el Universo en general) que el viejo modelo no hace. Pero el modelo de Newton todavía es todo lo que se necesita si se está calculando el vuelo de una sonda espacial desde la Tierra a la Luna.
¿SABEMOS COMO COMENZÓ EL UNIVERSO?

Esta ahora ampliamente aceptado que el Universo donde habitamos surgió a partir de una singularidad con densidad y energía “infinita” que dio lugar a una bola de fuego caliente y densa a la que llamamos Big Bang. En los años veinte y treinta, los astrónomos descubrieron por primera vez que nuestra Galaxia es simplemente una isla de estrellas dispersa entre muchas galaxias similares, y que grupos de estas galaxias se están apartando las unas de las otras a medida que el espacio se expande. Esta idea del Universo en expansión fue realmente predicha por la teoría general de la relatividad de Einstein, terminada en 1916 pero no se tomó en serio hasta que los observadores hicieron sus descubrimientos. Cuando se tomó en serio los matemáticos descubrieron que las ecuaciones describían exactamente el tipo de expansión que observamos, con la implicación de que si las galaxias se van alejando con el tiempo entonces deberían haber estado más juntas en el pasado, y hace mucho tiempo toda la materia en el Universo debería estar acumulada en una densa bola de fuego.

Es la combinación de la teoría y de la observación la que hace que la idea del Big Bang sea tan convincente; en los años sesenta llegó una clara evidencia, con el descubrimiento de un siseo débil de ruido de radio, la radiación cósmica de fondo, que viene de todas las direcciones del espacio y se interpreta como la radiación restante del mismo Big-Bang.
Como la expansión del Universo, la existencia de esta radiación de fondo fue predicha por la teoría antes de ser observada experimentalmente. A finales del siglo XX, la combinación de teoría y observaciones había establecido que el tiempo que ha pasado desde el Big Bang es de unos 14 mil millones de años, y que existen cientos de miles de millones de galaxias como la nuestra dispersas de un extremo al otro del Universo en expansión.
La pregunta a la que se están enfrentando ahora los cosmólogos es ¿Cómo empezó el mismo Big Bang?
El punto de partida para enfrentarnos a esta pregunta es el modelo estándar propio de los cosmólogos, que combina todo lo que han aprendido de las observaciones del universo en expansión con el entendimiento teórico del espacio y el tiempo incorporado a la teoría general de Einstein. El establecimiento de este modelo se ha visto favorecido por el hecho de que cuanto más lejos miramos del Universo, más tiempo atrás vemos. Debido a que la luz viaja a una velocidad finita, cuando miramos galaxias alejadas millones de años luz, la vemos como si estuvieran presentes como eran millones de años antes, cuando salió la luz que llega ahora a nuestros telescopios.
Con telescopios potentes, los astrónomos pueden ver qué aspecto tenía el Universo cuando era más joven (y la radiación cósmica de fondo nos permite “ver-con radiotelescopios- la última etapa de la bola de fuego que fue el Big Bang).

Lo más atrás que hemos visto, el origen de la radiación de fondo corresponde a un tiempo unos pocos cientos de miles de años después del momento del Big Bang, cuando todo el Universo estaba lleno de gas caliente (conocido técnicamente como plasma) a aproximadamente la misma temperatura que la que tiene la superficie del Sol hoy en día, unos pocos miles de grados Celsius. En ese momento, lo que ahora es el Universo visible entero era solo una milésima parte de su tamaño actual y no había objetos individuales en la escala de las estrellas o galaxias en el remolino de material caliente.
Moviéndonos hacia delante en el tiempo, las irregularidades observadas en la radiación de fondo son justamente del tamaño y estructura correctos para explicar el origen de las galaxias y de los grupos de galaxias – son las semillas donde creció la estructura que vemos en el Universo hoy- .

Yendo hacia atrás en el tiempo, la estructura de las irregularidades vista en la radiación de fondo nos habla sobre el tipo de irregularidades que había en el Universo cuando era incluso más joven, justo hasta ese momento atrás en que la teoría general por sí misma se rompe.
Lo primero, y más importante, que hay que decir sobre estas irregularidades en la radiación de fondo es que son diminutas. Son tan pequeñas que al principio era imposible medirlas, y la radiación parecía que viniera perfectamente uniforme desde todas las direcciones en el espacio (isotropía). Si la radiación fuera perfectamente uniforme, todo el modelo estándar del Universo se desbarataría, ya que si no hubiera habido irregularidades en la bola de fuego del Big Bang no habría habido semillas desde donde las galaxias pudieran crecer, y nosotros al no haberse formado las estrellas y fabricado en sus núcleos los materiales complejos de los que estamos hechos, no estaríamos aquí. El hecho de que los científicos estén tratando de resolver estas preguntas han convencido a los astrónomos de que debería haber irregularidades en la radiación de fondo, sólo había que desarrollar instrumentos sensibles para medirlas.

En este sentido podríamos citar el satélite de la NASA COBE que fue capaz de hacer medidas suficientemente sensibles para demostrar que había efectivamente minúsculas ondulaciones en la radiación de fondo. Las dos preguntas clave derivadas del descubrimiento son: ¿por qué la radiación de fondo es casi lisa?, ¿Qué crea las ondulaciones?
La primera pregunta es más profunda de lo que se pueda pensar, porque incluso hoy, 14 mil millones de años después, el Universo es todavía casi liso. Esto no es obvio si contrastamos la luminosidad de una galaxia como nuestra Vía Láctea con la oscuridad del espacio entre las galaxias pero enseguida se hace evidente a mayores escalas. El Universo no es exactamente uniforme, pero incluso en términos de distribución de las galaxias es uniforme en cierto sentido. Si tomamos una fotografía de las galaxias vistas en una pequeña zona del cielo se parecerá mucho a otra fotografía de una zona del mismo tamaño de otra parte del cielo. La radiación de fondo es incluso más uniforme, y parece exactamente la misma desde todos los puntos del espacio dentro de una fracción del 1 por ciento. La profundidad de esta observación descansa en el hecho de que no ha pasado el tiempo suficiente desde el Big Bang para que todas las diferentes partes del Universo interactúen unas con otras y deje de ser liso.
Esta homogeneidad está relacionada con otra característica extraña del Universo denominada sub-planitud. La teoría general de la relatividad nos dice que el espacio (en sentido estricto, el espacio-tiempo) se puede curvar y deformar por la presencia de materia. Localmente, cerca de un objeto como el Sol o la Tierra, esta deformación del espacio-tiempo produce el efecto que llamamos gravedad. Cósmicamente, en el espacio entre las estrellas y las galaxias el efecto combinado de toda la materia en el universo puede producir una curva gradual en el espacio en uno de los dos sentidos.
Aquí tendríamos que continuar hablando de la densidad crítica y de la clase de universo que tendríamos en función de la cantidad de materia que este contenga. Sin embargo, dejaremos ese punto del universo cerrado, abierto o plano, ya que, en uno de los comentarios muy recientes de esta colaboración ya quedaron explicados de manera suficiente.
Estudios cada vez más sofisticados de la radiación de fondo, que culminaron con las observaciones hechas por 0or el satélite Watts principios de éste siglo XXI y del Planck Explorer de ESA un poco más tarde, mostraron que el Universo efectivamente está indistinguiblemente cerca de la plenitud, de modo que su densidad debería estar indistinguiblemente cerca de la Densidad crítica. Esto dio lugar al rompecabezas de donde estaba la masa “desaparecida” (esa que llamamos materia oscura que, nunca se ha visto, ni produce radiación, ni sabemos como se hizo, de qué clase de partículas está conformada – si es que son partículas- y, un sin fin de interrogantes más que, ahora no sabemos contestar).
En realidad, la teoría de la inflación es todavía un trabajo en progreso, y, como en el caso de la GUT, existen diferentes variaciones o modelos sobre el tema. Lo que está claro de todo esto es que, no se puede negar, ni el esfuerzo realizado, ni el éxito alcanzado que, sin ser aún lo que se desea, sí es un paso importante en el conocimiento del Cosmos. Ahora sabemos de él muchísimo más que se sabía en los tiempos de Galileo, y, tanto la técnica, como las matemáticas y la física, han desarrollado la Astronomía y la Astrofísica, hasta unos niveles encomiables, teniendo en cuenta que estamos estudiando una cosa muy, muy grande y cuyos objetos están muy, muy lejos.
Sin embargo, podemos obtener imágenes de galaxias lejanas y de nebulosas que se encuentran a miles o millones de años luz de la Tierra y, mediante técnicas del estudio del espectro, saber, de que materiales están formados.
Es aún muy grande el espacio oscuro que tenemos que alumbrar para conocer en plenitud nuestro vasto Universo, son muchas las zonas que están en la penumbra, y, debemos y tenemos la obligación de continuar profundizando en el saber del Universo que nos acoge.
Yo, que soy un simple aficionado, eso sí, muy enamorado del Universo y apasionado de todas las maravillas que encierra que, sin que lo pueda evitar me fascinan, a veces pienso en que, el Universo entero podía haber surgido de una fluctuación cuántica del vacío, gracias a la combinación de inflación y a una curiosa propiedad de la gravedad.


Esta curiosa propiedad de la gravedad es que guarda energía negativa. Cuando algo (¡cualquier cosa!) cae hacia debajo de un campo gravitacional (como el agua que se precipita desde la montaña) la energía es liberada………Pero eso, será otra historia que ya contaremos. Ahora, para no cerrar en falso el comentario, diré que, no existe ningún límite, en principio, en cuanta masa (en sentido estricto masa-energía, teniendo en mente E=mc2) puede tener una fluctuación cuántica, aunque cuanto más masiva sea una fluctuación, menos probable es que suceda.

El cosmólogo americano Ed Tyron señaló que en principio una fluctuación cuántica que contiene la masa-energía de todo el Universo visible podría salir de la nada, y que aunque la masa-energía de tal fluctuación sería enorme, en las circunstancias correctas la energía gravitacional negativa del campo gravitacional asociado a toda esta masa equilibraría perfectamente esto, de modo que la energía total de la fluctuación sería cero.
La implicación, naturalmente, es que nuestro Universo nació (o brotó) de este modo desde el espacio-tiempo de otro universo, y que no hubo principio y no habrá final. Sólo un mar infinito de universos burbujas interconectados (como el propuesto por Stephen Hawking).
Particularmente a mí, no me desagrada ésta idea y la cambio, con los ojos cerrados, por el Big Crunch, que no nos deja ninguna esperanza de continuidad.
emilio silvera
Jun
1
¿Dónde está la materia perdida?
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en General ~
Clasificado en General ~
 Comments (0)
Comments (0)
Los físicos se vieron durante mucho tiempo turbados por el hecho de que a menudo, la partícula beta emitida en una desintegración del núcleo no alberga energía suficiente para compensar la masa perdida por el núcleo. En realidad, los electrones no eran igualmente deficitarios. Emergían con un amplio espectro de energías, y el máximo (conseguido por muy pocos electrones), era casi correcto, pero todos los demás no llegaban a alcanzarlo en mayor o menor grado. Las partículas alfa emitidas por un nucleido particular poseían iguales energías en cantidades inesperadas. En ese caso, ¿Qué era errónea en la emisión de partículas beta? ¿Qué había sucedido con la energía perdida?

En 1.922, Lise Maitner se hizo por primera vez esta pregunta, y, hacia 1.930, Niels Bohr estaba dispuesto a abandonar el gran principio de conservación de la energía, al menos en lo concerniente a partículas subatómicas. En 1.931, Wolfgang Pauli sugirió una solución para el enigma de la energía desaparecida.
Tal solución era muy simple: junto con la partícula beta del núcleo se desprendía otra, que se llevaba la energía desaparecida. Esa misteriosa segunda partícula tenía propiedades bastante extrañas. No poseía carga ni masa. Lo único que llevaba mientras se movía a la velocidad de la luz era cierta cantidad de energía. A decir verdad, aquello parecía un cuerpo ficticio creado exclusivamente para equilibrar el contraste de energías.
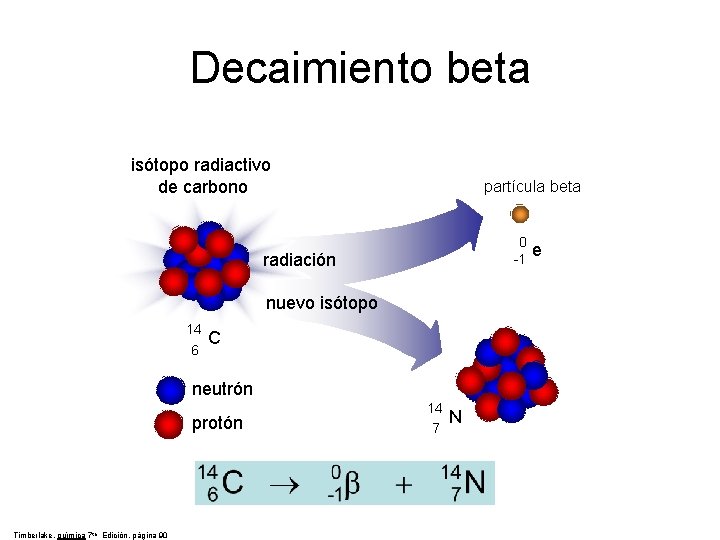
Sin embargo, tan pronto como se propuso la posibilidad de su existencia, los físicos creyeron en ella ciegamente. Y esta certeza se incrementó al descubrirse el neutrón y al saberse que se desintegraba en un protón y se liberaba un electrón, que, como en la decadencia beta, portaba insuficientes cantidades de energía. Enrico Fermi dio a esta partícula putativa el nombre de “neutrino”, palabra italiana que significa “pequeño neutro”.

El neutrón dio a los físicos otra prueba palpable de la existencia del neutrino. Como ya he comentado en otra página de este trabajo, casi todas las partículas describen un movimiento rotatorio. Esta rotación se expresa, más o menos, en múltiples de una mitad según la dirección del giro. Ahora bien, el protón, el neutrón y el electrón tienen rotación de una mitad. Por tanto, si el neutrón con rotación de una mitad origina un protón y un electrón, cada uno con rotación de una mitad, ¿qué sucede con la ley sobre conservación del momento angular? Aquí hay algún error. El protón y el electrón totalizan una mitad con sus rotaciones (si ambas rotaciones siguen la misma dirección) o cero (si sus rotaciones son opuestas); pero sus rotaciones no pueden sumar jamás una mitad. Sin embargo, por otra parte, el neutrino viene a solventar la cuestión.

Supongamos que la rotación del neutrón sea +½. Y admitamos también que la rotación del protón sea +½ y la del electrón -½, para dar un resultado neto de o. Demos ahora al neutrino una rotación de +½, y la balanza quedará equilibrada.
+½(n)=+½(p)-½(e)+½(neutrino)
Pero aun queda algo por equilibrar. Una sola partícula (el neutrón) ha formado dos partículas (el protón y el electrón), y, si incluimos el neutrino, tres partículas. Parece más razonable suponer que el neutrón se convierte en dos partículas y una antipartícula. En otras palabras: lo que realmente necesitamos equilibrar no es un neutrino, sino un antineutrino.
El propio neutrino surgiría de la conversación de un protón en un neutrón. Así, pues, los productos serían un neutrón (partícula), un positrón (antipartícula) y un neutrino (partícula). Esto también equilibra la balanza.
En otras palabras, la existencia de neutrinos y antineutrinos debería salvar no una, sino tres, importantes leyes de conservación: la conservación de la energía, la de conservación del espín y la de conservación de partícula/antipartícula.
Es importante conservar esas leyes puesto que parece estar presentes en toda clase de reacciones nucleares que no impliquen electrones o positrones, y sería muy útil si también se hallasen presentes en reacciones que incluyesen esas partículas.
Las más importantes conversiones protón-neutrón son las relaciones con las reacciones nucleares que se desarrollan en el Sol y en los astros. Por consiguiente, las estrellas emiten radiaciones rápidas de neutrinos, y se calcula que tal vez pierdan a causa de esto el 6 u 8 % de su energía. Pero eso, sería meternos en otra historia y, por mi parte, con la anterior explicación solo trataba de dar una muestra del ingenio del hombre que, como habréis visto, no es poco.

Desde que puedo recordar, he sido un amante de la Física. Me asombran cuestiones como la luz, su naturaleza de un conglomerado de colores, ondas y partículas, su velocidad que nos marca el límite del máximo que podemos correr en nuestro Universo, y en fin, muchos otros misterios que encierra esa cosa tan cotidiana que nos rodea y lo inunda todo haciendo posible que podamos ver por donde vamos, que las plantas vivan y emitan oxígeno o que nos calentemos. Realmente, sin luz, nuestra vida no sería posible.
Entonces, ¿Qué es realmente la luz?
Muchos (casi todos) opinan que es algo inmaterial. Los objetos materiales, grandes o muy pequeños como las galaxias o los electrones, son materia. La luz, sin embargo, se cree que es inmaterial, dos rayos de luz se cruzan sin afectarse el uno al otro.
Ya se ha tratado de convertir luz en materia
Sin embargo, yo que, desde luego, no soy un experto, opino en cambio que la luz, es simplemente una forma de energía lumínica, otra forma en la que se puede presentar la materia. Nosotros mismos, en última instancia, somos luz. Lo que confirma tal aseveración es que E = mc2 es decirla masa y la energía son dos aspectos de la misma cosa, así que la luz adopta la forma de energía pudiendo adoptar otra que sería la materia. ¿Qué aún no hemos visto esa transición? Simplemente hay que esperar avances en la Física para ver algunos.
Está claro que, los estudiosos de la época antigua y medieval estaban por completo a oscuras acerca de la naturaleza de la luz. Especulaban sobre que consistía en partículas emitidas por objetos relucientes o tal vez por el mismo ojo. Establecieron el hecho de que la luz viajaba en línea recta, que se reflejaba en un espejo con un ángulo igual a aquel con el que el rayo choca con el espejo, y que un rayo de luz se inclina (se refracta) cuando pasa del aire al cristal, al agua o a cualquier otra sustancia transparente.
Cuando la luz entra en un cristal, o en alguna sustancia transparente, de una forma oblicua (es decir, en un ángulo respecto de la vertical), siempre se refracta en una dirección que forma un ángulo menor respecto de la vertical. La exacta relación entre el ángulo original y el ángulo reflejado fue elaborada por primera vez en 1.621 por el físico neerlandés Willerbrord Snell. No publicó sus hallazgos y el filósofo francés René Descartes descubrió la ley, independientemente, en 1.637.
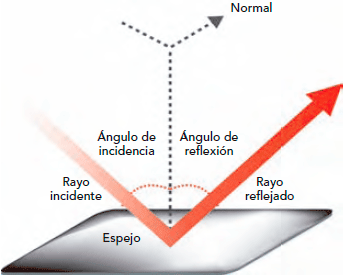
Los primeros experimentos importantes acerca de la naturaleza de la luz fueron llevados a cabo por Isaac Newton en 1.666, al permitir que un rayo de luz entrase en una habitación oscura a través de una grieta e las persianas, cayendo oblicuamente sobre una cara de un prisma de cristal triangular. El rayo se refracta cuando entra en el cristal y se refracta aún más en la misma dirección cuando sale por una segunda cara del prisma. (Las dos refracciones en la misma dirección se originan por que los dos lados del prisma de se encuentran en ángulo en vez de en forma paralela, como sería el caso en una lámina ordinaria de cristal.)
Newton atrapó el rayo emergente sobre una pantalla blanca para ver el efecto de la refracción reforzada. Descubrió que, en vez de formar una mancha de luz blanca, el rayo se extendía en una gama de colores: rojo, anaranjado, amarillo, verde, azul, y violeta, en este orden.
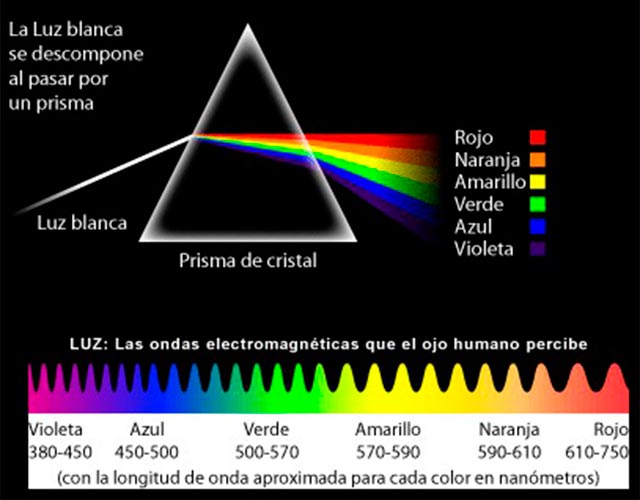
Newton dedujo de ello que la luz blanca corriente era una mezcla de varias luces que excitaban por separado nuestros ojos para producir las diversas sensaciones de colores. La amplia banda de sus componentes se denominó spectrum (palabra latina que significa “espectro” fantasma).
Newton llegó a la conclusión de que la luz se componía de diminutas partículas (“corpúsculos”), que viajaban a enormes velocidades.
Le surgieron y se planteó algunas inquietudes cuestiones. ¿Por qué se refractaban las partículas de luz verde más que los de luz amarilla? ¿Cómo se explicaba que dos rayos de luz se cruzaran sin perturbase mutuamente, es decir, sin que se produjeran colisiones entre partículas?

En 1.678, el físico neerlandés Christian Huyghens (un científico polifacético que había construido el primer reloj de péndulo y realizado importantes trabajos astronómicos) propuso una teoría opuesta: la de que la luz se componía de minúsculas ondas. Y si sus componentes fueran ondas, no sería difícil explicar los diversos difracciones de los diferentes tipos de luz a través de un medio refractante, siempre y cuando se aceptara que la luz se movía más despacio en ese medio refractante que en el aire. La cantidad de refracción variaría con la longitud de las ondas: cuanto más corta fuese tal longitud, tanto mayor sería la refracción. Ello significaba que la luz violeta (la más sensible a este fenómeno) debía de tener una longitud de onda mas corta que la luz azul, ésta, más corta que la verde, y así sucesivamente.
Lo que permitía al ojo distinguir los colores eran esas diferencias entre longitudes de onda. Y, como es natural, si la luz estaba integrada por ondas, dos rayos podrían cruzarse sin dificultad alguna. (Las ondas sonoras y las del agua se cruzan continuamente sin perder sus respectivas identidades.)
Pero la teoría de Huyqhens sobre las ondas tampoco fue muy satisfactoria. No explicaba por qué se movían en línea recta los rayos luminosos; ni por qué proyectaban sobras recortadas; ni aclaraba por qué las ondas luminosas no podían rodear los obstáculos, del mismo modo que pueden hacerlo las ondas sonoras y de agua. Por añadidura, se objetaba que si la luz consistía en ondas, ¿Cómo podía viajar por el vacío, ya que cruzaba el espacio desde el Sol y las Estrellas? ¿Cuál era esa mecánica ondulatoria?
El Principio del saber… ¡Es saber que no sabemos!
Un detalle sobre la velocidad de la Luz:
¡POR QU´ÑE NO PODEMOS VIAJAR A LA VELOCIDAD DE LA LUZ EN EL VACÍO?
“Según un estudio realizado por el físico William Edelstein, de la Universidad Johns Hopkins School of Medicine, con el actual nivel de desarrollo tecnológico es imposible. Si una nave alcanzara una velocidad cercana a la velocidad de la luz, los átomos de hidrógeno que impactarían sobre el fuselaje alcanzarían una energía cercana a los 10,000 sievert por segundo. Una dosis mortal para el ser humano es de 6 sievert por segundo. Estos átomos no solo destruirían la nave, sino toda vida en su interior.”
Así que, tendremos que buscar otros medios para viajar a las estrellas.
emilio silvera
















 Totales: 78.307.107
Totales: 78.307.107 Conectados: 49
Conectados: 49





















