Dic
27
La Imaginación: ¡Mucho más rápida que la Luz!
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Física ~
Clasificado en Física ~
 Comments (8)
Comments (8)
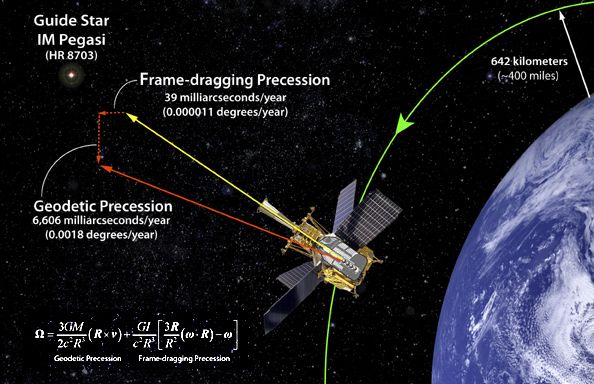
Satélite Gravity Probe B.
Dedicado a medir la curvatura del campo gravitatorio terrestre debido a la teoría de la relatividad de Einstein. La gravedad ha sido medida y comprobada de muchas maneras pero… ¡Gravedad cuántica! ¿qué es eso? La imaginación anda más rápida que los conocimientos. Sin embargo, así hemos ido avanzando en el transcurrir del Tiempo.
La llamada gravedad cuántica trata de fundir en una sola las dos teorías físicas más soberbias con las que contamos, la relatividad general y la mecánica cuántica, que en el estado actual de nuestro conocimiento parecen incompatibles. Su estudio, ahora mismo, es en algunos aspectos análogo a la física de hace cien años, cuando se creía en los átomos, pero se ignaraban los detalles de su estructura.
Desde aquel día en que Kaluza, le escribió a Einstein una carta con su teoría de las cinco dimensiones, en la que unía la Gravedad con el Electromagnetismo, la puerta de las dimensiones más altas quedó abierta y a los teóricos se les regaló una herramienta maravillosa: el hiperespacio; todo es posible. Hasta el matrimonio de la relatividad general y la mecánica cuántica, allí sí es posible encontrar esa soñada teoría de la gravedad cuántica.
Así que las teorías se han embarcado a la búsqueda de un objeto audaz: buscan una teoría que describa la simplicidad primigenia que reinaba en el intenso calor del universo en sus primeros tiempos; una teoría carente de parámetros, donde estén presentes todas las respuestas. Todo debe ser contestado a partir de una ecuación básica.
![59 - Curso de Relatividad General [Ecuaciones de Campo & Constante Cosmológica] - YouTube](https://i.ytimg.com/vi/HI3m80zLo24/maxresdefault.jpg)
Hay que reconocer que nos dice mucho
Claro que saber, lo que el universo es, leyendo una ecuación, por muy ingeniosa que ésta sea y por mucho que la misma pueda abarcar… Parece poco probable. ¿Dónde radica el problema? El problema está en que la única teoría candidata no tiene conexión directa con el mundo de la observación, o no lo tiene todavía si queremos expresarnos con propiedad. La energía necesaria para ello, no la tiene ni el nuevo acelerador de partículas LHC, la máquina más potente del mundo hasta el momento.
La verdad es que la teoría que ahora tenemos, el modelo estándar, concuerda de manera exacta con todos los datos a bajas energías y contesta cosas sin sentido a altas energías. ¡Necesitamos algo más avanzado!

A pesar de su grandeza, se queda corto para que nos pueda decir, lo que necesitamos saber: Si nos habla del Bosón de Higgs, ya estará bien
Se ha dicho que la función de la partícula de Higgs es la de dar masa a las partículas que carecen de ella, disfrazando así la verdadera simetría del mundo. Cuando su autor lanzó la idea a la comunidad científica, resultó además de nueva, muy extraña. El secreto de todo radica en conseguir la simplicidad: el átomo resultó ser complejo, lleno de esas infinitesimales partículas electromagnéticas que bautizamos con el nombre de electrones. Resultó que tenía un núcleo que contenía, a pesar de ser tan pequeño, casi toda la masa del átomo. El núcleo, tan pequeño, estaba compuesto de otros objetos más pequeños aún; los quarks que estaban instalados en nubes de otras partículas llamadas gluones, y ahora queremos continuar profundizando, sospechando que después de los quarks puede haber algo más.

Ahí las partículas toman su masa por el efecto frenado
Nos dicen que existen lugares que llaman los Océanos de Higgs, y, por ellos, circula libremente el dichoso Bosón que, también según nos dicen, proporciona la masa al resto de las partículas. Todo el Universo está permeado por esa especie de sustancia -como el viejo éter- que los griegos llamaban Ilem cósmico y que, a medida que el tiempo avanza, le vamos cambiando el nombre. Pues bien, ahí, en ese “océano” dicen que está el Bosón dador de masas.
Bueno, la idea nueva que surgió es que el espacio entero contiene un campo, el campo de Higgs, que impregna el vacío y es el mismo en todas partes, es decir, que si miramos a las estrellas en una noche clara, estamos mirando el campo de Higgs. Las partículas influidas por este campo toman masa. Esto no es por sí mismo destacable, pues las partículas pueden tomar energía de los campos (gauge) de los que hemos comentado otras veces, tales como: del campo gravitatorio o del electromagnético.

Si llevamos un bloque de plomo a lo alto de la Torre Eiffel, el bloque adquirirá energía potencial a causa de la alteración de su posición en el campo gravitatorio de la Tierra. Como E = mc2, ese aumento de la energía potencial equivale a un aumento de la masa, en este caso la masa del sistema Tierra-bloque de plomo. Aquí hemos de añadirle amablemente un poco de complejidad a la venerable ecuación de Einstein: la masa, m, tiene en realidad dos partes; una es la masa en reposo, m0, la que se mide en el laboratorio cuando la partícula está en reposo. La partícula adquiere la otra parte de la masa en virtud de su movimiento (como los protones en el acelerador de partículas, o los muones, que aumentan varias veces su masa cuando son lanzados a velocidades cercanas a c) en los aceleradores, o en virtud de su energía potencial de campo. Vemos una dinámica similar en los núcleos atómicos. Por ejemplo, si separamos el protón y el neutrón que componen un núcleo de deuterio, la suma de las masas aumenta.

Pero la energía potencial tomada del campo de Higgs difiere en varios aspectos de la acción de los campos familiares. La masa tomada de Higgs es en realidad masa en reposo. De hecho, en la que quizá sea la versión más apasionante de la teoría del campo de Higgs, éste genera toda la masa en reposo. Otra diferencia es que la cantidad de masa que se traga del campo es distinta para las distintas partículas. Los teóricos dicen que las masas de las partículas de nuestro modelo estándar miden con qué intensidad se acoplan éstas al campo de Higgs.
La influencia de Higgs en las masas de los quarks y de los leptones nos recuerda el descubrimiento por Pieter Zeeman, en 1.896, de la división de los niveles de energía de un electrón cuando se aplica un campo magnético al átomo. El campo (que representa metafóricamente el papel de Higgs) rompe la simetría del espacio de la que el electrón disfrutaba.

Hasta ahora no tenemos ni idea de qué reglas controlan los incrementos de masa generados por Higgs (de ahí la expectación creada por el nuevo acelerador de partículas LHC), pero el problema es irritante: ¿por qué sólo esas masas - las masas de los W+, W–, Z0, y el up, down, encanto, extraño, top y bottom, así como los leptones – que no forman ningún patrón obvio?
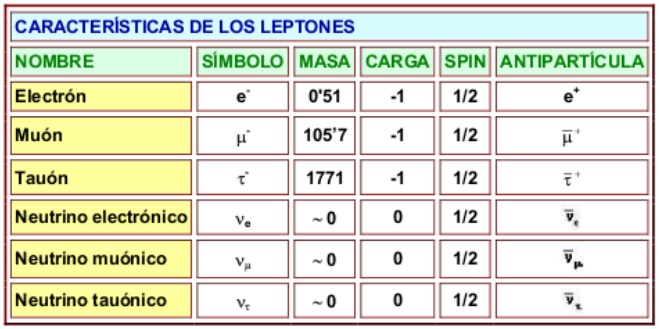
Las masas van desde la del electrón (0’0005 GeV) a la del top, que tiene que ser mayor que 91 GeV. Deberíamos recordar que esta extraña idea (el Higgs) se empleó con mucho éxito para formular la teoría electrodébil (Weinberg-Salam). Allí se propuso el campo de Higgs como una forma de ocultar la unidad de las fuerzas electromagnética y débil. En la unidad hay cuatro partículas mensajeras sin masa – los W+, W–, Z0 y el fotón – que llevan la fuerza electrodébil. Además está el campo de Higgs, y rápidamente, los W y Z absorben la esencia de Higgs y se hacen pesados; el fotón permanece intacto. La fuerza electrodébil se fragmenta en la débil (débil porque los mensajeros son muy gordos), y la electromagnética, cuyas propiedades determina el fotón, carente de masa. La simetría se rompe espontáneamente, dicen las teorías. Prefiero la descripción según la cual el Higgs oculta la simetría con su poder dador de masa.
Tampoco el Higgs es una partícula especial porque sea una excitación del del campo de Higgs que nos permita explorar sus propiedades, porque en las teorías sin Higgs o con Higgs compuesto también hay excitaciones del vacío que nos permiten explorar el campo.” Eso nos dicen en el magnifico Blog de Francis (th)E mule Science’s News.
| Partícula | Símbolo | Masa (en GeV/c2) | Carga eléctrica | Espín | Interacción |
|---|---|---|---|---|---|
| Fotón | 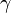 |
0 | 0 | 1 | electromagnética |
| Bosón W | W± | 80,4 | ± 1 | 1 | débil |
| Bosón Z | Z0 | 91,187 | 0 | 1 | débil |
| Gluón | g | 0 | 0 | 1 | fuerte |
Las masas de los W y Z se predijeron con éxito a partir de los parámetros de la teoría electrodébil, y las relajadas sonrisas de los físicos teóricos nos recuerdan que Hooft y Veltman dejaron sentado que la teoría entera está libre de infinitos.
Todos los intentos y los esfuerzos por hallar una pista de cuál era el origen de la masa fallaron. Feynman escribió su famosa pregunta: “¿por qué pesa el muón?”. Ahora, por lo menos, tenemos una respuesta parcial, en absoluto completa. Una voz potente y segura nos dice “¡Higgs!”. Durante más de sesenta años los físicos experimentadores se rompieron la cabeza con el origen de la masa, y ahora el campo de Higgs presenta el problema en un contexto nuevo; no se trata sólo del muón. Proporciona, por lo menos, una fuente común para todas las masas. La nueva pregunta feynmaniana podría ser: ¿Cómo determina el campo de Higgs la secuencia de masas, aparentemente sin patrón, que da a las partículas de la materia?
La variación de la masa con el estado de movimiento, el cambio de masa con la configuración del sistema y el que algunas partículas (el fotón seguramente, y los neutrinos posiblemente) tengan masa en reposo nula son tres hechos que ponen en entredicho que el concepto de masa sea un atributo fundamental de la materia. Habrá que recordar aquel cálculo de la masa que daba infinito y nunca pudimos resolver; los físicos sólo se deshicieron de él “renormalizándolo”, ese truco matemático que emplean cuando no saben hacerlo bien.

¿Sabremos alguna vez cómo adquieren masa las partículas?
Ese es el problema de trasfondo con el que tenemos que encarar el problema de los quarks, los leptones y los vehículos de las fuerzas, que se diferencian por sus masas. Hace que la historia de Higgs se tenga en pie: la masa no es una propiedad intrínseca de las partículas, sino una propiedad adquirida por la interacción de las partículas y su entorno.
La idea de que la masa no es intrínseca como la carga o el espín resulta aún más plausible por la idílica idea de que todos los quarks y fotones tendrían masa cero. En ese caso, obedecerían a una simetría satisfactoria, la quiral, en la que los espines estarían asociados para siempre con su dirección de movimiento. Pero ese idilio queda oculto por el fenómeno de Higgs.

Una cosa más; hemos hablado de los bosones gauge y de su espín de una unidad. Hemos comentado también las partículas fermiónicas de la materia (espín de media unidad). ¿Cuál es el pelaje de Higgs? Es un bosón de espín cero. El espín supone una direccionalidad en el espacio, pero el campo de Higgs da masa a los objetos donde quiera que estén y sin direccionalidad. Al Higgs se le llama a veces “bosón escalar” (sin dirección) por esa razón.
La interacción débil, recordaréis, fue inventada por E. Fermi para describir la desintegración radiactiva de los núcleos, que era básicamente un fenómeno de poca energía, y a medida que la teoría de Fermi se desarrolló, llegó a ser muy precisa a la hora de predecir un enorme número de procesos en el dominio de energía de los 100 MeV. Así que ahora, con las nuevas tecnologías y energías del LHC, las esperanzas son enormes para, por fin, encontrar el bosón de Higgs origen de la masa… y algunas cosas más.
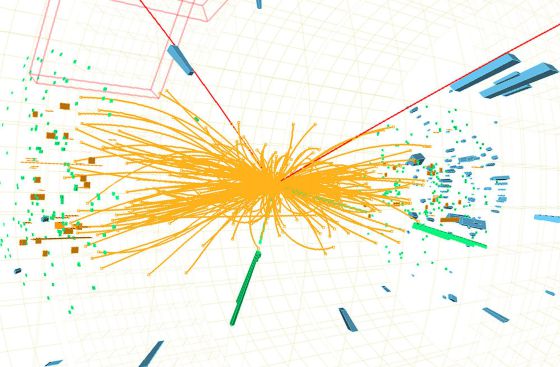
Hay que responder montones de preguntas: ¿cuáles son las propiedades de las partículas de Higgs? y, lo que es más importante, ¿cuál es su masa? (Bueno, parece que, en el último experimento apareció se localizó un bosón con ~125 GeV que, según parece, podría ser el esquivo Hihhs)¿Cómo reconoceremos una si nos la encontramos en una colisión del LHC? ¿Cuántos tipos hay? ¿Genera el Higgs todas las masas o sólo las hace incrementarse? ¿Cómo podemos saber más al respecto? Cómo es su partícula, nos cabe esperar que la veremos ahora después de gastar más de 50.000 millones de euros en los elementos necesarios para ello.
También a los cosmólogos les fascina la idea de Higgs, pues casi se dieron de bruces con la necesidad de tener campos escalares que participasen en el complejo proceso de la expansión del universo, añadiendo pues, un peso más a la carga que ha de soportar el Higgs.
El campo de Higgs, tal como se lo concibe ahora, se puede destruir con una energía grande, o temperaturas altas. Éstas generan fluctuaciones cuánticas que neutralizan el campo de Higgs. Por lo tanto, el cuado que las partículas y la cosmología pintan juntas de un universo primitivo puro y de resplandeciente simetría es demasiado caliente para Higgs. Pero cuando la temperatura cae bajo los 10-5 grados Kelvin o 100 GeV, el Higgs empieza a actuar y hace su generación de masas. Así, por ejemplo, antes del Higgs teníamos unos W, Z y fotones sin masa y la fuerza electrodébil unificada.

No, esto no es el Higgs, es, simplemente, una burbuja multicolor
El universo se expande y se enfría, y entonces viene el Higgs (que “engorda” los W y Z, y por alguna razón ignora el fotón) y de ello resulta que la simetría electrodébil se rompe. Tenemos entonces una interacción débil, transportada por los vehículos de la fuerza W+, W–, Z0, y por otra parte una interacción electromagnética, llevada por los fotones. Es como si para algunas partículas del campo de Higgs fuera una especie de aceite pesado a través del que se moviera con dificultad y que les hiciera parecer que tienen mucha masa. Para otras partículas, el Higgs es como el agua, y para otras, los fotones y quizá los neutrinos, es invisible.
De todas formas, es tanta la ignorancia que tenemos sobre el origen de la masa que nos agarramos como a un clavo ardiendo, en este caso, a la partícula de Higgs, que algunos han llegado a llamar “la partícula divina”. Lo mismo nos pasa con la dichosa “materia oscura” para ocultar lo que no sabemos sobre la expansión del Universo.
¡Ya veremos en qué termina todo esto!


Arriba tenemos nada más y nada menos que: a John Mather, Carlo Rubbia, Martinus Veltman, Gerardus ‘t Hooft at the Lindau Nobel Meetings 2010. Si científicos como ellos no vienen a nuestro rescate, y nos sacan del atolladero en el que estamos inmerso y hasta el cuelo de ignorancia…¡Mal irán las cosas!
Peter Higgs, de la Universidad de Edimburgo, introdujo la idea en la física de partículas. La utilizaron los teóricos Steven Weinberg y Abdus Salam, que trabajaban por separado, para comprender cómo se convertía la unificada y simétrica fuerza electrodébil, transmitida por una feliz familia de cuatro partículas mensajeras de masa nula, en dos fuerzas muy diferentes: la QED con un fotón carente de masa y la interacción débil con sus W+, W– y Z0 de masa grande. Weinberg y Salam se apoyaron en los trabajos previos de Sheldon Glashow, quien, tras los pasos de Julian Schwinger, sabía sólo que había una teoría electrodébil unificada, coherente, pero no unió todos los detalles. Y estaban Jeffrey Goldstone y Martinus Veltman y Gerard’t Hooft. También hay otros a los que habría que mencionar, pero lo que siempre pasa, quedan en el olvido de manera injusta. Además, ¿cuántos teóricos hacen falta para encender una bombilla? La verdad es que, casi siempre, han hecho falta muchos. Recordemos el largo recorrido de los múltiples detalles sueltos y físicos que prepararon el terreno para que llegara Einstein y pudiera, uniéndolo todo, exponer su teoría relativista.

Lo cierto es que (al menos de momento), la materia y energía oscura, las supercuerdas, y el bosón de Higss, sí son la alfonbra que decía Veltman, aquel físico serio y Premio Nobel que, no confesaba con ciertas ruedas de molino. Él, quería hablar de cosas tamgibles y, tampoco le gustaban las partículas virtuales.
Sobre la idea de Peter Higgs, Veltman, uno de sus arquitectos, dice que es una alfombra bajo la que barremos nuestra ignorancia. Glashow es menos amable y lo llamó retrete donde echamos las incoherencias de nuestras teorías actuales. La objeción principal: que no tenemos la menor prueba experimental. Ahora, por fin, la tendremos con el LHC. El modelo estándar es lo bastante fuerte para decirnos que la partícula de Higgs de menor masa (podría haber muchas) debe “pesar” menor de 1 TeV, ¿por qué?; si tiene más de 1 TeV el modelo estándar se vuelve incoherente y tenemos la crisis de la unitariedad.
Después de todo esto, llego a la conclusión de que el campo de Higgs, el modelo estándar y nuestra idea de surgió el universo dependen de que se encuentre el bosón de Higgs. Y ahora, por fin, tenemos un acelerador con la energía necesaria para que nos la muestre, y que con su potencia pueda crear para nosotros una partícula que pese nada menos que 1 TeV.
emilio silvera
Dic
27
La complejidad del átomo y la Química de elementos
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en General ~
Clasificado en General ~
 Comments (1)
Comments (1)

Demócrito de Abdera
Hacia 1.900 se sabía que el átomo no era una partícula simple e indivisible, como predijo Demócrito, pues contenía, al menos, un corpúsculo subatómico: el electrón, cuyo descubridor fue J. J. Thomson, el cual supuso que los electrones se arracimaban como uvas en el cuerpo principal del átomo de carga positiva.

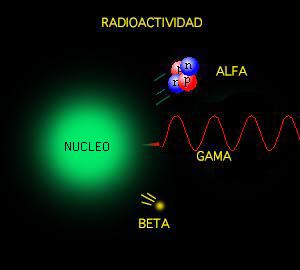
Poco tiempo después resultó evidente que existían otras subpartículas en el interior del átomo. Cuando Becquerel descubrió la radiactividad, identificó como emanaciones constituidas por electrones algunas de las radiaciones emitidas por sustancias radiactivas. Pero también quedaron al descubierto otras emisiones. Los Curie en Francia y Ernest Rutherford en Inglaterra detectaron una emisión bastante menos penetrante que el flujo electrónico. Rutherford la llamó rayos alfa, y denominó rayos beta a la emisión de electrones.


Partículas beta. Las partículas beta son electrones moviéndose a gran velocidad (próxima a la de la luz 0.98. c = 270000 km/s). Las radiaciones Alfa, Beta y Gamma con potencia diferentes
Los electrones volantes constitutivos de esta última radiación son, individualmente, partículas beta. Así mismo, se descubrió que los rayos alfa estaban formados por partículas, que fueron llamadas partículas alfa. Como ya sabemos, alfa y beta son las primeras letras del alfabeto griego y se escriben con los gráficos α y β.
Entretanto, el químico francés Paul Ulrico Villard descubría una tercera forma de emisión radiactiva, a la que dio el nombre de rayos gamma, es decir, la tercera letra del alfabeto griego (γ). Pronto se identificó como una radiación análoga a los rayos X, aunque de menor longitud de onda.
Mediante sus experimentos, Rutherford comprobó que un campo magnético desviaba las partículas alfa con mucho menos fuerza que las partículas beta. Por añadidura, las desviaba en dirección opuesta, lo cual significaba que la partícula alfa tenía una carga positiva, es decir, contraria a la negativa del electrón. La intensidad de tal desviación permitió calcular que la partícula alfa tenía como mínimo una masa dos veces mayor que la del hidrogenión, cuya carga positiva era la más pequeña conocida hasta entonces.
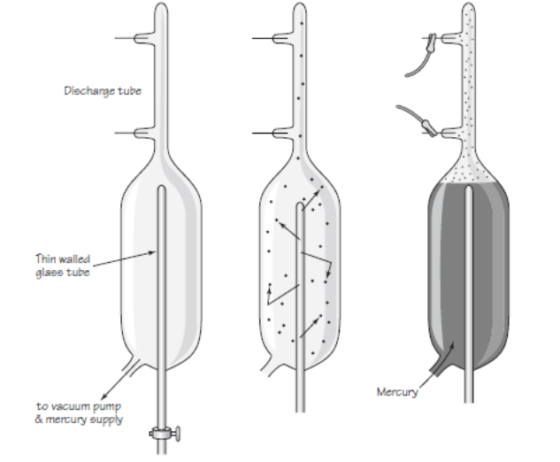
En 1.909, Rutherford pudo aislar las partículas alfa. Puso material radiactivo en un tubo de vidrio fino rodeado por vidrio grueso, e hizo el vacío entre ambas superficies. Las partículas alfa pudieron atravesar la pared fina, pero no la gruesa, lo que dio lugar a que las partículas quedaran aprisionadas entre ambas, y Rutherford recurrió entonces a la descarga eléctrica para excitar las partículas alfa, hasta llevarlas a la incandescencia. Entonces mostraron los rayos espectrales del helio.
Hay pruebas de que las partículas alfa producidas por sustancias radiactivas en el suelo constituyen el origen del helio en los pozos de gas natural.
Si la partícula alfa es helio, su masa debe ser cuatro veces mayor que la del hidrógeno. Ello significa que la carga positiva de éste último equivale a dos unidades, tomando como unidad la carga del hidrogenión.
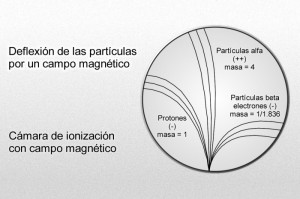
Más tarde, Rutherford identificó otra partícula positiva en el átomo. A decir verdad, había sido detectada y reconocida ya muchos años antes. En 1.886, el físico alemán Eugen Goldstein, empleando un tubo catódico con un cátodo perforado, descubrió una nueva radiación que fluía por los orificios del cátodo en dirección opuesta a la de los rayos catódicos. La denominó rayos canales.
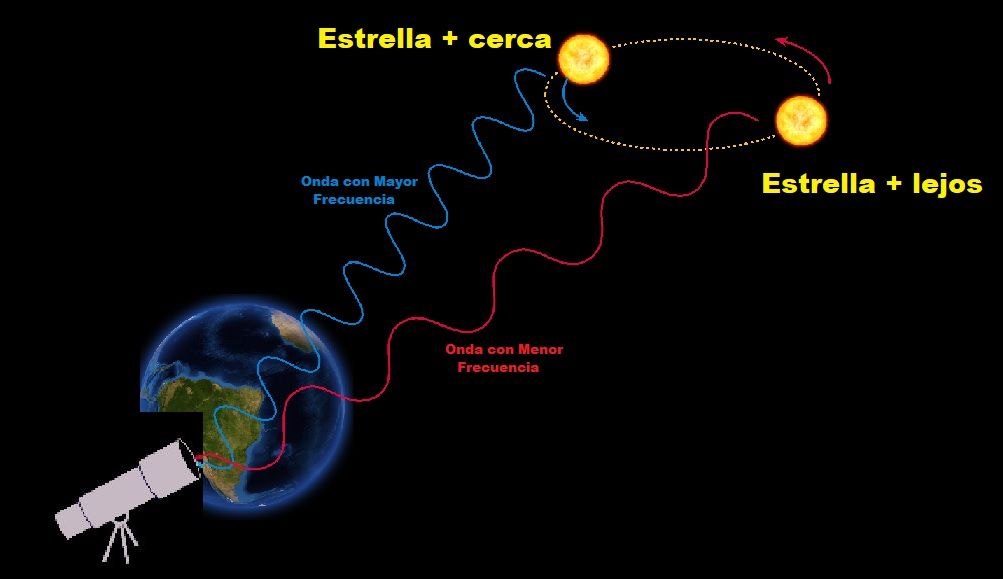
En 1.902, esta radiación sirvió para detectar por vez primera el efecto Doppler-Fizean respecto a las ondas luminosas de origen terrestre. El físico alemán de nombre Johannes Stara orientó un espectroscopio de tal forma que los rayos cayeron sobre éste, revelando la desviación hacia el violeta. Por estos trabajos se le otorgó el premio Nobel de Física en 1.919.

Puesto que los rayos canales se mueven en dirección opuesta a los rayos catódicos de carga negativa, Thomson propuso que se diera a esta radiación el nombre de rayos positivos. Entonces se comprobó que las partículas de rayos positivos podían atravesar fácilmente la materia. De aquí que fuesen considerados, por su volumen, mucho más pequeños que los iones corrientes o átomos. La desviación determinada, en su caso, por un campo magnético, puso de relieve que la más ínfima de estas partículas tenía carga y masa similares a los del hidrogenión, suponiendo que este ión contuviese la misma unidad posible de carga positiva.
Por consiguiente se dedujo que la partícula del rayo positivo era la partícula positiva elemental, o sea, el elemento contrapuesto al electrón; Rutherford lo llamó protón (del neutro griego proton, “lo primero”).
Protón carga positiva y electrón negativa. Ambas de la misma potencia
Desde luego, el protón y el electrón llevan cargas eléctricas iguales, aunque opuestas; ahora bien, la masa del protón, referida al electrón, es 1.836 veces mayor (como señalo en el gráfico anterior).
Parecía probable pues que el átomo estuviese compuesto por protones y electrones, cuyas cargas se equilibraran entre sí. También parecía claro que los protones se hallaban en el interior del átomo y no se desprendían, como ocurría fácilmente con los electrones. Pero entonces se planteó el gran interrogante: ¿cuál era la estructura de esas partículas El núcleo atómico

El núcleo atómico
El propio Rutherford empezó a vislumbrar la respuesta. Entre 1.906 y 1.908 (hace ahora un siglo) realizó constantes experimentos disparando partículas alfa contra una lámina sutil de metal (como oro o platino), para analizar sus átomos. La mayor parte de los proyectiles atravesaron la barrera sin desviarse (como balas a través de las hojas de un árbol), pero no todos. En la placa fotográfica que le sirvió de blanco tras el metal, Rutherford descubrió varios impactos dispersos e insospechados alrededor del punto central. Comprobó que algunas partículas habían rebotado. Era como si en vez de atravesar las hojas, algunos proyectiles hubiesen chocado contra algo más sólido. Rutherford supuso que aquella “balas” habían chocado contra una especie de núcleo denso, que ocupaba sólo una parte mínima del volumen atómico y ese núcleo de intensa densidad desviaban los proyectiles que acertaban a chocar contra él. Ello ocurría en muy raras ocasiones, lo cual demostraba que los núcleos atómicos debían ser realmente ínfimos, porque un proyectil había de encontrar por fuerza muchos millones de átomos al atravesar la lámina

Experimento de Rutherford que descubrió el núcleo atómico
Era lógico suponer, pues, que los protones constituían ese núcleo duro. Rutherford representó los protones atómicos como elementos apiñados alrededor de un minúsculo “núcleo atómico” que servía de centro (después de todo eso, hemos podido saber que el diámetro de ese núcleo equivale a algo más de una cienmilésima del volumen total del átomo).
En 1.908 se concedió a Rutherford el premio Nobel de Química por su extraordinaria labor de investigación sobre la naturaleza de la materia. Él fue el responsable de importantes descubrimientos que permitieron conocer la estructura de los átomos en esa primera avanzadilla.

El átomo de Hidrógeno
Desde entonces se pueden describir con términos más concretos los átomos específicos y sus diversos comportamientos. Por ejemplo, el átomo de hidrógeno posee un solo electrón. Si se elimina, el protón restante se asocia inmediatamente a alguna molécula vecina; y cuando el núcleo desnudo de hidrógeno no encuentra por este medio un electrón que participe, actúa como un protón (es decir, una partícula subatómica), lo cual le permite penetrar en la materia y reaccionar con otros núcleos si conserva la suficiente energía.
El helio, que posee dos electrones, no cede uno con tanta facilidad. Sus dos electrones forman un caparazón hermético, por lo cual el átomo es inerte. No obstante, si se despoja al helio de ambos electrones, se convierte en una partícula alfa, es decir, una partícula subatómica portadora de dos unidades de carga positiva.
:format(jpg)/f.elconfidencial.com%2Foriginal%2Febb%2F97b%2F31e%2Febb97b31e26102fac36eba521365a96d.jpg)
“El litio es un metal altamente valioso y muy demandado por ser un elemento clave en la industria aeroespacial y para producir baterías. Físicamente, es un metal suave, blanco y brillante y varias de sus aleaciones y compuestos se producen a escala industrial, ya que se emplean para producir una variedad de dispositivos eléctricos y por ser clave en la apuesta por energías renovables. A pesar de que se ha popularizado su uso, este metal no abunda y los principales yacimientos se ubican en Chile, China, Argentina y Australia. No obstante, se han descubierto recientemente reservas de litio en Ucrania. En este sentido, se está cuestionando si las motivaciones de la invasión liderada por Putin pueden estar ligadas a estas estimaciones.”
Hay un tercer elemento, el litio, cuyo átomo tiene tres electrones. Si se despoja de uno o dos, se transforma en ión, y si pierde los tres, queda reducida a un núcleo desnudo, con una carga positiva de tres unidades.
Las unidades de carga positiva en el núcleo atómico deben ser numéricamente idénticas a los electrones que contiene por norma, pues el átomo suele ser un cuerpo neutro, y esta igualdad de lo positivo con lo negativo es el equilibrio. De hecho, los números atómicos de sus elementos se basan en sus unidades de carga positiva, no en las de carga negativa, porque resulta fácil hacer variar el número de electrones atómicos dentro de la formación iónica, pero en cambio se encuentran grandes dificultades si se desea alterar el número de sus protones.
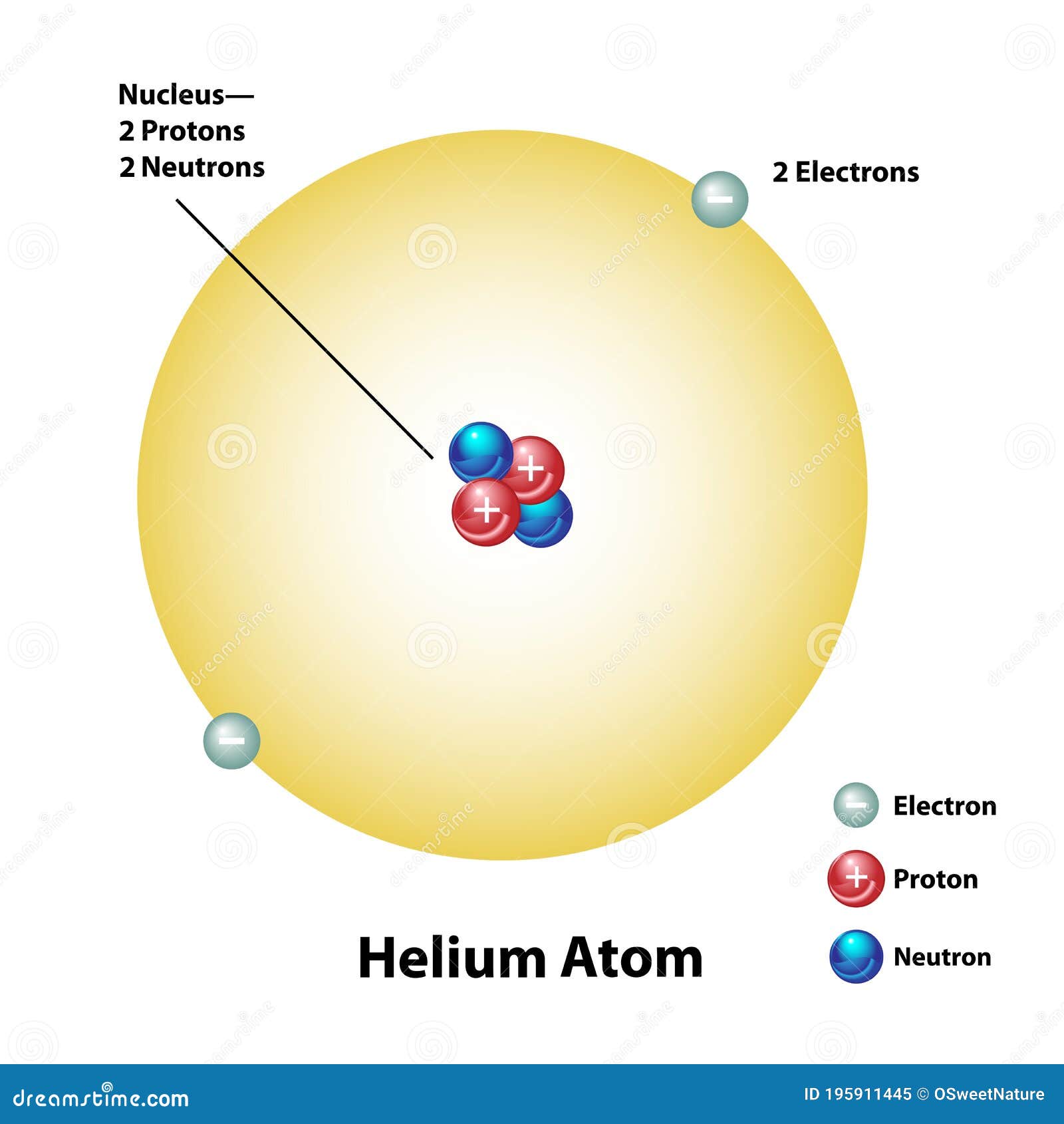
Apenas esbozado este esquema de la construcción atómica, surgieron nuevos enigmas. El número de unidades con carga positiva en un núcleo no equilibró, en ningún caso, el peso nuclear ni la masa, exceptuando el caso del átomo de hidrógeno. Para citar un ejemplo, se averiguó que el núcleo de helio tenía una carga positiva dos veces mayor que la del núcleo de hidrógeno; pero como ya se sabía, su masa era cuatro veces mayor que la de este último. Y la situación empeoró progresivamente a medida que se descendía por la tabla de elementos, e incluso cuando se alcanzó el uranio, se encontró un núcleo con una masa igual a 238 protones, pero una carga que equivalía sólo a 92.
¿Cómo era posible que un núcleo que contenía cuatro protones (según se suponía el núcleo de helio) tuviera sólo dos unidades de carga positiva? Según la más simple y primera conjetura emitida, la presencia en el núcleo de partículas cargadas negativamente y con peso despreciable neutralizaba dos unidades de carga. Como es natural, se pensó también en el electrón. Se podría componer el rompecabezas si se suponía que en núcleo de helio estaba integrado por cuatro protones y dos electrones neutralizadores, lo cual deja libre una carga positiva neta de dos, y así sucesivamente, hasta llegar al uranio, cuyo núcleo tendría, pues, 238 protones y 146 electrones, con 92 unidades libres de carga positiva. El hecho de que los núcleos radiactivos emitieran electrones (según se había comprobado ya, por ejemplo, en el caso de las partículas beta), reforzó esta idea general. Dicha teoría prevaleció durante más de una década, hasta que por caminos indirectos, llegó una respuesta mejor como resultado de otras investigaciones.
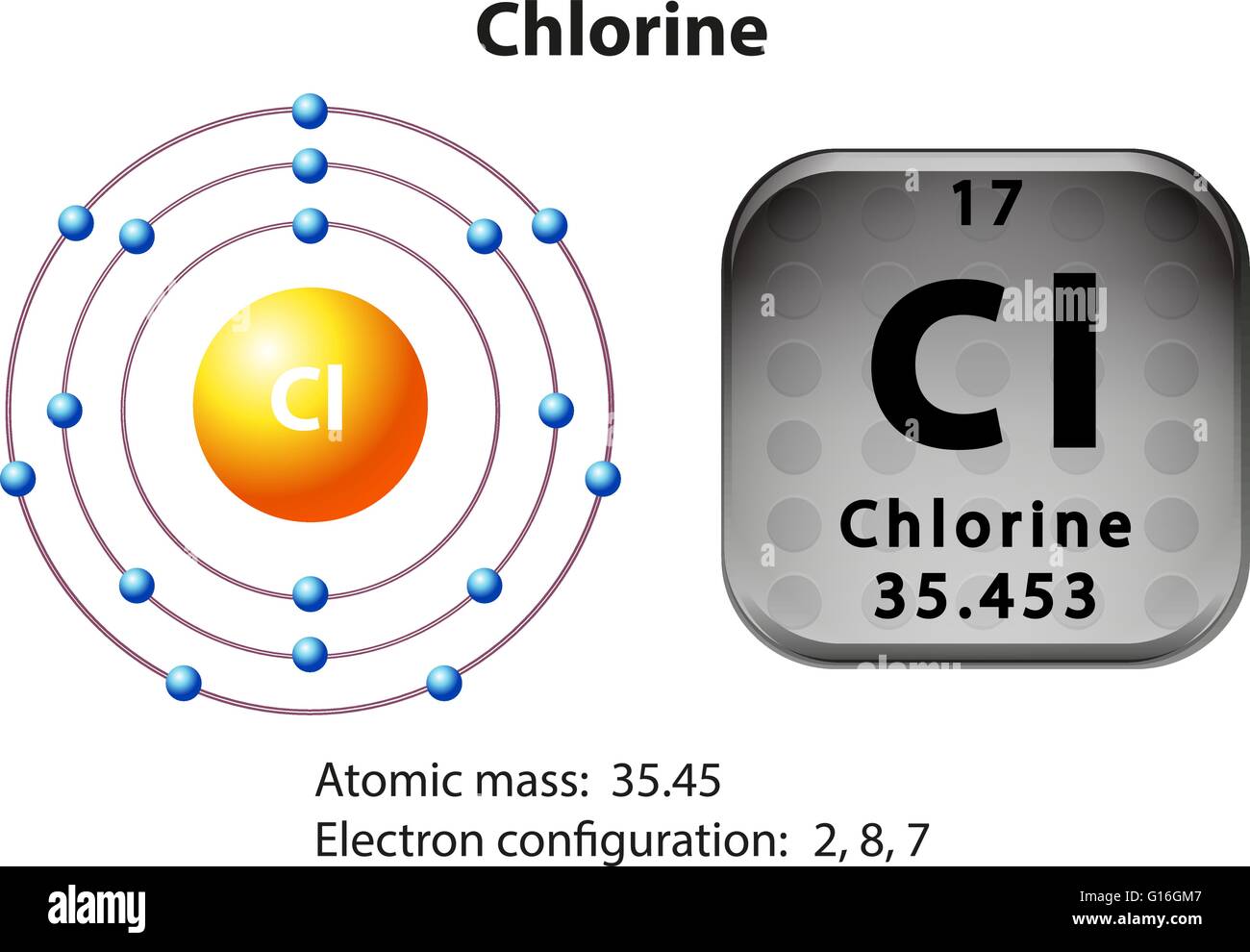
Pero entre tanto se habían presentado algunas objeciones rigurosas contra dicha hipótesis. Por lo pronto, si el núcleo estaba constituido esencialmente de protones, mientras que los ligeros electrones no aportaban prácticamente ninguna contribución a la masa, ¿Cómo se explicaba que las masas relativas de varios núcleos no estuvieran representadas por número enteros? Según los pesos atómicos conocidos, el núcleo del átomo cloro, por ejemplo, tenía una masa 35’5 veces mayor que la del núcleo de hidrógeno. ¿Acaso significaba esto que contenía 35’5 protones? Ningún científico (ni entonces ni ahora) podía aceptar la existencia de medio protón.
Este singular interrogante encontró una respuesta incluso antes de solventar el problema principal, y ello dio lugar a una interesante historia.
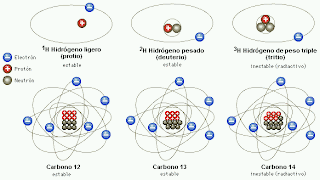
Isótopos; construcción de bloques uniformes
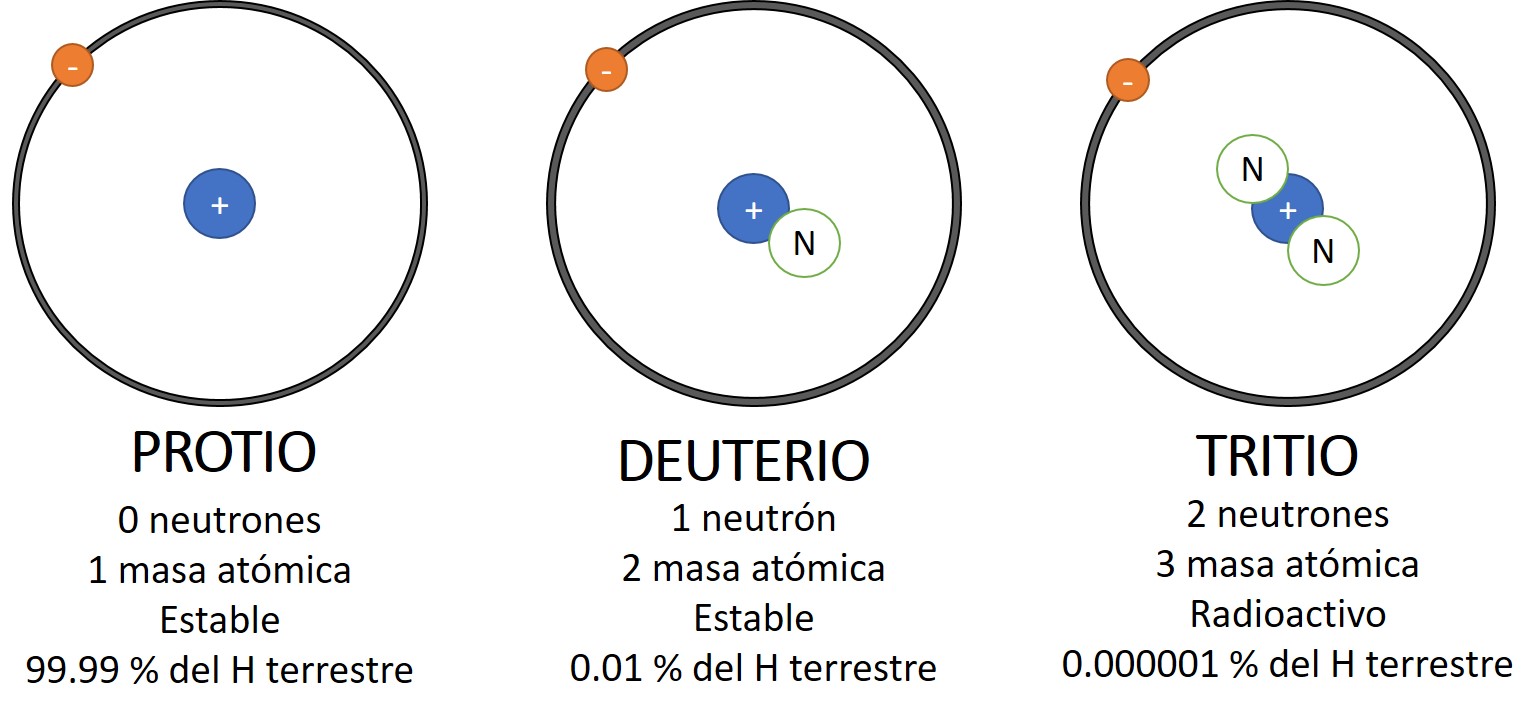
Allá por 1.816, el físico inglés William Prout había insinuado ya que el átomo de hidrógeno debía entrar en la constitución de todos los átomos. Con el tiempo se fueron desvelando los pesos atómicos, y la teoría de Prout quedó arrinconada, pues se comprobó que muchos elementos tenían pesos fraccionarios (para lo cual se tomó el oxígeno, tipificado al 16). El cloro, según dije antes, tiene un peso atómico aproximado de 35’5, o para ser exactos, 35’457. otros ejemplos son el antimonio, con un peso atómico de 121’75, el galio con 137’34, el boro con 10’811 y el cadmio con 112’40.
Hacia principios de siglo se hizo una serie de observaciones desconcertantes, que condujeron al esclarecimiento. El inglés William Crookes (el del tubo Crookes) logró disociar del uranio una sustancia cuya ínfima cantidad resultó ser mucho más radiactiva que el propio uranio. Apoyándose en su experimento, afirmó que el uranio no tenía radiactividad, y que ésta procedía exclusivamente de dicha impureza, que él denominó uranio X. Por otra parte, Henri Becquerel descubrió que el uranio purificado y ligeramente radiactivo adquiría mayor radiactividad con el tiempo, por causas desconocidas. Si se deja reposar durante algún tiempo, se podía extraer de él repetidas veces uranio activo X. Para decirlo de otra manera, por su propia radiactividad, el uranio se convertía en el uranio X, más radiactivo aún.

Un isótopo del torio para explicar el misterio materia-antimateria
Por entonces, Rutherford, a su vez, separó del torio un torio X muy radiactivo, y comprobó también que el torio seguía produciendo más torio X. Hacia aquellas fechas se sabía ya que el más famoso de los elementos radiactivos, el radio, emitía un gas radiactivo, denominado radón. Por tanto, Rutherford y su ayudante, el químico Frederick Soddy, dedujeron que durante la emisión de sus partículas los átomos radiactivos se transformaron en otras variedades de átomos radiactivos.

Varios químicos que investigaron tales transformaciones lograron obtener un surtido muy variado de nuevas sustancias, a las que dieron nombres tales como radio A, radio B, mesotorio I, mesotorio II y actinio C. Luego los agruparon todos en tres series, de acuerdo con sus historiales atómicos. Una serie se originó del uranio disociado; otra del torio, y la tercera del actinio (si bien más tarde se encontró un predecesor del actinio, llamado protactinio).

Crédito: Wikimedia Commons
“El origen etimológico de su nombre proviene del término actinio y el griego protos ( πρῶτος), que significa primero. La conjunción de estos términos significa entonces “padre del actinio” porque, entre otras cosas, el actinio (Ac) surge como un producto de la desintegración radiactiva del protactinio. De cierto modo, el protactinio fue mencionado o predecido por el gran Dimitri Mendeleev ya en 1871, aunque el descubrimiento en sí se le atribuye al químico alemán Otto Hahn y la física austriaca Lise Meitner. Sin embargo, el protactinio no fue aislado hasta 1934, cuando así lo consiguió el químico nuclear Aristid von Grosse, de origen germano.”
En total se identificaron unos cuarenta miembros de esas series, y cada uno se distinguió por su peculiar esquema de radiación. Pero los productos finales de las tres series fueron idénticos: en último término, todas las cadenas de sustancias conducían al mismo elemento, el plomo.

El último elemento de la Tabla Periódica que son todos naturales. Existen otros artificiales “Los Transiránidos“
En química, los Elementos transuránicos (conocidos también como elementos transuránidos) son elementos químicos con número atómico mayor que 92, el número atómico del elemento uranio. El nombre de trans-uránidos significa “más allá del uranio”
Todos los elementos transuránidos son muy radiactivos como el Plutonio
Lista de los elementos transuránicos
|
Ahora bien, esas cuarenta sustancias no podían ser, sin excepción, elementos disociados. Entre el uranio (92) y el plomo (82) había sólo diez lugares en la tabla periódica, y todos ellos, salvo dos, pertenecían a elementos conocidos.
emilio silvera
Dic
27
La Química, la complejidad del átomo II
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en General ~
Clasificado en General ~
 Comments (0)
Comments (0)

Marie Curie y Pierre Curie
El 18 de julio de 1898, en la Escuela de Física y Química de París, Pierre Curie, y su esposa, Marie, presentaron una importante Memoria en la Academia francesa de Ciencias. En ella recogieron especialmente las experiencias de Marie, que en su tesis doctoral estudiaba específicamente los llamados “rayos de Becquerel” (radiaciones de naturaleza desconocida, emitidas espontáneamente por algunos metales como el uranio). Esta investigación dio pie al descubrimiento de un metal desconocido, al que decidieron llamar “polonio”, basándose en el nombre del país de origen de Marie.
Marie Curie. Foto: Wikimedia Commons / Henri Manuel

Marie Curie. Foto: Wikimedia Commons / Henri Manuel
En el campo teórico, los progresos en el estudio de la radiactividad, conseguidos gracias al talento y a los esfuerzos de Henri Becquerel y del matrimonio Curie, hicieron posibles los trabajos posteriores de Rutherford, Geiger, Soddy y Villardy para identificar las radiaciones alfa, beta y gamma producidas espontáneamente en los cuerpos radiactivos; y muy pronto la concepción de los modelos atómicos, las teorías atómicas de De Broglie y Schrodinger y la decisiva fisión del núcleo del uranio por Otto Hahn y Fritz Strassman en el año 1939.

En realidad, los químicos descubrieron que aunque las sustancias diferían entre sí por su radiactividad, algunas tenían propiedades químicas idénticas. Por ejemplo, ya en 1.907 los químicos americanos Herbert Newby McCoy y W. H. Ross descubrieron que el radiotorio (uno entre los varios productos de la desintegración del torio) mostraba el mismo comportamiento químico que el torio, y el radio D, el mismo que el plomo, tanto que a veces era llamado radioplomo. De todo lo cual se infirió que tales sustancias eran en realidad variedades de mismo elemento: el radiotorio, una forma de torio; el radioplomo, un miembro de una familia de plomos; y así sucesivamente.

Torio
En 1.913, Soddy esclareció esta idea y le dio más amplitud. Demostró que cuando un átomo emitía una partícula alfa, se transformaba en un elemento que ocupaba dos lugares más abajo en la lista de elementos, y que cuando emitía una partícula beta, ocupaba, después de su transformación, el lugar inmediatamente superior. Con arreglo a tal norma, el radiotorio descendía en la tabla hasta el lugar del torio, y lo mismo ocurría con las sustancias denominadas uranio X y uranio Y, es decir, que los tres serían variedades del elemento 90. Así mismo, el radio D, el radio B, el torio B y el actinio B compartirían el lugar del plomo como variedades del elemento 82.
Soddy dio el nombre de isótopos (del griego iso y topos, “el mismo lugar”) a todos los miembros de una familia de sustancias que ocupaban el mismo lugar en la tabla periódica. En 1.921 se le concedió el premio Nobel de Química.
El modelo protón-electrón del núcleo concordó perfectamente con la teoría de Soddy sobre los isótopos. Al retirar una partícula alfa de un núcleo, se reducía en dos unidades la carga positiva de dicho núcleo, exactamente lo que necesitaba para bajar dos lugares en la tabla periódica. Por otra parte, cuando el núcleo expulsaba un electrón (partícula beta), quedaba sin neutralizar un protón adicional, y ello incrementaba en una unidad la carga positiva del núcleo, lo cual era como agregar una unidad al número atómico, y por tanto, el elemento pasaba a ocupar la posición inmediatamente superior en la tabla periódica de los elementos. ¡Maravilloso!

¿Cómo se explica que cuando el torio se descompone en radiotorio después de sufrir no una, sino tres desintegraciones, el producto siga siendo torio? Pues bien, en este proceso el átomo de torio pierde una partícula alfa, luego una partícula beta, y más tarde una segunda partícula beta. Si aceptamos la teoría sobre el bloque constitutivo de los protones, ello significa que el átomo ha perdido cuatro electrones (dos de ellos contenidos presuntamente en la partícula alfa) y cuatro protones. (La situación actual difiere bastante de este cuadro, aunque en cierto modo, esto no afecta al resultado).
El núcleo de torio constaba inicialmente (según se suponía) de 232 protones y 142 electrones. Al haber perdido cuatro protones y otros cuatro electrones, quedaba reducido a 228 protones y 138 electrones. No obstante, conservaba todavía el número atómico 90, es decir, el mismo de antes.
Así pues, el radiotorio, a semejanza del torio, posee 90 electrones planetarios, que giran alrededor del núcleo. Puesto que las propiedades químicas de un átomo están sujetas al número de sus electrones planetarios, el torio y el radiotorio tienen el mismo comportamiento químico, sea cual fuere su diferencia en peso atómico (232 y 228 respectivamente).


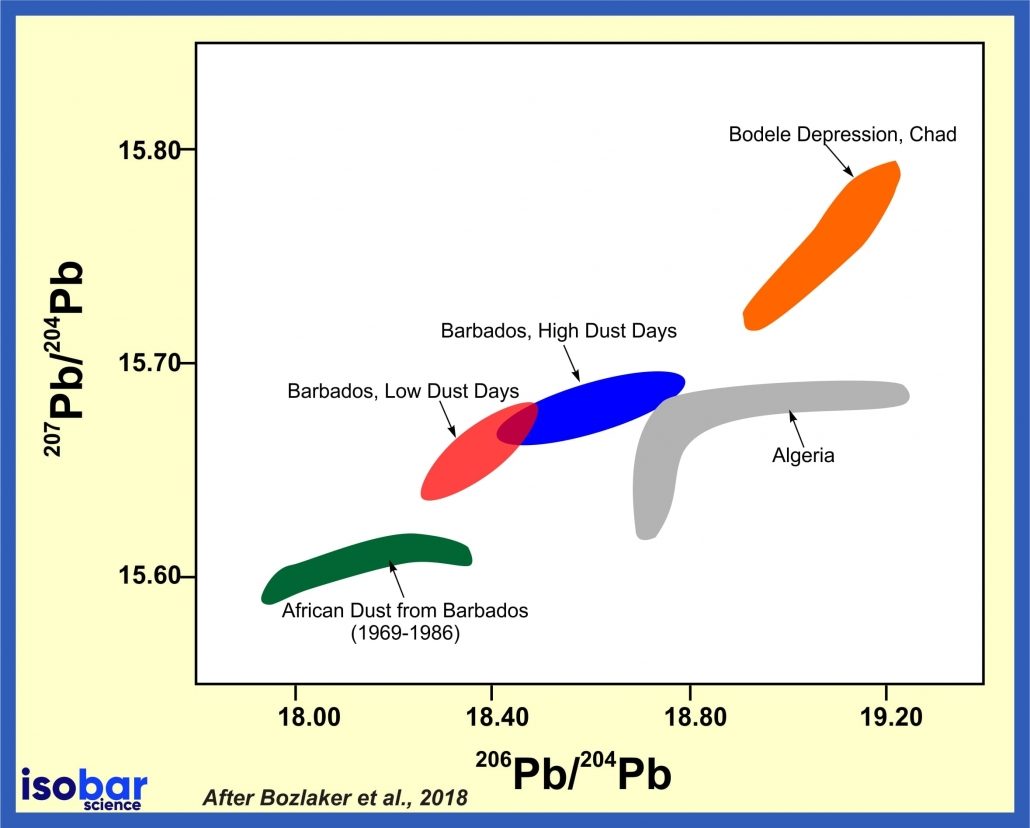
Geoquímica isotópica del plomo
Los isótopos de un elemento se identifican por su peso atómico, o número másico. Así, el torio corriente se denomina torio 232, y el radiotorio, torio 228. Los isótopos radiactivos del plomo se distinguen también por estas denominaciones: plomo 210 (radio D), plomo 214 (radio B), plomo 212 (torio B) y plomo 211 (actinio B).
Se descubrió que la noción de isótopo podía aplicarse indistintamente tanto a los elementos estables como a los radiactivos. Por ejemplo, se comprobó que las tres series radiactivas anteriormente mencionadas terminaban en tres formas distintas de plomo. La serie del uranio acababa en plomo 206, la del torio en plomo 208 y la del actinio en plomo 207. cada uno de estos era un isótopo estable y corriente del plomo, pero los tres plomos diferían por su peso atómico.
Mediante un dispositivo inventado por cierto ayudante de J. J. Thomson, llamado Francis William Aston, se demostró la existencia de los isótopos estables. En 1.919, Thomson, empleando la versión primitiva de aquel artilugio, demostró que el neón estaba constituido por dos variedades de átomos: una cuyo número de masa era 20, y otra con 22. El neón 20 era el isótopo común; el neón 22 lo acompañaba en la proporción de un átomo cada diez. Más tarde se descubrió un tercer isótopo, el neón 21, cuyo porcentaje en el neón atmosférico era de un átomo por cada 400.
Entonces fue posible, al fin, razonar el peso atómico fraccionario de los elementos. El peso atómico del neón (20, 183) representaba el peso conjunto de los tres isótopos, de pesos diferentes, que integraban el elemento en su estado natural. Cada átomo individual tenía un número másico entero, pero el promedio de sus masas (el peso atómico) era un número fraccionario.
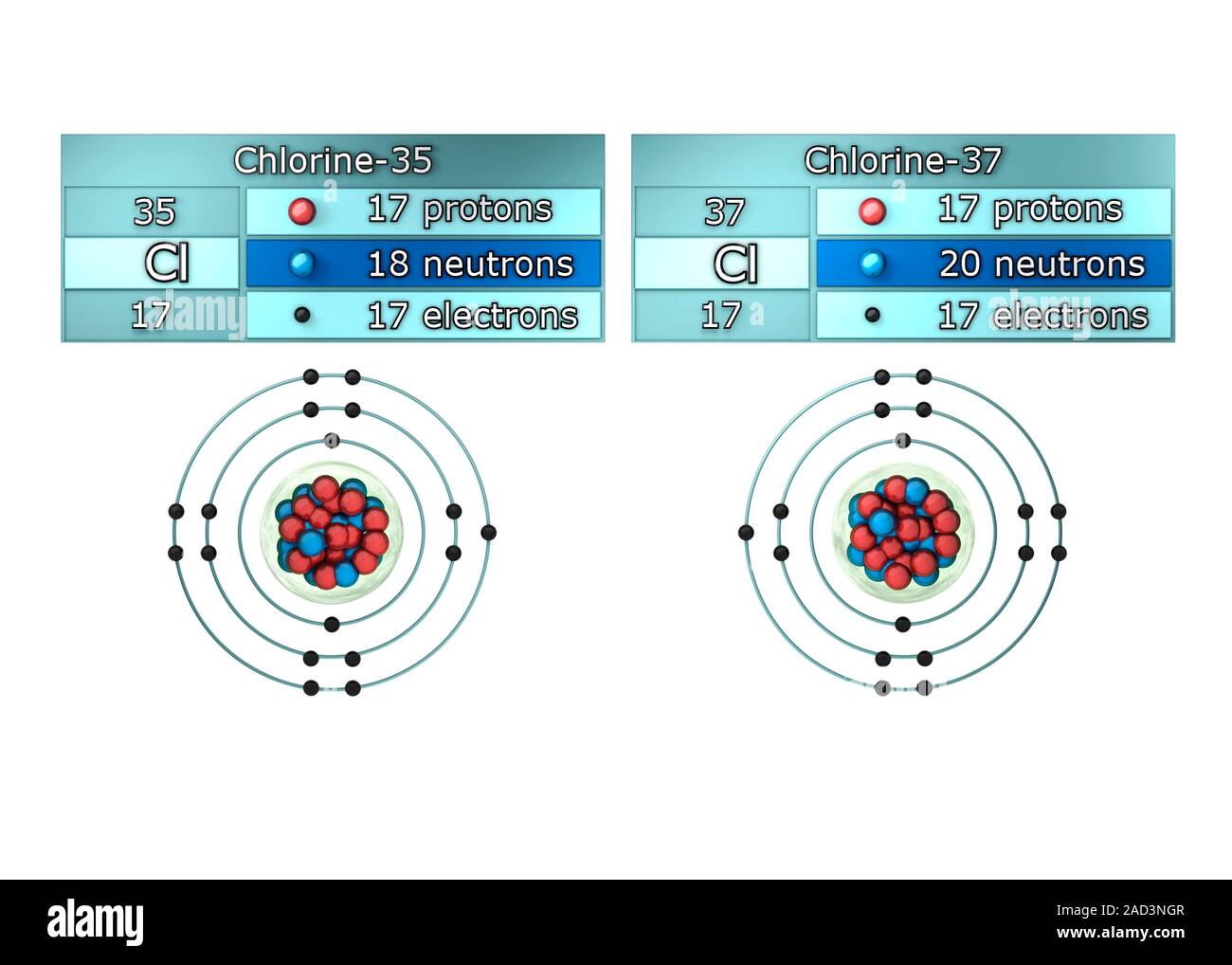
Aston procedió a mostrar que varios elementos estables comunes eran, en realidad, mezclas de isótopos. Descubrió que el cloro, con un peso atómico fraccionario de 35’453, estaba constituido por el cloro 35 y el cloro 37, en la proporción de cuatro a uno. En 1.922 se le otorgó el premio Nobel de Química.
En el discurso pronunciado al recibir el premio, Aston predijo la posibilidad de aprovechar la energía almacenada en el núcleo atómico, vislumbrando ya las futuras y nefastas bombas y centrales nucleares. Allá por 1.935, el físico canadiense Arthur Jeffrey Dempster empleó el instrumento de Aston para avanzar sensiblemente en esa dirección; demostró que 993 de cada 1.000 átomos de uranio eran de uranio 238 (no válido para combustible nuclear). Y muy pronto se haría evidente el profundo significado de tal descubrimiento.
Así, después de estar siguiendo huellas falsas durante un siglo, se reivindicó definitivamente la teoría de Prout. Los elementos estaban constituidos por bloques estructurales uniformes; si no átomos de hidrógeno, sí, por lo menos, unidades con masa de hidrógeno.
¿Qué no será capaz de inventar el hombre para descubrir los misterios de la naturaleza?

Rutherford
Ha pasado mucho tiempo desde que Rutherford identificara la primera partícula nuclear (la partícula alfa). El camino ha sido largo y muy duro, con muchos intentos fallidos antes de ir consiguiendo los triunfos (los únicos que suenan), y muchos han sido los nombres que contribuyen para conseguir llegar al conocimiento del átomo y del núcleo actual; los electrones circulando alrededor del núcleo, en sus diferentes niveles, con un núcleo compuesto de protones y neutrones que, a su vez, son constituidos por los quarks allí confinados por los gluones, las partículas mediadoras de la fuerza nuclear fuerte. Pero, ¿qué habrá más allá de los quarks?, ¿las supercuerdas vibrantes? Algún día se sabrá.
emilio silvera















 Totales: 75.371.843
Totales: 75.371.843 Conectados: 74
Conectados: 74






















