Ago
13
¿El núcleo del átomo? ¡Una maravilla de la Naturaleza!
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en El núclo atómico ~
Clasificado en El núclo atómico ~
 Comments (1)
Comments (1)

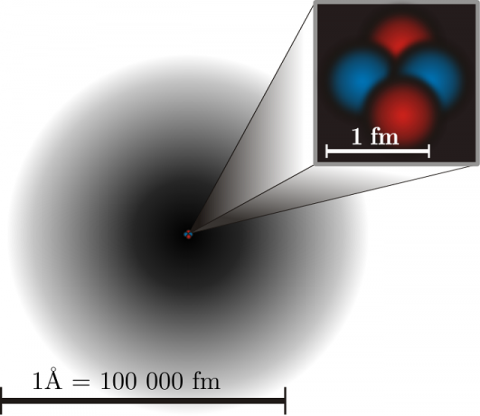
En tan minúscula superficie están presentes y se produce sucesos increíbles
Las partículas del núcleo atómico. Protón y Neutrón (sin olvidar los tripletes de Quarks que los constituyen y los Bosones intermediarios de la fuerza nuclear fuerte (Los Gluones)
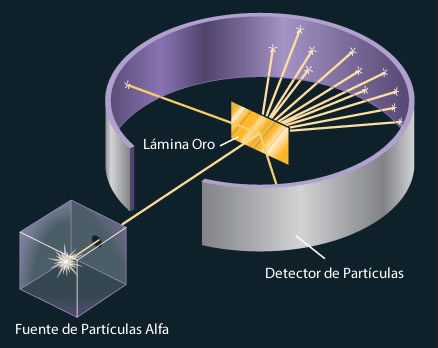
En 1920 (Rutherford) descubrió las partículas positivas que forman los átomos, los protones. El experimento de Rutherford consistió en estudiar la dispersión de partículas alfa (núcleos de helio) al impactar con una lámina de oro. Rutherford realizó este experimento de dispersión de partículas para estudiar la validez del modelo atómico de Thomson, que descubrió el electrón y fue mentor de Ernest Rutherford.


Su carga eléctrica es la misma que la de los electrones, pero positiva, y su masa es semejante a la del átomo de hidrógeno (recuerda que la masa de los electrones es 1836 menor que la del átomo de hidrógeno. LLamó a estas partículas positivas protones.
Por lo tanto en los núcleos de los átomos hay unas partículas positivas que se llaman protones. En el hidrógeno solo hay una partícula ya que recordemos su masa era casi la misma.
Se comprobó que el número de protones es una característica especial de cada elemento químico, ya que todos los átomos del mismo elemento tienen el mismo número de protones. Se llama número atómico (Z) al número de protones que tienen los átomos de un elemento químico. A cada elemento químico le corresponde un número atómico desde 1 hasta 106.
Todavía tenemos que buscar otras partículas en el núcleo atómico. La masa de los protones de un núcleo es mucho menor que la masa del núcleo.
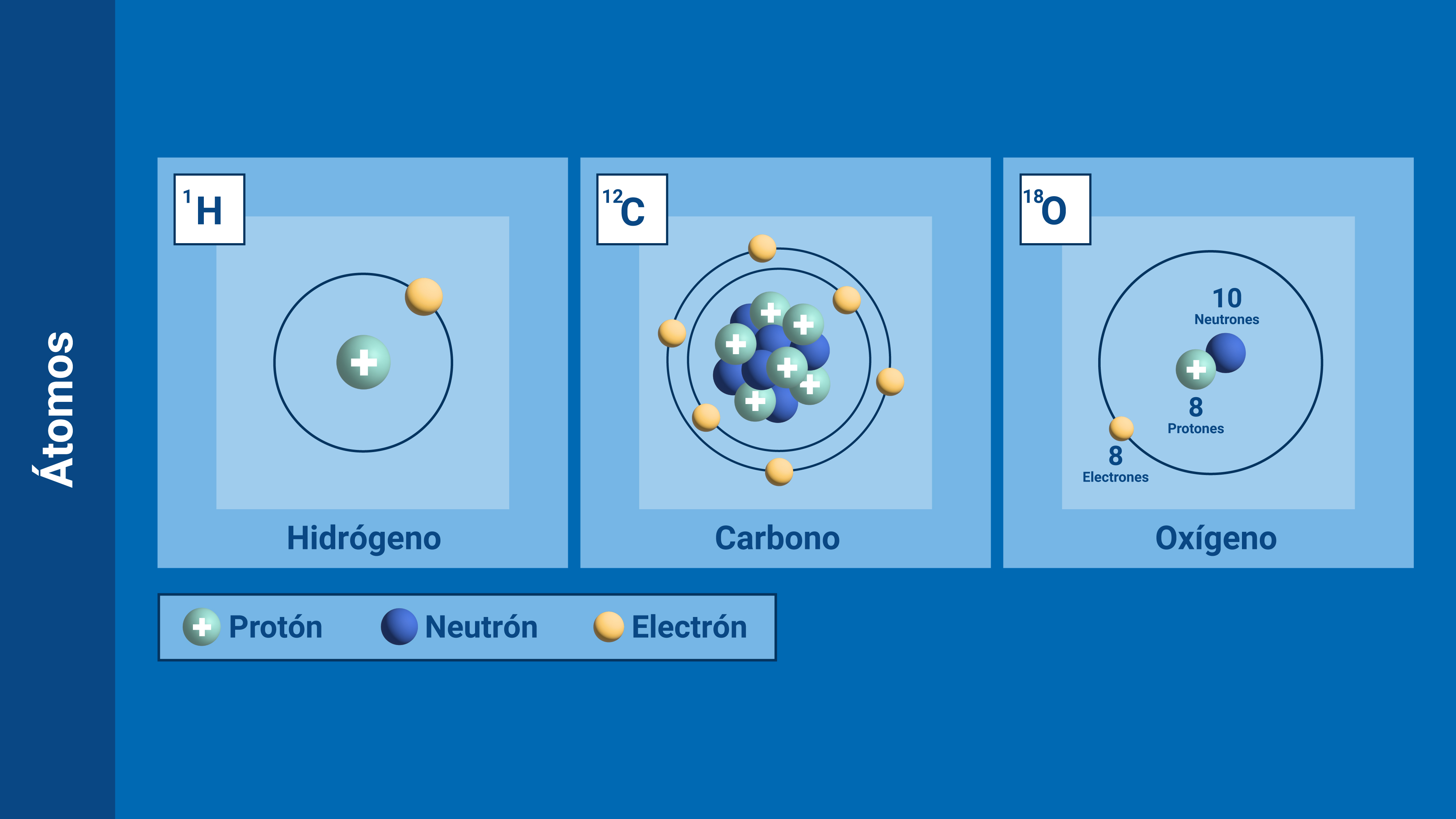
Cada elemento químico se caracteriza por el número de protones de su núcleo, que se denomina número atómico (Z). Así, el hidrógeno ( 1H) tiene un protón, el carbono ( 6C) tiene 6 protones y el oxígeno ( 8O) tiene 8 protones en el núcleo.
El número de neutrones del núcleo puede variar. Casi siempre hay tantos o más neutrones que protones. La masa atómica(A) se obtiene sumando el número de protones y de neutrones de un núcleo determinado.
Un mismo elemento químico puede estar constituído por átomos diferentes, es decir, sus números atómicos son iguales, pero el número de neutrones es distinto. Estos átomos se denominan isótopos del elemento en cuestión. Isótopos significa “mismo lugar“, es decir, que como todos los isótopos de un elemento tienen el mismo número atómico, ocupan el mismo lugar en la Tabla Periódica.
Isótopos del Hidrógeno

Isótopos del Carbono

Desde 1918 estaba probado que existían los isótopos. Estos, eran átomos que tenían propiedades químicas iguales (parecían elementos iguales, por tanto), tenían el mismo número atómico, pero sus masas atómicas eran diferentes. En el núcleo debían existir partículas neutras que contribuyeran a la masa pero no tuvieran carga eléctrica.

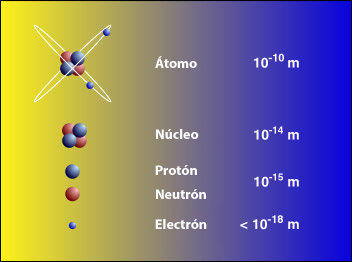
La curiosidad acerca del tamaño y masa del átomo atrajo a cientos de científicos durante un largo período en el que la falta de instrumentos y técnicas apropiadas impidió lograr respuestas satisfactorias. Con posterioridad se diseñaron numerosos experimentos ingeniosos para determinar el tamaño y peso de los diferentes átomos.

El átomo más ligero, el de hidrógeno, tiene un diámetro de aproximadamente 10-10 m (0,0000000001 m) y una masa alrededor de 1,7 x 10-27 kg (la fracción de un kilogramo representada por 17 precedido de 26 ceros y una coma decimal).


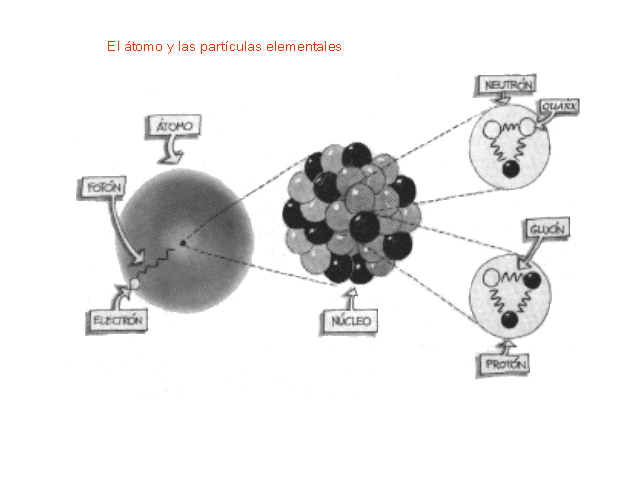
Como no es el objeto del trabajo, no hablaremos hoy de los Quarks, y, simplemente diremos que en la naturaleza no se encuentran quarks aislados. Estos siempre se encuentran en grupos, llamados Hadrones. de dos o tres quarks, conocidos como mesones y bariones respectivamente. Esto es una consecuencia directa del confinamiento de color. En el año 2003 se encontró evidencia experimental de una nueva asociación de cinco quarks, los Pentaquarks, cuya evidencia, en principio controvertida , fue demostrada gracias al Colisionador de Partículas LHC en el pasado Julio de 2.015.

Pero sigamos con lo que nos ocupa y veamos que los Quarks están confinados dentro de los nucleones (protones y neutrones) donde la fuerza fuerte les retiene y nos los deja que se vayan alejando más de lo debido como se explica en el cuadro de arriba.
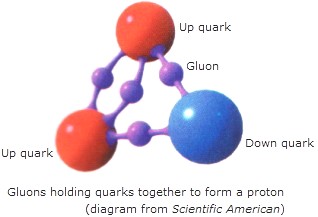
Dentro del nucleo se desatan las fuerzas de la Naturaleza, la que conocemos como fuerza nuclear fuerte, la más potente de las cuatro fuerzas fundamentales que, intermediada por otras partículas de la familia de los Bosones, los Gluones, no dejan que los Quarks se alejen y son retenidos allí, dentro de los nucleones donde tienen su función de conformar los hadrones másicos del núcleo que le aporta la materia al átomo.
Los Gluones, son las partículas intermediarias de la fuerza fuerte, y, de la misma manera, existen otros Bosones encargados de mediar en las otras fuerzas conocidas de la Naturaleza: El Fotón para los fenómenos electromagnéticos, el Gravitón (no encontrado aún) para la fuerza de Gravedad, y, los W+, W–y Zº para la fuerza nuclear débil. Los Gluones se encargan de la fuerza nuclear fuerte para el que el núcleo del átomo sea posible
Lo cierto es que, el núcleo atómico está cargado positivamente y, tal carga, hace la llamada para que, un enjambre de electrones, con cargas negativas, vengan a rodear el núcleo atómico y, de esa manera, queda estabilizado el átomo, ese pequeño objeto que conforma todas las cosas hechas de materia.
Así, los electrones que rodea el núcleo, con su carga eléctrica negativa que complementa la positiva de los protones y hace estable al átomo; una masa de solamente 1/1.836 de la del núcleo más ligero (el del hidrógeno). Y, sin embargo, la importancia del electrón es vital en el universo.
Repasando todo esto, no puedo dejar de recordar aquellas palabras que el físico Freeman Dyson escribió:
“Cuando miramos en el universo e identificamos los muchos accidentes de la física y la astronomía que han colaborado en nuestro beneficio, casi parece que el universo debe haber sabido, en cierto sentido, que nosotros íbamos a venir“.
Fijaros en el hecho cierto de que, si la carga del electrón, o, la masa del protón, variaran aunque sólo fuese una diezmillonésima parte… ¡La vida no podría existir en el Universo! Estamos hechos de átomos y, con tal cambio, éstos nunca se habrían podido conformar.
Emilio Silvera V.















 Totales: 75.608.365
Totales: 75.608.365 Conectados: 51
Conectados: 51
























el 31 de julio del 2017 a las 9:23
En el Gráfico que aparece en primer lugar del trabajo, debajo, nos referimos a las partñiculas del Núclea atómico y, sólo mencionamos al protón y al neutrón, cuando, en realidad el núcleo atómico es muy complejo y, allí reinan otros objetos y la fuerza fuerte. Es decir, los tripletes de Quarks conforman a los Nucleones (protones y neutrones cuando están en el núcleo atómico), 2 quarks up y 1 quark down, conforman un protón y, 2 quarks down y 1 quarks up, un neutrón. Además, dichas Quarks están confinados dentro de los nucleones por medio de la fuerza fuerte, y, las partículas mensajeras son los Bosones que llamamos Gluones que, como si de un fuerte pegamento se tratara, cuando los protones o los neutrones tratan de separarse, los agarra y no los deja que se separen demasiado.
Así, el núcleo se mantiene estable y, como la carga de los protones es positiva, llegan los electrones (de carga negativa) y equilibran el átomo que consigue de esta forma una gran consistencia.
¡La Naturaleza! ¿Quién la puede superar?