Sep
18
Conociendo la materia II
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Física ~
Clasificado en Física ~
 Comments (12)
Comments (12)
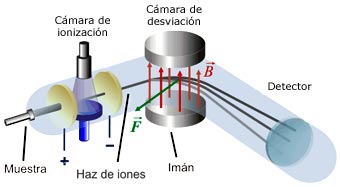

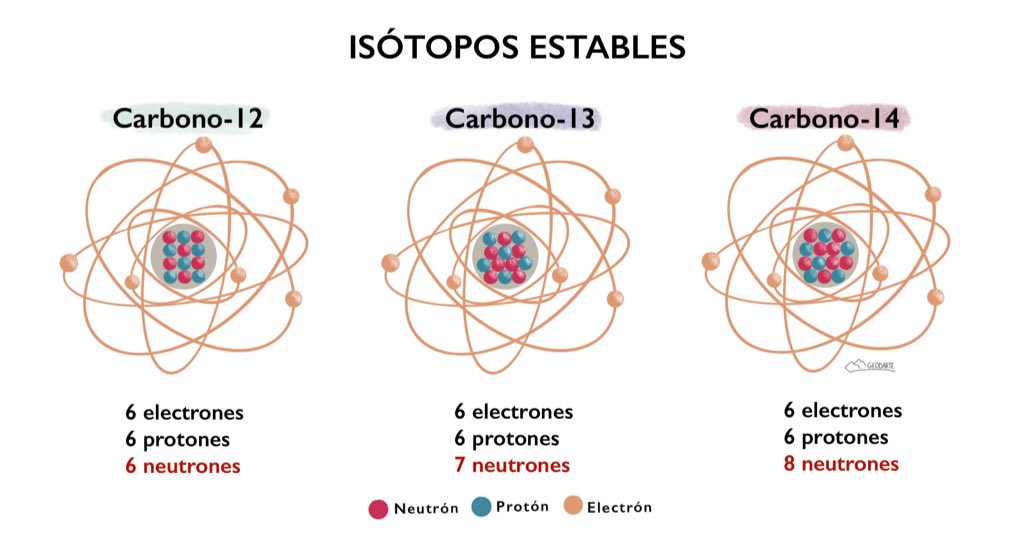
Mediante un dispositivo inventado por cierto ayudante de J J.Thomson, llamado Francis William Aston, se demostró la existencia de los isótopos estables. En 1.919, Thomson, empleando la versión primitiva de aquel artilugio, demostró que el neón estaba constituido por dos variedades de átomos: una cuyo número de masa era 20, y otra, 22. El neón 20 era el isótopo común; el neón 22 lo acompañaba en la proporción de un átomo por cada diez. (Mas tarde se descubrió un tercer isótopo, el neón 21, cuyo porcentaje en el neón atmosférico era de un átomo por cada 400.)
Entonces fue posible, al fin, razonar el peso atómico fraccionario de los elementos. El peso atómico del neón (20, 183) representaba el peso conjunto de los tres isótopos, de pesos diferentes, que integraban, el elemento en su estado natural. Cada átomo individual tenía un número másico entero, pero el promedio de sus masas –el peso atómico- era un número fraccionario.
Aston procedió a mostrar que varios elementos estables comunes eran, en realidad, mezclas de isótopos. Descubrió que el cloro, con un peso atómico fraccionario de 35’453, estaba constituido por el cloro 35 y el cloro 37, en la “proporción” de cuatro a uno. En 1.922 se le otorgó el premio Nóbel de Química.

En el discurso pronunciado al recibir el premio, Aston predijo la posibilidad de aprovechar la energía almacenada en el núcleo atómico, vislumbrando ya las futuras y nefastas bombas y centrales nucleares. Allá por 1.935, el físico canadiense Arthur Jeffrey Dempster empleó el instrumento de Aston para avanzar sensiblemente en esa dirección. Demostró que, si bien 993 de cada 1.000 átomos de uranio grande uranio 238 (no válido para combustible nuclear), los siete restantes eran uranio 235 (buen combustible nuclear). Y, muy pronto se haría evidente el profundo significado de tal descubrimiento.
Así, después de esta siguiendo huellas falsas durante un siglo, se reivindicó definitivamente la teoría de Prout. Los elementes estaban constituidos por bloques estructurales uniformes; si no átomos de hidrógeno, sí, por lo menos, unidades con masa de hidrógeno.
¿Qué no será capaz de inventar el hombre para descubrir los misterios de la naturaleza?

Su experimento nos descubrió la existencia del núcleo atómico
Ha pasado mucho tiempo desde que Rutherford identificara la primera partícula nuclear (la partícula alfa). El camino ha sido largo y muy duro, con muchos intentos fallidos antes de ir consiguiendo los triunfos (los únicos que suenan), y muchos han sido los nombres que contribuyeron para conseguir llegar al conocimiento del átomo y del núcleo actual: Los electrones circulando alrededor del núcleo, en sus distintos niveles, con un núcleo compuesto de protones y neutrones que, a su vez, son constituidos por los quarks allí confinados por los gluones, las partículas mediadoras de la fuerza nuclear fuente.
Pero ¿Qué habrá más allá de los quarks?

¿Las supercuerdas vibrantes?
¡Algún día se sabrá!
Partículas

El Universo de las partículas es fascinante. Cuando las partículas primarias chocan con átomos y moléculas en el aire, aplastan sus núcleos y producen toda clase de partículas secundaria. En esta radiación secundaria (aún muy energética) la que detectamos cerca de la Tierra, por los globos enviados a la atmósfera superior han registrado la radiación primaria.

El físico estadounidense Robert Andrews Millikan, que recogió una gran cantidad de información acerca de esta radiación (y que le dio el nombre de rayos cósmicos), decidió que debería haber una clase de radiación electromagnética. Su poder de penetración era tal que, parte del mismo, atravesaba muchos centímetros de plomo. Para Millikan, esto sugería que la radiación se parecía a la de los penetrantes rayos gamma, pero con la longitud de onda más corta.

Otros, sobre todo el físico norteamericano Holly Compton, no estaban de acuerdo en que los rayos cósmicos fuesen partículas. Había un medio para investigar este asunto. Si se trataba de partículas cargadas, deberían ser rechazadas por el campo magnético de la Tierra al aproximarse a nuestro planeta desde el espacio exterior. Compton estudió las mediciones de la radiación cósmica en varias latitudes y descubrió que en realidad se curvaban con el campo magnético: era más débil cerca del ecuador magnético y más fuerte cerca de los polos, donde las líneas de fuerza magnética se hundían más en la Tierra.
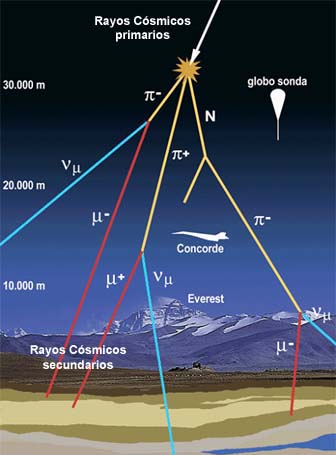
Las partículas cósmicas primarias, cuando entran en nuestra atmósfera llevan consigo unas energías fantásticas, muy elevadas. En general, cuanto más pesado es el núcleo, más raro resulta entre las partículas cósmicas. Núcleos tan complejos como los que forman los átomos de hierro se detectaron con rapidez, en 1.968, otros núcleos tan complejos como los del uranio. Los núcleos de uranio constituyen sólo una partícula entre 10 millones. También se incluirán aquí electrones de muy elevada energía.
Ahora bien, la siguiente partícula inédita –después del neutrón- se descubrió en los rayos cósmicos. A decir verdad, cierto físico teórico había predicho ya este descubrimiento.
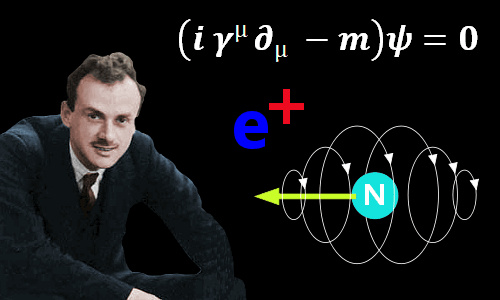
La ecuación de Paul Dirac (1928)
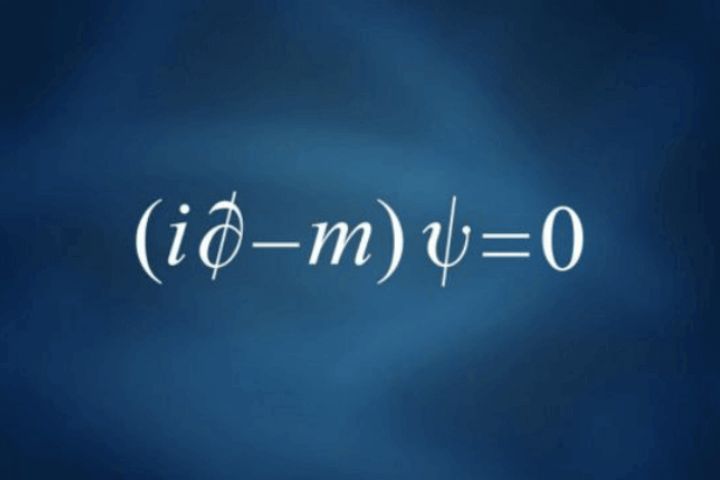
La ecuación de Dirac fue formulada por el físico teórico británico Paul Dirac (1902-1984) en 1928.
La ecuación de Dirac es importante en la física cuántica porque es capaz de describir el comportamiento de partículas de alta energía que se mueven a velocidades cercanas a la velocidad de la luz, como los electrones, que no pueden ser descritas con precisión por las ecuaciones de la física clásica. En esta ecuación, Dirac combina la mecánica cuántica y la teoría especial de la relatividad de Albert Einstein.
La ecuación de Dirac tuvo un impacto significativo en la física cuántica y condujo a muchos descubrimientos importantes, como la predicción de la existencia de antimateria.
Es más general que la ecuación de Schrödinger, que solo se aplica a partículas no relativistas.
Paul Adrien Maurice Dirac había aducido, fundándose en un análisis matemático de las propiedades inherentes a las partículas subatómicas, que cada partícula debería tener su “antipartícula”. (Los científicos desean no sólo que la Naturaleza sea simple, sino también simétrica.) Así pues, debería haber un “antielectron”, salvo por su carga, que sería positiva, y no negativa, idéntico al electrón, y un “antiprotón” con carga negativa en vez de positiva.
En 1.930, cuando Dirac expuso su teoría, no llamó demasiado la atención en el mundo de la ciencia. Pero, fiel a la cita, dos años después apareció el “antielectron”. Por entonces, el físico americano Carl David Anderson trabajaba con Millikan, en un intento por averiguar si los rayos cósmicos eran radiación electromagnética o partículas. Por aquellas fechas, casi todo el mundo estaba dispuesto a aceptar las pruebas presentadas por Compton, según las cuales, se trataría de partículas cargadas; pero Millikan no acababa de darse por satisfecho con tal solución.
Anderson se propuso averiguar si los rayos cósmicos que penetraban en una cámara de ionización se curvaban bajo la acción de un potente campo magnético. Al objeto de frenar dichos rayos lo suficiente como para detectar la curvatura, si la había, puso en la cámara una barrera de plomo de 6’35 mm de espesor. Descubrió que, cuando causaba el plomo, la radiación cósmica trazaba una estela curva a través de la cámara. Y descubrió algo más. A su paso por el plomo, los rayos cósmicos energéticos arrancaban partículas de los átomos de plomo. Una de esas partículas dejó una estela similar a la del electrón. ¡Allí estaba, pues, el “antielectron” de Dirac! Anderson le dio el nombre de “positrón”. Tenemos aquí un ejemplo de radiación secundaria producida por rayos cósmicos. Pero aún había más, pues en 1.963 se descubrió que los positrones figuraban también entre las radiaciones primarias.
Abandonado a sus propios medios, el positrón es tan estable como el electrón (¿y por qué no habría de serlo, si es idéntico al electrón, excepto en su carga eléctrica?). Además, su existencia puede ser indefinida. Ahora bien, en realidad no queda abandonado nunca a sus propios medios, ya que se mueve en un universo repleto de electrones. Apenas inicia su veloz carrera (cuya duración ronda la millonésima de segundo), se encuentra ya con uno.


Pero no nos confundamos, aunque se forme un sistema positronio, su existencia durará, como máximo, una diezmillonésima de segundo. El encuentro de electrón-positrón=aniquilamiento mutuo, solo queda energía en forma de radiación gamma. Ocurre pues, tal como había sugerido Einstein: la materia puede convertirse en energía y viceversa. Por cierto que Anderson consiguió detectar muy pronto el fenómeno inverso: desaparición súbita de los rayos gamma, para dar origen a una pareja electrón-positrón. Este fenómeno se llama “producción en pareja.” Anderson compartió con Hess el premio Nóbel de Física de 1.936.
Poco después, los Joliot-Curie detectaron el positrón por otros medios, y, al hacerlo así, realizaron, de paso, un importante descubrimiento. Al bombardear los átomos de aluminio con partículas alfa, descubrieron que con tal sistema no solo se obtenían protones, sino también positrones. Cuando suspendieron el bombardeo, el aluminio siguió emitiendo positrones, emisión que sólo con el tiempo se debilitó.
Aparentemente habían creado, sin proponérselo, una nueva sustancia radiactiva.


He aquí la interpretación de lo ocurrido, según los Joliot-Curie: Cuando un núcleo de aluminio absorbe una partícula alfa, la adición de los dos protones transforma el aluminio (nº atómico 13 en fósforo (nº atómico 15). Puesto que las partículas alfa contienen cuatro nucleones en total, el número masivo se eleva 4 unidades, es decir, del aluminio 27, al fósforo 31. Ahora bien, si al reaccionar se expulsa un protón de ese núcleo, la reducción en una unidad de sus números atómicos y masivos hará surgir otro elemento, o sea, el silicio 30.

Las partículas alfa (α) tienen carga positiva y están compuestas por dos protones y dos neutrones del núcleo del átomo. Las partículas alfa provienen de la desintegración de los elementos radiactivos más pesados, como el uranio, radio y polonio.
Puesto que la partícula alfa es el núcleo del helio, y un protón es el núcleo del hidrógeno, podemos escribir la siguiente ecuación de esta “reacción nuclear”:
aluminio 27+helio4®silicio30+hidrogeno1
Nótese que los números másicos de equilibran:
27+4= a 30+1
Adentrarse en el Universo de las partículas que componen los elementos de la Tabla periódica, y, en definitiva, la materia conocida, es verdaderamente fantástico.
Emilio Silvera Vázquez
















 Totales: 75.469.840
Totales: 75.469.840 Conectados: 15
Conectados: 15























el 1 de agosto del 2009 a las 21:08
Hola Emilio:
Última noticia: Ahora resulta que los electrones no son indivisibles. Eso les parece por lo menos a unos inveatigadores de USA que encuentran que los electrones pueden dividirse en espiones y holones (creo que no me equivoco en el nombre). De confirmarse sería una noticia importante.
Un abrazo. Ramon Marquès
el 1 de agosto del 2009 a las 21:41
Amigo Emilio, disculpa un par de errores en el comentario que precede. Los investigadores son de Cambridge. Las dos partículas que surgen del electrón se llaman “spinons” y “holons”. Un abrazo. Ramon Marquès
el 2 de agosto del 2009 a las 9:35
Ya tenía noticias del resultado de tal investigación pero, como siempre hago con estas “sorpresas”, la dejo en cuarentena hasta que, los resultados sean confirmados, no una, sino mil veces, ya que, el electrón, amigo Ramón, cuyo nombre tiene su origen en el griego y significa delgado, es un leptón (el más pequeño de los tres hermanos -electrón, muón y ntau- que, por su configuración y características especiales, resulta de muy difícil comprensión que pueda ser una partícula compleja que, a su vez, esté formada por otras pero, cosas más raras hemos podido comprobar…Esperemos a ver.
De todas las maneras, de ser cierto, sería una gran noticia que nos adentraría más en el conocimiento de la Naturaleza de la materia y del Universo mismo.
Un abrazo.
el 10 de septiembre del 2010 a las 18:14
Supongo no se ha confirmado la tal noticia.
el 10 de septiembre del 2010 a las 18:31
Estimado Emilio:
Imposible imprimir sus artículos, ¿verdad? Mi tiempo frente a una computadora suele ser escaso y hay artículos como el caso de esta seguidilla de artículos titulados “conociendo la materia” que querría poder leerlos con el tiempo y la tranquilidad que se merecen. Un cordial saludo.
el 10 de septiembre del 2010 a las 19:56
Amigo Javier:
Puedes pinchar en el apartado “suscripciones web” (final de la pagina a la derecha) en Google y, te apareceran los articulos que podras copias y pegar sin problemas.
Tendre que decirle al Administrador, el amigo Shalafi, que deje libre el poder copiar los articulos que, no pocas personas me han solicitado.
Un abrazo.
el 10 de septiembre del 2010 a las 19:28
Javier, hay formas (y digo bien, formaS) de hacerlo, pero si el autor no lo dice será por algo. Y yo sin el consentimiento oportuno tampoco lo haré 😉
Saludos!
el 10 de septiembre del 2010 a las 19:59
Estimado amigo Zephyros:
Se agradece el detalle, aunque, como digo, es cosa del Administrador que, celoso de mis derechos de autor ha puesto ese inconveniente que, en realidad, no parece que sea impedimento alguno como bien dices.
De todas las maneras, agradecido quedo.
Un abrazo amigo
el 10 de septiembre del 2010 a las 23:26
Gracias Emilio. Aunque los artículos que están disponibles para imprimir ya los he podido leer días pasados. Veré si encuentro alguna de las formas de Zephiros. No se preocupe, que si me doy maña tampoco lo revelaré.
el 13 de septiembre del 2010 a las 10:58
Me alegro Javi, y, de todas las maneras, me da igual que lo reveles o no. En definitiva, se trata de divulgar y que otros se puedan aprovechar de todos estos conocimientos.
Saludos.
el 10 de septiembre del 2010 a las 23:34
Y me di maña nomás. Gracias Zephiros, cuando se quiere se puede.
el 14 de septiembre del 2010 a las 0:42
Y esa es otra lección aprendida 🙂