El Agua es mucho más de lo que se deja ver
Publica El Español en el apartado de Química. El agua es más rara de lo que piensas
IMPRESIÓN NO PERMITIDA - TEXTO SUJETO A DERECHOS DE AUTOR
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en El agua... ¡esa maravilla! ~
Clasificado en El agua... ¡esa maravilla! ~
 Comments (0)
Comments (0)

Está comenzando a comprenderse cómo es la estructura íntima de un líquido con propiedades aberrantes a las que debemos la existencia de la vida en la Tierra.

¿Qué ocurriría si el hielo se hundiera en lugar de flotar? A primera vista, no gran cosa: tal vez habría que remover el gin & tonic de vez en cuando para que se mantuviera frío. Y, sin duda, el Titanic habría llegado a puerto sano y salvo. Pero en realidad, todo sería muy diferente. De hecho, ni siquiera estaríamos aquí: si el agua congelada cayera al fondo del mar, y se formara nuevo hielo que a su vez se hundiera, el resultado final durante las grandes glaciaciones de la Tierra habría sido una gran masa de océanos sólidos que no podría haber sostenido la existencia de vida.

Así pues, debemos nuestra existencia al hecho de que el hielo flote, es decir, que el agua en estado sólido sea menos densa que en fase líquida. Pero lo cierto es que esto es una completa anomalía. Como las demás sustancias, el agua aumenta su densidad al enfriarse, pero por debajo de los 4 oC sucede algo extraño: a medida que comienza a pasar al estado sólido, su volumen aumenta, lo que reduce su densidad.
Y ésta es sólo una de las cualidades aberrantes del agua, la única sustancia que en las condiciones ambientales terrestres puede encontrarse en tres estados distintos: sólido, líquido y gas. Nada en el agua es típico, aunque la costumbre nos tenga habituados.

Fijémonos en su temperatura de ebullición: 100 oC. El agua, H2O, es la combinación de hidrógeno y oxígeno. Este último encabeza un grupo de la tabla periódica formado por otros elementos con los que comparte propiedades, como el azufre (S), el selenio (Se) o el teluro (Te). Si sustituimos el oxígeno por sus compañeros, obtenemos la tendencia que siguen sus puntos de ebullición: de abajo arriba, el H2Te hierve a -4 grados, el H2Se a -42 y el H2S a -62. Así, el agua debería hervir por debajo de los 80 grados bajo cero. Algo similar ocurre con los puntos de congelación: si se comportara como el resto de su grupo, el agua debería helarse a unos 100 bajo cero.
Otra propiedad que nos parece normal, pero en realidad sumamente insólita, es su inmensa tensión superficial, la mayor en un líquido exceptuando el metal mercurio. Vemos esta tensión superficial cuando llenamos un vaso por encima del borde sin que rebose, o en las gotas de rocío sobre las hojas, y algunos insectos acuáticos la aprovechan para deslizarse patinando sobre la superficie de las charcas.

La tensión superficial del agua permite que algunos insectos puedan caminar sobre ella. Markus Gayda (CC)
El agua lubrica y adhiere al mismo tiempo: podemos resbalar sobre un suelo mojado, pero prueben a despegar dos láminas de vidrio unidas por la humedad. El agua es un solvente universal, capaz de disolver sustancias tan dispares como las sales, los alcoholes, los ácidos o los álcalis. Y por si fuera poco, en ciertos casos el agua caliente se congela más deprisa que el agua fría; es el llamado efecto Mpemba, descubierto por un estudiante de secundaria de Tanzania cuyo profesor se carcajeó de él… hasta que un científico lo confirmó.
Así prosigue una lista de anomalías que ha mantenido perplejos a los científicos durante siglos. En 1612, Galileo Galilei escribía: “A mi juicio, el hielo debería ser agua rarificada más que condensada; […] el agua al congelarse aumenta de volumen, y el hielo que se produce es más ligero que el agua sobre la cual nada”. Obvio hoy para nosotros, pero no en su día para los detractores de Galileo, que atribuían la flotación del hielo a su forma.

Las peculiaridades del agua dieron pie a uno de los episodios más rocambolescos de la historia de la ciencia. En 1966, un científico soviético llamado Boris Deryagin presentó en Londres un chocante hallazgo. Un colega suyo, Nikolai Fedyakin, había descubierto que el agua presentaba un comportamiento excepcional cuando se aislaba en finos tubos capilares de cuarzo. El líquido así confinado era mucho más denso y viscoso de lo normal, su punto de ebullición se disparaba hasta los 150o C y el de congelación se desplomaba hasta -40o C, solidificándose en una especie de masa marrón.

La fiebre se desató cuando un equipo de investigadores de EEUU repitió los experimentos y confirmó sus resultados en la revista Science, bautizando la nueva sustancia con un nombre irresistible: poliagua. La hipótesis sugería que el agua confinada formaba un polímero del que se derivaban exóticas propiedades. La revista Time, el diario The New York Times y otros grandes medios cubrieron aquel extrordinario hallazgo que olía a premio Nobel. La revista Popular Sciencepublicaba instrucciones sobre “cómo crear tu propia poliagua”. En la revista Nature, un científico advertía de que la poliagua podía ser “el material más peligroso de la Tierra”, ya que su simple contacto con el agua normal podía polimerizarla y dejar el planeta seco, como un “facsímil de Venus”. El Pentágono se involucró, temeroso de que la URSS llevara ventaja en la explotación de sus posibles aplicaciones militares.

Hasta que a un científico de EEUU llamado Denis Rousseau, pensando que podía tratarse simplemente de agua contaminada, se le ocurrió repetir las pruebas practicadas a la poliagua analizando el sudor de su camiseta después de un partido de balonmano. Y resultó que la presunta poliagua y el sudor eran, a todos los efectos y valga la expresión, como dos gotas de agua. La poliagua no era más que agua normal con impurezas.
Las propiedades del agua están también en el corazón de otro mito, la homeopatía. En 1988 el francés Jacques Benveniste logró publicar en Nature un estudio que decía aportar pruebas sobre la capacidad del agua de recordar las sustancias que había contenido.
El principio homeopático sostiene que, cuanto menos compuesto, más efectividad; sus preparaciones se basan en diluir un ingrediente una y otra vez hasta que desaparece de la solución, quedando sólo agua con una especie de memoria. Otros investigadores trataron sin éxito de reproducir los resultados de Benveniste, que fueron después refutados, y la hipótesis de la memoria del agua ha sido repetidamentedesacreditada. Sin embargo, en este caso el mito no ha desaparecido; a diferencia de la poliagua, la homeopatía sostiene una poderosa industria.
Hoy la ciencia ha descubierto que las propiedades anómalas del agua tienen mucho que ver con una estructura muy cambiante y dinámica, todo lo contrario de un material con memoria. El secreto está en la química del H2O. El oxígeno es uno de los elementos más electronegativos de la tabla periódica; es decir, que atrae con más fuerza los electrones. En el átomo de oxígeno predomina la carga negativa, mientras que en los dos hidrógenos se acumula la carga positiva. Ambas se compensan de modo que la carga neta es cero, pero esta estructura convierte a la molécula de agua en lo que se llama un dipolo: polo negativo y polo positivo. Ninguna de las moléculas parecidas a ella tiene un carácter dipolar tan marcado. Y esta es la razón de la enorme tensión superficial, ya que las moléculas de agua tienden a pegarse fuertemente unas a otras a través de estos polos, que se unen por un tipo de enlace llamado puente de hidrógeno.


Hasta hace poco más de una década, primaba la idea de que el agua líquida tenía una estructura homogénea. En el hielo, el agua está ordenada formando pirámides triangulares, o tetraedros, con una molécula en su centro y otras cuatro en los vértices, unidas a la central por puentes de hidrógeno. Se pensaba que al pasar a líquido se mantenía la misma estructura básica, pero los huecos del tetraedro se rellenaban con más moléculas, y de ahí su mayor densidad. Hasta que en 2004 los suecos Anders Nilsson y Lars Petterson lo pusieron todo patas arriba.
Mientras estudiaban por rayos X la estructura de otra molécula en disolución, Nilsson, de la Universidad de Stanford, y Pettersson, de la de Estocolmo, descubrieron que lo más interesante estaba en el agua. En contra de lo que decían los libros de texto, su potente fuente de rayos X les revelaba que sólo una pequeña parte de las moléculas de agua líquida formaban tetraedros. La inmensa mayoría estaban en una configuración más desordenada y compacta con sólo dos puentes de hidrógeno, y no cuatro. “Proponíamos que la estructura dominante estaba seriamente distorsionada”, resume Nilsson a EL ESPAÑOL.

Resultó que esta estructura en dos fases distintas, tetraedros y masa desordenada, lo explicaba todo. Por ejemplo, cuando el hielo se derrite, el agua comienza a pasar a la estructura compacta, lo que eleva su densidad. Pero por encima de 4 oC, al aumentar las moléculas desordenadas, la vibración de éstas las aparta unas de otras, lo que resulta en un agua más ligera a mayor temperatura.
Curiosamente, el modelo de Nilsson y Pettersson se parecía mucho a una hipótesis propuesta varios años antes para el agua superenfriada. Se llama así al agua por debajo del punto de congelación que se mantiene en estado líquido al impedirse la formación de hielo; en la naturaleza existe, por ejemplo, en las nubes a gran altura. En 1992, un equipo de la Universidad de Boston propuso que el agua superenfriada se compone de dos fases, una de baja y otra de alta densidad. Estas dos fases se han relacionado con una estructura en tetraedros, la primera, y otra más desordenada, la segunda.
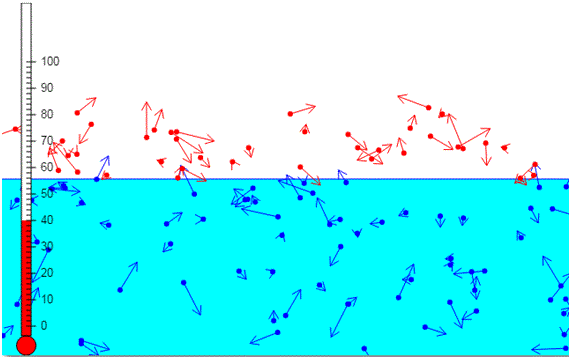
Si se calienta un líquido se incrementa la energía cinética media de sus moléculas. Las moléculas cuya energía cinética es más elevada y que están cerca de la superficie del líquido escaparán y darán lugar a la fase de vapor
Así, las dos líneas de investigación, la del agua que vemos a diario y la de la superenfriada, han confluido en un mismo modelo: una mezcla de dos estructuras que conviven y que se dan en mayor o menor grado dependiendo de la temperatura. En su última revisión, publicada en Nature Communications en diciembre de 2015, Nilsson y Pettersson cuentan que el agua es heterogénea, una mezcla cambiante de fases de alta y baja densidad. “La estructura distorsionada que proponíamos se relaciona con el líquido de alta densidad que es dominante a temperatura ambiente”, dice Nilsson. Y todo encaja, añade: “Las fluctuaciones entre los líquidos de alta y baja densidad explican las propiedades anómalas del agua”.

Un iceberg es una enorme masa de agua en forma de hielo que flota. Dan Rea, USAF (PD)
Esta idea del agua como la mezcla de aceite y vinagre en el aliño, pero ambos compuestos por una misma sustancia, aún se está abriendo paso en la comunidad científica. Por el momento, no todos están dispuestos a dejarse convencer. Pero mientras los expertos debaten, también comienzan a reflexionar sobre un intrigante enigma.

Cuando Nilsson y Pettersson dibujan un gráfico con presiones en un eje y temperaturas en el otro, resulta que las propiedades anómalas del agua se dan exclusivamente en una región central con forma de embudo. Por encima y por debajo de esta zona desaparece la doble personalidad del agua, que adopta sólo un estado y se comporta como un líquido cualquiera. Pero se da la circunstancia de que la región del embudo corresponde a las condiciones de la Tierra. “Al parecer, el agua se vuelve anómala a las temperaturas a las que suele existir la vida”, apunta Nilsson. “¿Es pura coincidencia o es algo significativo?”, se pregunta.