Jun
7
¿Alquimia estelar? ¿Proplasma vivo? ¿De dónde venimos?
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Alquimia estelar ~
Clasificado en Alquimia estelar ~
 Comments (0)
Comments (0)

Estructuración del protoplasma-vivo como el plasma de la Vida con unas notables facultades para hacer cosas nuevas a partir de otras viejas. ¡Cuánto se habría excitado y cuán complacido habría estado Pasteur si hubiera conocido el famoso experimentio de Miller! Pese a ser el mismo un teísta, Pateur estaba convencido de que Dios creó la vida sobre la Tierra combinando precisamente fuerzas químicas y azar. Reconocía también, como sabemos, que los compuestos or´ganicos de los seres vivos son ópticamente activos, es decir, poseen una asimetría interna capaz de desviar planos de luz polarizada. Estaba impresionado, con el hecho de que, fuera de los tejidos vivos, los compuestos asimétricos se encuentran siempre en forma racémica: una mezcla de moléculas orientadas a la derecha, y otras, orientadas a la izquierda. Solamente en estos tejidos vivos, los compuestos orgánicos tienen una lateralidad bien definida.
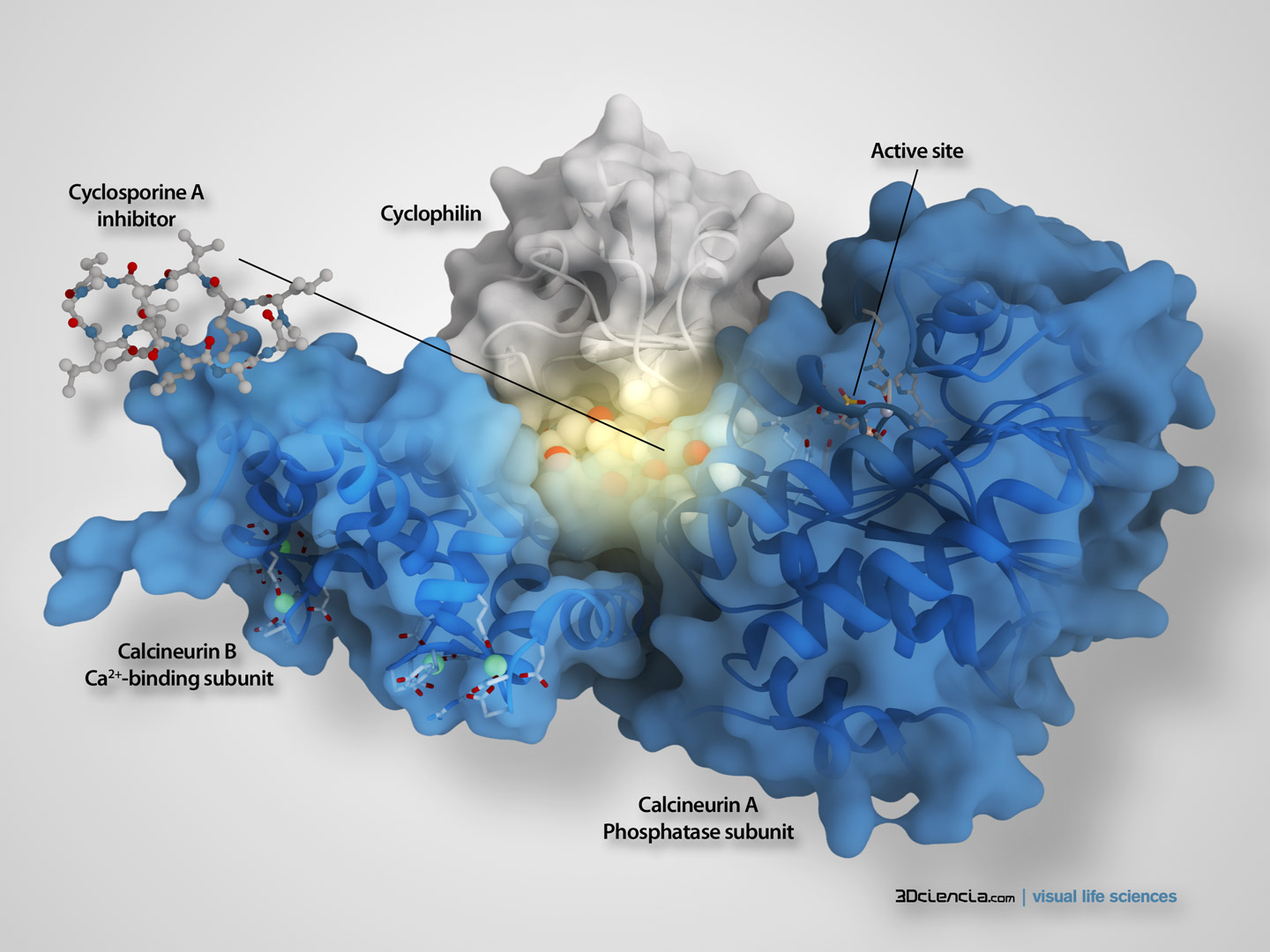
En la imagen de arriba podemos ver la estructura de molécula de ciclosporina A en forma de corona, izquierda de la imagen (representación de bolas y varillas) y unida a su diana por la que ejerce su función farmacológica (representada como modelo de esferas). Se une a la ciclofilina (en blanco) y esta a su vez a la Calcineurina. Esta última es la encargada de permitir la respuesta inmune de los linfocitos por lo que ésta queda bloqueada. Siempre hemos querido saber sobre el origen de la vida y los secretos que la rodean y cómo apareció en nuestro mundo.
El protoplasma-vivo para mantener su forma debe renovar sus moléculas de materia. El recambio de sustancias es lo que se conoce globalmente como metabolismo. Corresponde a reacciones sencillas de oxidación, reducción, hidrólisis, condensación, etc. Estas reacciones se van modificando y perfeccionando, en los casos más optimistas, hasta llegar a diferenciarse procesos idénticos en alguna o algunas reacciones, A. Baj y Palladin estudiaron la respiración, con todas sus reacciones y catalizadas por su fermento específico. S. Kostichev, A. Liebedev estudiaron la química de la fermentación.
Michurin estudió la relación del organismo y el medio. Los fermentos de las estructuras protoplasmáticas determinaban sus reacciones por la velocidad y la dirección, estableciendo una relación con el medio. Se establecía un círculo de fenómenos relacionados y ordenados regularmente. Se producían asimilaciones y desasimilaciones de sustancias orgánicas con el fin de autoconservación y autorenovación del protoplasma.
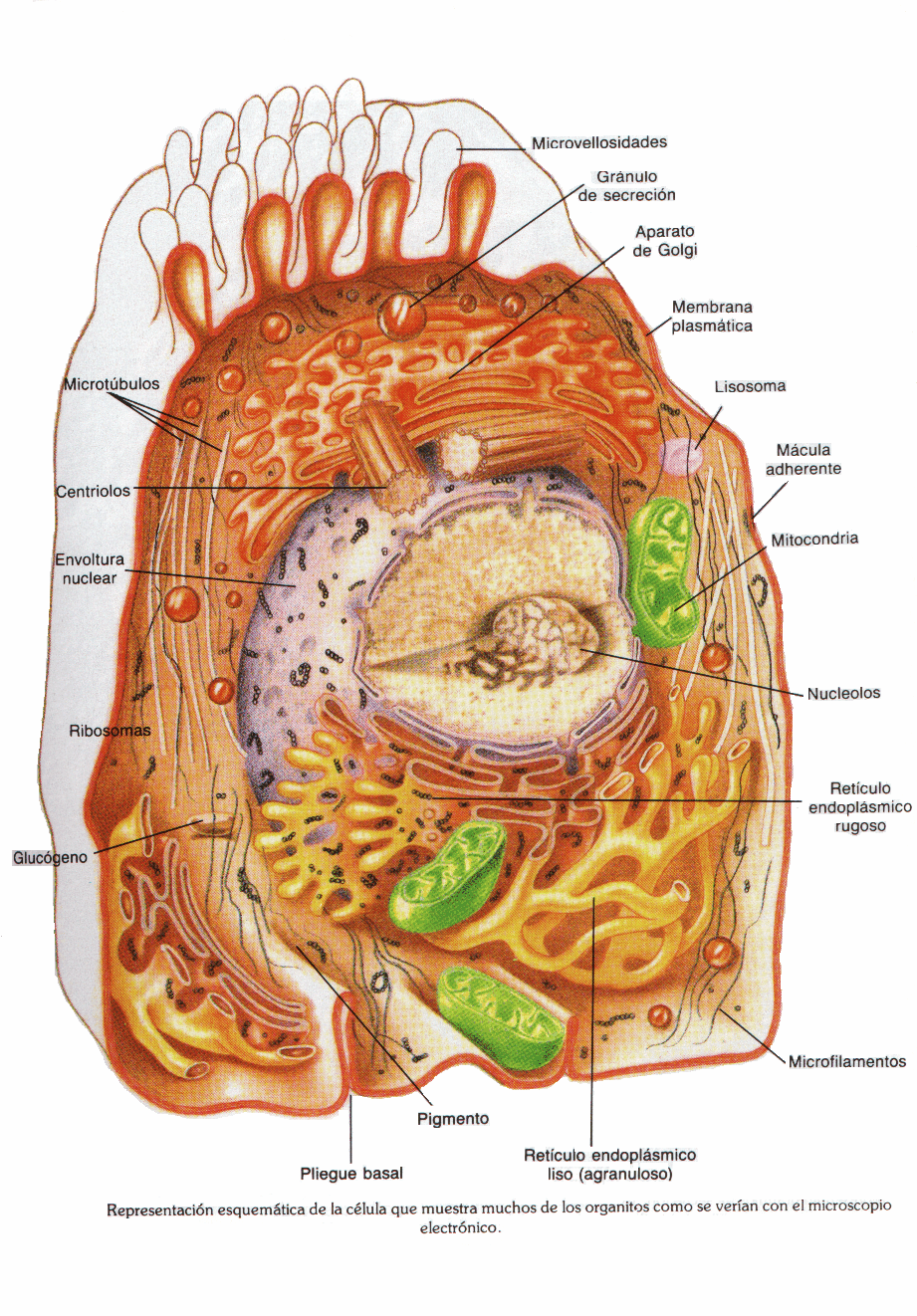
En la base de la organización de todo individuo está la célula, y en la célula el protoplasma vivo, en cuya compleja estructura morfológica y química reside el principio de todas las funciones vitales. Inicialmente la organización morfológica de la célula sólo se conocía a través de los medios ópticos. Dentro de los límites de su poder resolutivo; con la introducción del microscopio electrónico amplió notablemente los conocimientos sobre la estructura celular, al conseguirse aumentos hasta 200 veces superior a los obtenidos por los medios ópticos.
Muchas son las veces que aquí, en este lugar dedicado a distintas disciplinas de la Ciencia, hemos hablado de la Vida. Sin embargo, nunca nos hemos parado a explicar la cuestión del proceso del origen de la vida, conociendo antes, aunque sea de manera sencilla y sin profundidad, aquellos principios básicos de la estructura del protoplasma vivo, ese sustrato material que será la base de todos los seres vivos, sin excepción.
A finales del siglo XIX y principios del XX, había científicos que creían que los organismos sólo eran “máquinas vivientes” especiales, de estructuras muy complejas y, aseguraban que la estructura del protoplasma vivo era algo así como una máquina, construido conforme a un determinado plan y que estaba formado por “vigas” y “tirantes” como si de un puente se tratara y que, de manera similar a éste, los lazos de unión tenían unida toda la estructura que, de esta manera, se mantenía firme, y, esa estructura de tan estricto orden en la colocación recíproca de las distintas partes del protoplasma vivo, era precisamente, según ellos, la causa específica de la vida. Y, a todo ello, sin olvidarse del Carbono, la base de todo signo de vida que conocemos.

Pero el estudio concreto del protoplasma vivo desmintió esta teoría mecanicista. Fue probado que no existía ninguna estructura parecida a una máquina ni siquiera a las de máxima precisión, en el interior del protoplasma vivo.
Es bien conocido que la masa básica del protoplasma vivo es líquida; nos hallamos ante un coacervado complejo, constituido por una gran cantidad de sustancias orgánicas de un peso molecular considerable, entre estas destacan las proteínas y los lipoides. Por esta razón, se encuentran flotando a su libre albedrío en esa sustancia coacervática fundamental, partículas filamentosas coloides, quizás enormes moléculas proteínicas sueltas, y muy probablemente, auténticos enjambres de esas moléculas. El tamaño de las partículas es tan diminuto que no se distinguen ni a través de los microscopios actuales más sofisticados. Pero encontramos otros elementos visibles en el interior del protoplasma vivo. Cuando las moléculas proteínicas y de otras sustancias se unen formando conglomerados, destacan en la masa protoplasmática en forma de pequeñas gotas, captadas a través del microscopio, o en forma de coágulos, con una determina estructura denominados elementos morfológicos. El núcleo, las plastídulas, las mitocondrias, etcétera.

Estos elementos protoplasmáticos, observables a través del microscopio, son, esencialmente, una manifestación aparente y externa de determinadas relaciones de solubilidad, enormemente complejas, de las distintas sustancias que conforman el protoplasma vivo y que se ha podido comprobar que tiene, un papel determinante, en el curso del proceso de la vida, que no se puede comparar de ningún modo con el papel que desempeña una máquina en su trabajo específico. Esto queda totalmente justificado por la sencilla razón de que una máquina y el protoplasma vivo son dos sistemas distintos y contrarios.
Sin duda, lo que caracteriza la función de una máquina es el desplazamiento mecánico de sus diferentes partes en el espacio. Por esa razón hay que insistir que el elemento más importante de la estructura de una máquina es, precisamente, la colocación de sus piezas; mientras que el proceso vital tiene un carácter totalmente distinto. Se manifiesta esencialmente con el recambio de sustancias, o sea, con la interacción química de las diferentes partes que conforman el protoplasma vivo. Por esto deducimos que el elemento primordial en toda la estructuración del protoplasma vivo es el orden concreto que siguen los procesos químicos en el tiempo, la forma tan armónica en que se combinan, siempre con tendencia a conservar en su conjunto el sistema vital.
Es de vital importancia para la formación del protoplasma vivo que exista una estructura interna determinada. Pero otro factor no menos decisivo es la organización en el tiempo, o sea, que los procesos que se dan en el protoplasma vivo lo hagan en armonía. Cualquier organismo, tanto animal, planta o microbio, vive únicamente mientras pasen por él, de forma continuada y constante, nuevas partículas de sustancias, cargadas de energía. Distintos cuerpos químicos pasan del medio ambiente al organismo; y cuando están dentro, sufren unos determinados y esenciales trastornos, mediante los cuales acaban convirtiéndose en sustancias del propio organismo invadido y serán iguales que aquellos cuerpos químicos que antes formaban parte del ser vivo. Este proceso se conoce con el nombre de asimilación. Sin embargo, de forma paralela a este proceso se da la desasimilación, que se trata precisamente del proceso contrario, es decir, las distintas sustancias que forman la parte del organismo vivo son sensibles a los cambios del propio organismo, se desintegran a menor o mayor velocidad, y son sustituidas por los cuerpos asimilados. De esta forma, los productos de la desintegración se echan al medio envolvente.
Por otra parte, en todo esto debemos tener en cuenta un gente que, siendo ineludible para la vida, está siempre presente en todo lo que a ella concierne. El Agua.


El agua pura es un líquido inodoro e insípido. Tiene un matiz azul, que sólo puede detectarse en capas de gran profundidad. A la presión atmosférica (760 mm de mercurio), el punto de congelación del agua es de 0 °C y su punto de ebullición de 100 °C. El agua alcanza su densidad máxima a una temperatura de 4 °C y se expande al congelarse. Como muchos otros líquidos, el agua puede existir en estado sobreenfriado, es decir, que puede permanecer en estado líquido aunque su temperatura esté por debajo de su punto de congelación.
Es muy cierto que la sustancia del organismo vivo siempre se encuentra en movimiento, desintegrándose y volviendo a formarse de manera continua en virtud de la gran cantidad de reacciones de desintegración y síntesis, que se dan guardando una fuerte relación entre ellas. Ya Heráclito, aquel gran dialéctico de la antigua Grecia, nos decía: “nuestros cuerpos fluyen como un arroyo, y de la misma manera que el agua de éste, la materia se renueva en ellos.” Está claro que una corriente o un chorro de agua pueden mantener su forma, su aspecto externo, durante un tiempo, pero su aspecto sólo es la manifestación exterior de ese proceso continuo y constante del movimiento de las partículas del agua. Incluso la misma existencia de este sistema depende, naturalmente, de que las renovadas moléculas de materia pasen constantemente, y a una velocidad determinada por el chorro de agua. Pero si interrumpimos este proceso, el chorro dejará de existir como tal. Lo mismo sucede en todos los sistemas conocidos como dinámicos, los cuales tienen un proceso concreto.

Es un hecho concreto e innegable que los seres vivos también son sistemas dinámicos. Igual que el chorro de agua al que antes hacíamos referencia, su forma y su estructura sólo forman parte de la expresión externa y aparente de un equilibrio, muy competente, formado por procesos que se dan en el ser vivo en sucesión permanente a lo largo de toda su vida. Sin embargo, el carácter de estos procesos es totalmente diferente a los que ocurre en los sistemas dinámicos de la naturaleza orgánica.
Las moléculas de agua llegan al chorro, ya como moléculas de agua, y lo atraviesan sin que se produzca ningún cambio. Pues el organismo toma del medio ambiente sustancias ajenas y desconocidas para él, pero a continuación, mediante procesos químicos muy complejos, son convertidos en sustancias del propio organismo, muy parecidas a los materiales que forman su cuerpo.
Precisamente esto es lo que hace posible las condiciones que mantienen constantemente la composición y estructura del organismo, ignorando este proceso continuo e ininterrumpido de desasimilación que se da en todos los organismos vivos.
Así pues, desde una perspectiva puramente química, el recambio de sustancias, también llamado metabolismo, es un conjunto enorme de reacciones más o menos sencillas, de oxidación, reducción, hidrólisis, condensación, etcétera. Lo que lo hace diferente del protoplasma vivo, es que en el metabolismo, estas reacciones se encuentran organizadas en el tiempo de de cierto modo, las cuales se combinan para poder crear un sistema integral. Dichas reacciones no surgen por casualidad, y de forma caótica, sino que se dan en estricta sucesión, y en un orden armónico concreto.
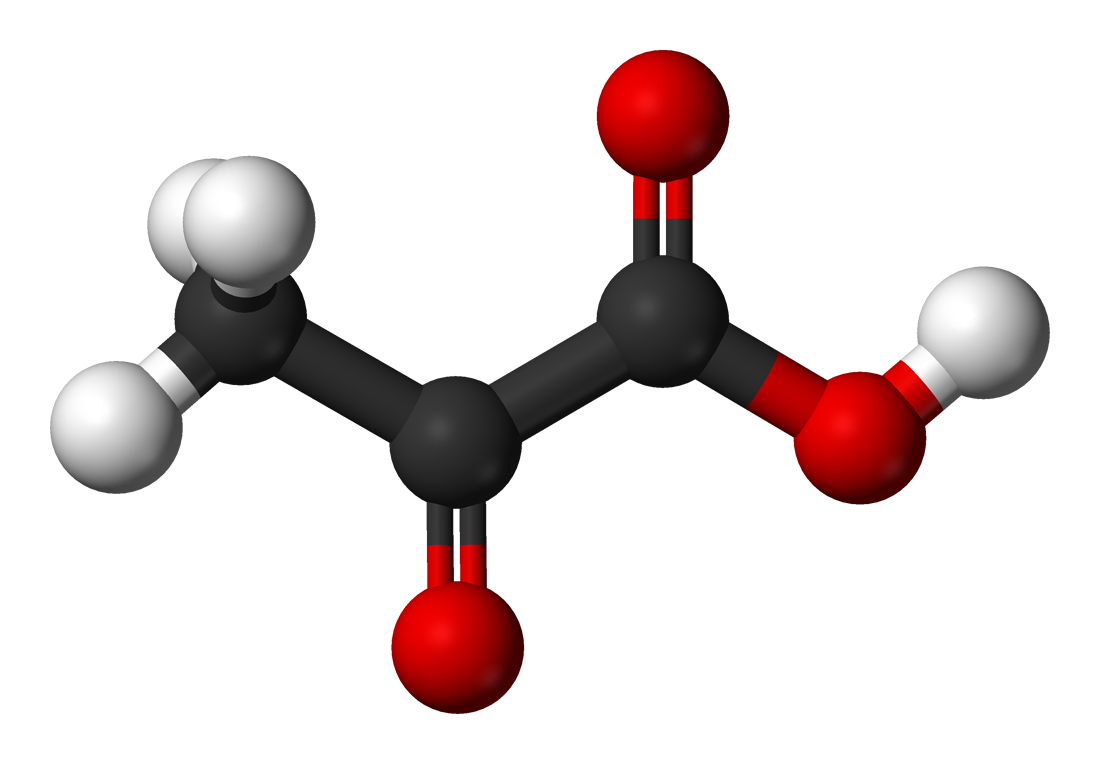
El ácido pirúvico (ver otros nombres en la tabla) es un ácido alfa-ceto que tiene un papel importante en los procesos bioquímicos. El anión carboxilato del ácido pirúvico se conoce como piruvato. El ácido pirúvico es un compuesto orgánico clave en el metabolismo. Es el producto final de la glucolisis, una ruta metabólica universal en la que la glucosa se escinde en dos moléculas de piruvato y se origina energía (2 moléculas de ATP).
Ese orden será la base de todos los fenómenos vitales conocidos. En la fermentación alcohólica, por ejemplo, el azúcar proveniente del líquido, que es fermentable, penetra en la célula de la levadura, sufriendo determinados trastornos químicos. O sea, primero se le incorpora el ácido fosfórico y luego se divide en dos partes.
Una de las cuales experimentará un proceso de reducción, mientras que la otra se oxidará, quedando convertida, finalmente, en ácido pirúvico, que más tarde se descompondrá en anhídrido carbónico y acetaldehído. Este último se reducirá, quedando transformado después en alcohol etílico. Como resultado, podemos observar que el azúcar queda convertido en alcohol y anhídrido carbónico.

Esto nos demuestra que en la célula de la levadura, lo que determina la producción de estas sustancias es el extraordinario rigor con que se dan todas estas reacciones, las cuales se suceden de forma muy ordenada. Sólo con que sustituyésemos en esta cadena de transmutaciones un único eslabón o si alterásemos en lo más mínimo el orden de dichas transmutaciones ya no tendríamos como resultado alcohol etílico, sino cualquier otra sustancia. En efecto, en las bacterias de la fermentación de la leche, el azúcar, al principio sufría los mismos cambios en la levadura, pero cuando se llega a la fermentación del ácido pirúvico, éste ya no se descompone, todo lo contrario, se reduce al instante. Esto explica que en las bacterias de la fermentación láctica el azúcar no se transforme en alcohol etílico, sino en ácido láctico.
Las encimas
La enzimología, al igual que las disciplinas experimentales que han surgido como ramas del tronco común que es la biología, tiene una historia propia construida a través de observaciones, experiencias, pruebas y teorías.
Se inició con el estudio de los procesos de fermentación y de putrefacción y Antoine-Laurente Lavoisier fue el primero en plantear sobre bases cuantitativas el proceso de la fermentación alcohólica, al observar una relación entre cantidad de azúcar presente y productos formados durante el proceso.
Un estudio de la síntesis de distintas sustancias en el protoplasma vivo demuestra que éstas no se crean de repente, y no provienen de un acto químico especial, sino que son el resultado de una cadena larguísima de trastornos químicos.
No puede constituirse un cuerpo químico complejo, propio de un ser vivo en concreto, sin que se produzcan centenares o miles de reacciones en un orden regular, constante, y ya previsto con rigurosidad, lo cual constituirá la base de la existencia del protoplasma vivo.
La Biología Físico-Química
La bioquímica, es la rama de la Química y de la Biología que tiene por objetivo principal el conocimiento de la estructura y comportamiento de las moléculas biológicas, que son compuestos de Carbono que forman las diversas partes de la célula y llevan a cabo las reacciones químicas las que le permiten crecer, alimentarse, reproducirse y usar y almacenar energía.
Porque cuanto más compleja es la sustancia, más reacciones intervienen en su formación dentro del protoplasma vivo y estas reacciones deben coordinarse entre sí con mayor rigor y exactitud. En efecto, investigaciones bastante recientes han demostrado que en la síntesis de las proteínas a partir de los aminoácidos toman parte gran cantidad de reacciones que se producen en una sucesión muy ordenada. Únicamente como consecuencia de esta rigurosa armonía, de esta sucesión ordenada de las reacciones, se da en el protoplasma vivo ese ritmo estructural, esa regularidad en la sucesión de los distintos aminoácidos que también podemos apreciar en las proteínas actuales.
Por consiguiente, las moléculas proteínicas, así originadas y con una estructura determinada se agrupan entre sí, y ciertas leyes las hacen tender a la formación de auténticos conglomerados moleculares que se acaban separando de la masa protoplasmática y se distinguen como elementos morfológicos, visibles a través del microscopio, como formas protoplasmáticas características por su gran movilidad. De esta manera, la composición química propia del protoplasma vivo, como su estructura, son la manifestación del orden en que se producen estos procesos químicos que se dan de forma continua y permanente en la materia viva.
Hidrógeno

Todos sabemos de su importanica para la vida
En el siglo XVI se observó que cuando el ácido sulfúrico actuaba sobre el hierro se desprendía un gas combustible. En 1766 Henry Cavendish demostró que dicho gas era una sustancia distinta a otros gases también combustibles, confundiendo el gas obtenido, al que llamo <<aire inflamable>>. Provenía del hierro y no del ácido sulfúrico, también demostró que el gas en el aire y en el oxígeno se formaba Agua

La Atmósfera
Es la capa de gas que rodea a un cuerpo celeste que tenga la suficiente masa como para atraer ese gas. Los gases son atraídos por la gravedad del cuerpo, y se mantienen en ella si la gravedad es suficiente y la temperatura de la atmósfera es baja. Algunos planetas están formados principalmente por gases, con lo que tienen atmósferas muy profundas. Si no se dan ciertos parámetros, el protoplasma vivo de la vida, nunca habría hecho acto de presencia.
– Nitrógeno (78%) y
– Oxígeno (21%)
 – El 1% restante lo forma
– El 1% restante lo forma
n el argón (0,9%), el dióxido de Carbono (0,03%), y distintas proporciones de vapor de agua, y trazas de hidrógeno, ozono, metano, monóxido de Carbono, helio, neón, kriptón y xenón.
Ozonosfera y sodiosfera
Desde 15 hasta 60 kilómetros de altitud, el ozono, que en las zonas próximas al suelo se encuentra sólo en pequeñas cantidades, aparece en porcentajes más sensibles y forma la ozonosfera. Este ozono absorbe la radiación ultravioleta procedente del Sol, haciendo posible de es modo la existencia de vida en la Tierra.
Pues bien, debemos preguntarnos de qué depende ese orden, propio de la organización del protoplasma vivo, y cuáles son sus causas inmediatas. Un estudio minucioso sobre esta cuestión dejará demostrado que el orden indicado no es simplemente algo externo, que queda al margen de la materia viva, teoría defendida por los idealistas; en cambio, hoy día, sabemos perfectamente que la velocidad, la dirección y el encadenamiento de las diferentes reacciones, todo lo que forma el orden que estamos viendo, depende totalmente de las relaciones físicas y químicas que se establecen en el protoplasma vivo.

Las propiedades químicas de las sustancias integradoras del protoplasma vivo, en primer lugar, y también las de las sustancias orgánicas que intervienen son las que constituyen la base de todo ello. Dichas sustancias orgánicas poseen enormes posibilidades químicas y pueden generar gran variedad de reacciones. Pero, aprovechan estas posibilidades con mucha “pereza”, lentamente, a veces a una velocidad ínfima. En muchas ocasiones, se necesitan meses e incluso años, para que llegue a producirse alguna de las reacciones efectuadas entre las mismas sustancias orgánicas. Por esto, los químicos, para acelerar el proceso de las reacciones entre las sustancias orgánicas, usan a menudo en su trabajo diferentes sustancias de acción enérgica-ácidos y álcalis fuertes, etcétera.

Reacciones químicas por todo el universo
Para conseguir tal aceleramiento cada vez con más frecuencia, los químicos recurren a la utilización de los catalizadores. Hace ya mucho tiempo que habían notado que sólo con añadir una pequeña dosis de algún catalizador a la mezcla donde se estaba realizando una reacción, se producía un gran aceleramiento de ésta. Además, otra propiedad propia e los catalizadores es que no se destruyen durante el proceso de la reacción, y cuando esta finaliza, comprobamos que queda exactamente la misma cantidad de catalizador que añadimos a la mezcla al principio. Así que, cantidades insignificantes de catalizador son suficientes, muchas veces, pata provocar la rápida transmutación de masas considerables de diferentes sustancias. Esta cualidad, hoy día, es de gran utilidad para la industria química, que usa como catalizadores distintos metales, sus óxidos, sus sales y otros cuerpos orgánicos o inorgánicos. Las reacciones químicas dadas en animales y vegetales entre las distintas sustancias orgánicas se suceden a gran velocidad. De lo contrario, la Vida no pasaría tan rápida como en realidad pasa. Se sabe que la gran velocidad de las reacciones químicas producidas en el protoplasma vivo es debida a la presencia constante de catalizadores biológicos especiales llamados fermentos.

Hace tiempo que estos fermentos fueron descubiertos, y ya con anterioridad, los científicos se habían fijado en ellos. Pues resultó que los fenómenos se podían extraer del protoplasma vivo y así separarse en forma de solución acuosa o como polvo seco de fácil solubilidad. Esto me hace pensar en lo que ocurre en las Nebulosas. No hace mucho se consiguieron fermentos en forma cristalina y se resolvió su composición química. Estos resultaron ser proteínas, y muchas veces, en combinación con otras sustancias de distinta naturaleza. Estos fermentos, por el carácter de su acción, se asemejan a los catalizadores inorgánicos. Sin embargo, se diferencian de ellos por la increíble intensidad de sus efectos.
En este sentido, los fermentos superan a los catalizadores inorgánicos de acción en centenares de miles, y en ocasiones hasta en millones de veces. Así que en los fermentos de naturaleza proteínica se da un mecanismo increíblemente perfecto y racional que hace posible acelerar las reacciones químicas entre las distintas sustancias orgánicas. Los fermentos también se caracterizan por la excepcional especifidad de su acción.
La Teoría Celular

Llegados a este punto debemos profundizar un poco más en la constitución de los seres vivos. Para ello debemos saber la teoría celular, enunciada por Matthias Schleiden (1804-1881) y Theodor Schwann (1810-1882).
La teoría celular de Schleiden y Schwann señala un rasgo común para todos los seres vivos: todos están compuestos por células y por productos elaborados por ellas. Aunque la idea de que la célula es el “átomo” de la vida nos parezca evidente, su importancia y la dificultad de su descubrimiento son parejas a la dificultad del descubrimiento de la existencia de átomos en química, y marca un cambio de paradigma en la manera de concebir la vida.
La teoría celular se basó en los adelantos realizados mediante los aparatos de observación debidos inicialmente a Robert Hooke (1635-1703) y a Anton Van Leeuwenhoek (1632-1723). Hooke construyó cientos de microscopios. Los más avanzados estaban formados por dos lupas combinadas como ocular y objetivo (microscopio compuesto).


Aunque con ellos llegó a alcanzar 250 aumentos, eran preferibles los de una sola lente, como los que construyó van Leeuwenhoek, ya que presentaban menos aberración cromática. Con esos instrumentos consiguieron descubrir infusorios (aquellas células o microorganismos que tienen cilios u otras estructuras de motilidad para su locomoción en un medio líquido), bacterias, la existencia de capilares en la membrana interdigital de las ranas.
Ahora sabemos que tanto los paramecios como los organismos superiores están formados por una o más células, almacenan y transportan la energía, duplican su material genético y utilizan la información que ese material contiene para sintetizar proteínas siempre de la misma forma. Todos estos procesos, que están presentes en todas las células, son los que forman la maquinaria de la vida.
Sustancias orgánicas que nos dan las vitaminas
Por supuesto, esto es a causa de las particularidades del efecto catalítico de las proteínas; pues la sustancia orgánica (el sustrato) que sufre alteraciones en el transcurso del proceso metabólico, forma ya al principio, una unión bastante compleja aunque de corta duración, con la correspondiente proteína-fermento. Esta fusión tan completa, no es estable, pues sufre distintos trastornos con mucha rapidez: el sustrato sufre las transformaciones correspondientes y el fermento se regenera, para poder unirse de nuevo a otras porciones del sustrato.
Entonces, para que las sustancias integradoras del protoplasma vivo puedan participar realmente con el metabolismo, debe combinarse con una proteína y constituir con ella un enlace complejo. De no ser así, sus posibilidades químicas se producirán muy lentamente y entonces perderán toda su importancia en el impetuoso proceso vital. Por esta razón el cómo se modifique una sustancia orgánica en el transcurso del metabolismo, depende, además de la estructura molecular de esta sustancia, y de las posibilidades químicas de la misma, también de la acción de fermentación de las proteínas protoplasmáticas, las cuales se encargan de llevar esa sustancia al proceso metabólico general.

Los fermentos, además de ser un poderoso acelerador de los procesos químicos sufridos por la materia viva; son también un mecanismo químico interno, el cual se encarga de que esos procesos sean conducidos por un cauce muy concreto. La gran especificidad de las proteínas-fermentos consigue que cada una de ellas forme enlaces complejos sólo con determinadas sustancias y catalice solamente algunas reacciones. Por esto, cuando se produce éste o el otro proceso vital, y con más motivo, cuando se verificas todo el proceso metabólico, actúan miles de proteínas-fermento de distintas clases. Cada una de estas proteínas puede catalizar de forma específica una sola reacción, y sólo el conjunto de acciones de todas ellas, en muy precisa combinación, hará posible ese orden regular de los fenómenos que entendemos como base del metabolismo.
Con el uso de los distintos fermentos específicos que se obtienen a partir del organismo vivo, en el laboratorio, pueden reproducirse de forma aislada cada una de las reacciones químicas, y todos los eslabones que forman el proceso metabólico. Así desenredamos el ovillo tan sumamente complicado de las transmutaciones químicas producidas durante el metabolismo, donde miles de reacciones individuales se mezclan. Por este mismo procedimiento se puede descomponer el proceso metabólico en sus diferentes etapas químicas, se puede analizar las sustancias integradora de la materia viva, y además los distintos procesos realizados en ella.

De esa manera se demostró que la respiración funciona a partir de una serie de reacciones como la oxidación o la reducción, dichas reacciones se dan con muchísimo rigor en un orden estricto y cada una de éstas es catalizada por un fermento específico (S.Kóstichev, A. Liédev y otros autores).
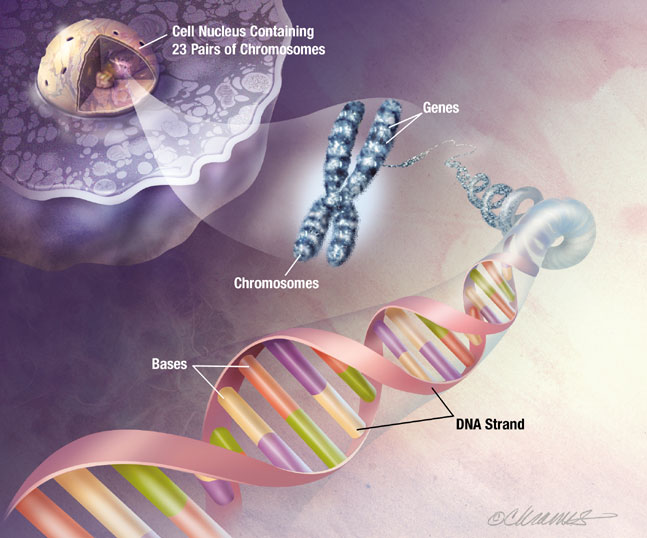
En 1878 el biólogo alemán Walter Fleming descubrió que se podían teñir unas estructuras existentes en el interior del núcleo y llamo cromatina a la materia que las formaban.
Como las células de la preparación morían al teñirse, y en una preparación existían células en muy diferentes etapas de crecimiento y división, Fleming pudo estudiar estas etapas y comprender cómo evolucionaba la vida de la célula.
Al comenzar el proceso de división celular la cromatina forma una especie de hilos que se denominan, con mucha lógica, cromosomas (cuerpos coloreados) y Fleming llamó al proceso de división celular mitosis, una palabra griega que significa hilo.
En 1887 el biólogo belga Edouart van Beneden contó el número de cromosomas de células de diferentes especies y llegó a la conclusión de que el número de cromosomas es una característica de la especie. Todas las células humanas tienen 46 cromosomas.
También descubrió que los espermatozoides y los óvulos tenían la mitad de los cromosomas de las células normales, y dedujo que al unirse conservaban todos sus cromosomas, con lo que recuperaban el número característico de la especie.

Imagen de espermatozoides
Tanto Fleming como van Beneden comprendieron que eran los cromosomas del huevo los que determinaban las características del animal que se iba a formar, pero no podían saber el mecanismo por el que lo hacían.
Por entonces se empezó a llamar citoplasma vivo al conjunto de protoplasma vivo y orgánulos que están comprendidos entre el núcleo y la pared o membrana celular, y se empezaron a estudiar estos orgánulos.
Así, en 1898 el biólogo alemán Carl Benda descubrió las mitocondrias, que en griego significa hilos de cartílago. Ahora sabemos que son los órganos que se encargan de la obtención de energía a partir de azúcar y oxígeno. Ese mismo año Golgi descubrió el complejo que lleva su nombre.

Aminoácidos y azúcares de la vida están ahí presentes
Hoy día, ya hemos dado el salto del análisis de los procesos vitales a su reproducción, a su síntesis. De esta forma, combinando de manera precisa en una solución acuosa de azúcar, una veintena de fermentos distintos, obtenidos a partir de seres vivos, pueden reproducirse los fenómenos propios de la fermentación alcohólica. En este líquido, donde gran cantidad de proteínas distintas se hallan disueltas, los trastornos que sufre el azúcar son verificados en el mismo orden regular que siguen en la levadura viva, aunque aquí no existe ninguna estructura celular.
Todos estos procesos son, en realidad, terriblemente complejos y están expuestos a que, cualquier alteración del medio incida de manera directa en su devenir. Pero, por otra parte y en las circunstancias adecuadas, no existe ningún factor físico o químico, ni sustancia orgánica o sal inorgánica que, de alguna manera, puedan alterar el curso de las reacciones fermentativas. Cualquier aumento o disminución de la temperatura, alguna modificación de la acidez del medio, del potencial oxidativo y de la composición salina o de la presión osmótica, alterará la correlación entre las velocidades de las distintas reacciones de fermentación, y de esta forma cambia su sucesión temporal. Es aquí donde se asientan todas las premisas de esa unidad entre el organismo y el medio, tan característica de la vida.

Esta organización tan especial de la sustancia viva influye en gran manera, en las células de los organismos actuales, en el orden y la dirección de las reacciones fermentativas, las cuales son la base del proceso metabólico. Cuando se agrupan las proteínas entre sí pueden quedar aisladas de la solución general y conseguir diferentes estructuras protoplasmáticas de muy ágil movimiento. Con total seguridad, sobre la superficie de estas estructuras se encuentran concentrados gran cantidad de fermentos.
Está claro que el orden característico de la organización del protoplasma está basado en las distintas propiedades químicas de las sustancias integradoras de la materia viva.

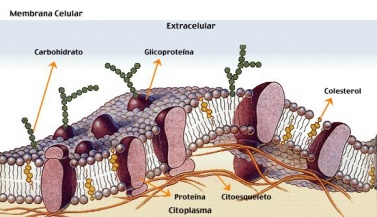
1.-Todos los seres vivos están formados por células y sus productos. Por tanto la célula es la unidad anatómica del organismo.
2.-Todas las células proceden de otras células preexistentes y éstas, a su vez, de otras células. Esto lo certificaron los viejos científicos con el axioma omnis cellula e cellula, latinajo que significa lo que todos ustedes suponen, que toda célula procede de otra célula.
3.-La célula es la unidad funcional del organismo.
4.-La célula es también la unidad genética del organismo.
Básicamente la célula está formada por tres elementos:
• Núcleo
• Membrana y
• Citoplasma
La membrana envuelve la célula confiriéndole su individualidad. Dicho de otra manera, la célula es una unidad separada de otras células por su membrana.
El citoplasma está formado por un líquido llamado citosol (solución celular) y gran cantidad de gránulos que reciben el nombre genérico de organelos y que más adelante describiremos. Adelantemos que en estos organelos hay una gran actividad ya que se encargan de funciones digestivas y respiratorias.
El núcleo está separado del resto del citoplasma por otra membrana, la membrana nuclear. En su interior se encuentra el material genético que crea los patrones para producir nuevas células con las características de nuestra especie. Una célula humana siempre producirá otra célula humana.
Hablar de nosotros mismos es demasiado complejo para que, científicamente podamos abarcar todo lo que somos ym sólo poco a poco podemos ir comprendiendo la grandeza que en nosaotros está representada como esa parte del universo que piensa, tiene ideas y sentimientos y, en definitiva, es la materia del Universo evolucionada hasta su más alto grado hasta el momento conocido.
emilio silvera
May
19
Moléculas, sustancias, cuerpos…
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Alquimia estelar ~
Clasificado en Alquimia estelar ~
 Comments (0)
Comments (0)
El material más abundante del Universo es el Hidrógeno cuyos átomos contienen un sólo protón y un sólo electrón. Sin embargo, a partir de él se pueden conseguir todos los elementos que existen mediante una transición de fase que, generalmente, se produce en las estrellas.
Es allí, en las estrellas, en sus hornos nucleares y en las explosiones de supernovas, donde a miles de millones de grados de temperatura, se crean los elementos más complejos que el hidrógeno y el helio. Aparece el litio, el carbono, el silicio o el nitrógeno y el hierro.

De estos materiales estamos nosotros hechos, y, lógicamente, se fabricaron en las estrellas.
En una supernova, en orden decreciente tenemos la secuencia de núcleos H, He, O, C, N, Fe, que coincide bastante bien con una ordenación en la tabla periódica que es:
H, He, (Li, Be, B) C, N, O…… Fe
¿Apreciáis la maravilla? Las estrellas brillan en el cielo para hacer posible que nosotros estemos aquí descubriendo los enigmas del Universo y…. de la vida inteligente.

El telescopio VLT (Very Large Telescope) de ESO ha obtenido imágenes de una fascinante región de formación de estrellas en la Gran Nube de Magallanes — una de las galaxias satélite de la Vía Láctea. Esta precisa imagen revela dos peculiares y brillantes nubes de gas: la rojiza NGC 2014 y su vecina azulada NGC 2020. Pese a que son muy diferentes, ambas fueron esculpidas por potentes vientos estelares procedentes de estrellas recién nacidas extremadamente calientes que también irradian el gas, provocando que brille de forma intensa. (para verla entera hay que pasar la rgla hacia la derehca).
Pero está claro que, todo el proceso estelar evolutivo inorgánico nos condujo desde el simple gas y polvo cósmico a la formación de estrellas y nebulosas solares hasta los planetas, la Tierra en particular, en cuyo medio ígneo describimos la formación de las estructuras de los silicatos, desplegándose con ello una enorme diversidad de composiciones, formas y colores, asistiéndose, por primera vez en la historia de la materia, a unas manifestaciones que contrastan con las que hemos mencionado en relación al proceso de las estrellas.
Desde el punto de vista del orden es la primera vez que nos encontramos con objetos de tamaño comparables al nuestro, en los que la ordenación de sus constituyentes es el rasgo más característico.
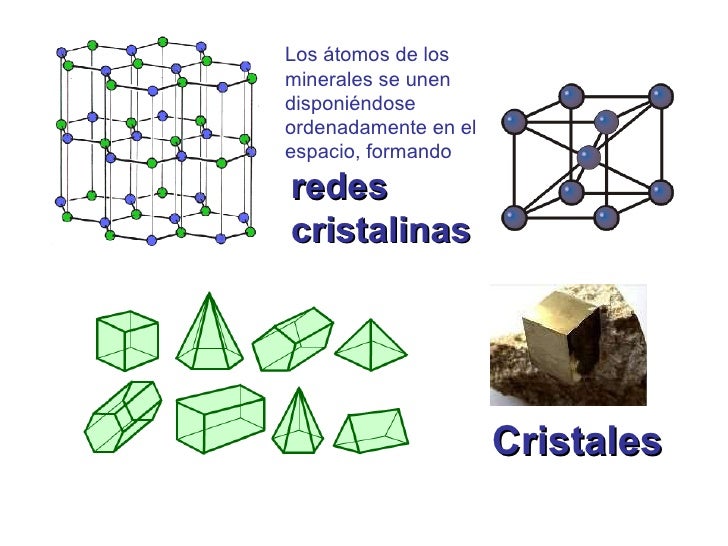
Al mismo tiempo nos ha parecido reconocer que esos objetos, es decir, sus redes cristalinas “reales”, almacenan información (memoria) que se nos muestra muy diversa y que puede cobrar interés en ciertos casos, como el de los microcristales de arcilla, en los que, según Cairos-Swith, puede incluso llegar a transmitirse.
Porque ¿qué sabemos en realidad de lo que llamamos materia inerte? Lo único que sabemos de ella son los datos referidos a sus condiciones físicas de dureza, composición, etc., en otros aspectos, ni sabemos si pueden existir otras propiedades distintas a las meramente-físicas.
¿No os hace pensar que nosotros estemos hechos, precisamente, de lo que llamamos materia inerte?

Pero el mundo inorgánico es sólo una parte del inmenso mundo molecular. El resto lo constituye el mundo orgánico, que es el de las moléculas que contienen carbono y otros átomos y del que quedan excluidos, por convenio y características especiales, los carbonatos, bicarbonatos y carburos metálicos, los cuales se incluyen en el mundo inorgánico.
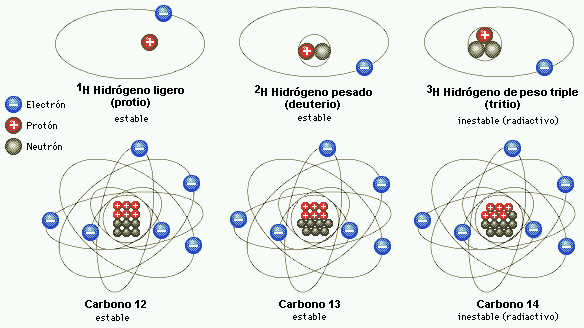
Según decía en páginas anteriores, los quarks u y d se hallan en el seno de los nucleones (protones y neutrones) y, por tanto, en los núcleos atómicos. Hoy día, estos se consideran como una subclase de los hadrones.
La composición de los núcleos (lo que en Química se llama análisis cualitativo) es extraordinariamente sencilla ya que, como es sabido, constan de neutrones y protones que se pueden considerar como unidades que, dentro del núcleo, mantienen su identidad. Tal simplicidad cualitativa recuerda, por ejemplo, el caso de las series orgánicas, siendo la de los hidrocarburos saturados la más conocida. Recordad que su fórmula general es , lo que significa que una molécula de hidrocarburo contiene n átomos de carbono (símbolo C) y (2n+2) átomos de hidrógeno (símbolo H).
El número de protones y neutrones determina al elemento, desde el hidrógeno (el más simple), al Uranio (el más complejo), siempre referido a elementos naturales que son 92, el resto, son artificiales, los conocidos transuránicos en cuyo grupo están el Einstenio o el Plutonio, artificiales todos ellos.
Los núcleos, como sistemas dinámicos de nucleones, pertenecen obviamente a la microfísica y, por consiguiente, para su descripción es necesario acudir a la mecánica cuántica. La materia, en general, aunque presumimos de conocerla, en realidad, nos queda mucho por aprender de ella.
Hablemos un poco de moléculas.

El papel primordial del agua en el metabolismo de los seres vivos se debe sus propiedades físicas y químicas, derivadas de la estructura molecular.
El número de especimenes atómicos es finito, existiendo ciertas razones para suponer que hacia el número atómico 173 los correspondientes núcleos serían inestables, no por razones intrínsecas de inestabilidad “radiactiva” nuclear, sino por razones relativistas. Ya antes me referiría a las especies atómicas, naturales y artificiales que son de unos pocos millares; en cambio; el número de moléculas conocidas hasta ahora comprende varios millones de especimenes, aumentando continuamente el número de ellas gracias a las síntesis que se llevan a cabo en numerosos laboratorios repartidos por todo el mundo.
Una molécula es una estructura, con individualidad propia, constituida por núcleos y electrones. Obviamente, en una molécula las interacciones deben tener lugar entre núcleos y electrones, núcleos y núcleos y electrones y electrones, siendo del tipo electromagnético.

Proteina supresora de tumores p53 encajada a una secuencia de ADN
Debido al confinamiento de los núcleos, el papel que desempeñan, aparte del de proporcionar la casi totalidad de la masa de la molécula, es poco relevante, a no ser que se trate de moléculas livianas, como la del hidrógeno. De una manera gráfica podríamos decir que los núcleos en una molécula constituyen el armazón de la misma, el esqueleto, cuya misión sería proporcionar el soporte del edificio. El papel más relevante lo proporcionan los electrones y en particular los llamados de valencia, que son los que de modo mayoritario intervienen en los enlaces, debido a que su energía es comparativamente inferior a la de los demás, lo que desempeña muy importante papel en la evolución.

Desde las moléculas más sencilla, como la del hidrógeno, con un total de 2 electrones, hasta las más complejas, como las de las proteínas, con muchos miles de ellos, existe toda una gama, según decía, de varios millones. Esta extraordinaria variedad de especies moleculares contrasta con la de las especies nucleares e incluso atómicas.
Sin entrar en las posibles diferencias interpretativas de estas notables divergencias, señalaré que, desde el punto de vista de la información, las especies moleculares la poseen en mucho mayor grado que los nucleares y atómicas.
Dejando aparte los núcleos, la información que soportan los átomos se podría atribuir a la distribución de su carga eléctrica, y en particular a la de los electrones más débilmente ligados. Concretando un poco se podría admitir que la citada información la soportan los orbitales atómicos, pues son precisamente estos orbitales las que introducen diferencias “geométricas” entre los diferentes electrones corticales.
Justamente esa información es la que va a determinar las capacidades de unión de unos átomos con otros, previo el “reconocimiento” entre los orbitales correspondientes. De acuerdo con la mecánica cuántica el número de orbitales se reduce a unos pocos. Se individualizan por unas letras hablándose de orbitales, s, p, d, f, g, h. Este pequeño número nos proporciona una gran diversidad.
La llamada hibridación (una especie de mezcla) de orbitales es un modo de aumentar el número de mensajes, esto es, la información, bien entendido que esta hibridación ocurre en tanto y en cuanto dos átomos se preparan para enlazarse y formar una molécula. En las moléculas, la información, obviamente, debe de abarcar a todo el edificio, por lo que en principio parece que debería ser más rica que en los átomos. La ganancia de información equivale a una disminución de entropía; por esta razón, a la información se la llama también negantropía.
En términos electrónicos, la información se podría considerar proporcionada por un campo de densidad eléctrica, con valles, cimas, collados, etc., es decir, curvas isoelectrónicas, equivalentes formalmente a las de nivel en topografía. Parece razonable suponer que cuanto más diverso sean los átomos de una molécula, más rica y variada podrá ser su información, la información que pueda soportar.
La enorme variedad de formas, colores, comportamientos, etc., que acompaña a los objetos, incluidos los vivientes, sería una consecuencia de la riqueza en la información que soportan las moléculas (y sus agregados) que forman parte de dichos objetos. Ello explicaría que las moléculas de la vida sean en general de grandes dimensiones (macromoléculas). La inmensa mayoría de ellas contiene carbono. Debido a su tetravalencia y a la gran capacidad que posee dicho átomo para unirse consigo mismo, dichas moléculas pueden considerarse como un esqueleto formado por cadenas de esos átomos.
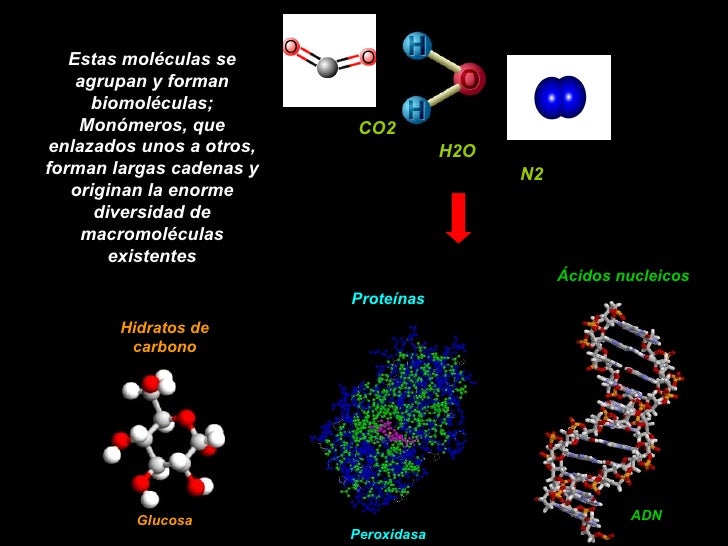
Estas moléculas se agrupan y forman biomoléculas; Monómeros, que enlazados unos a otros, forman largas cadenas y originan la enorme diversidad de macromoléculas existentes CO2 H2O N2 Hidratos de carbono Glucosa Peroxidasa.
El carbono no es el único átomo con capacidad para formar los citados esqueletos. Próximos al carbono en la tabla periódica, el silicio, fósforo y boro comparten con dicho átomo esa característica, si bien en un grado mucho menor.
Refiriéndonos al silicio, que para nosotros es el más importante, señalaremos que las “moléculas” que dicho átomo forma con el oxígeno y otros átomos, generalmente metálicos, poseyendo gran nivel de información, difieren, en varios aspectos, de las moléculas orgánicas, es decir, de las que poseen un esqueleto de átomos de carbono.

El mundo de los silicatos es de una gran diversidad, existiendo centenares de especies minerológicas. Esas diferencias se refieren, fundamentalmente, a que el enlace químico en el caso de las moléculas orgánicas es covalente, y cuando se forma la sustancia correspondiente (cuatrillones de moléculas) o es un líquido, como es el caso de los aceites, o bien un sólido que funde fácilmente. Entre las moléculas que lo forman se ejercen unas fuerzas, llamadas de van der Waals, que, pueden considerarse como residuales de las fuerzas electromagnéticas, algo más débiles que éstas. En cambio, en los silicatos sólidos (como en el caso del topacio) el enlace covalente o iónico no se limita a una molécula, sino que se extiende en el espacio ocupado por el sólido, resultando un entramado particularmente fuerte.
Al igual que para los cristales de hielo, en la mayoría de los silicatos la información que soportan es pequeña, aunque conviene matizar este punto. Para un cristal ideal así sería en efecto, pero ocurre que en la realidad el cristal ideal es una abstracción, ya que en el cristal real existen aquí y allá los llamados defectos puntuales que trastocan la periodicidad espacial propia de las redes ideales. Precisamente esos defectos puntuales podían proporcionar una mayor información.

Las moléculas orgánicas con enlaces dobles ó triples tienen también formas características.
Si prescindimos de las orgánicas, el resto de las moléculas que resultan de la combinación entre los diferentes átomos no llega a 100.000, frente a los varios millones de las primeras. Resulta ranozable suponer que toda la enorme variedad de moléculas existentes, principalmente en los planetas rocosos, se haya formado por evolución de los átomos, como corresponde a un proceso evolutivo. La molécula poseería mayor orden que los átomos de donde procede, esto es, menor entropía. En su formación, el ambiente se habría desordenado al ganar entropía en una cierta cantidad tal, que arrojarse un balance total positivo.
No puedo, dejar pasar la oportunidad, aunque sea de pasada, remencionar las sustancias.
Tipos de energía que se almacena en moléculas orgánicas
Las así llamadas, son cuerpos formados por moléculas idénticas, entra las cuales pueden o no existir enlaces químicos. Veremos varios ejemplos. Las sustancias como el oxígeno, cloro, metano, amoníaco, etc., se presentan en estado gaseoso en condiciones ordinarias de presión y temperatura. Para su confinamiento se embotellan, aunque existen casos en que se encuentran mezcladas en el aire (os podéis dar una vueltecita por el Polo químico de Huelva).
En cualquier caso, un gas como los citados consiste en un enjambre de las moléculas correspondientes. Entre ellas no se ejercen fuerzas, salvo cuando colisionan, lo que hacen con una frecuencia que depende de la concentración, es decir, del número de ellas que están concentradas en la unidad de volumen; número que podemos calcular conociendo la presión y temperatura de la masa de gas confinada en un volumen conocido.

Decía que no existen fuerzas entre las moléculas de un gas. En realidad, es más exacto que el valor de esas fuerzas es insignificante porque las fuerzas residuales de las electromagnéticas, a las que antes me referí, disminuyen más rápidamente con la distancia que las fuerzas de Coulomb; y esta distancia es ordinariamente de varios diámetros moleculares.
Podemos conseguir que la intensidad de esas fuerzas aumente tratando de disminuir la distancia media entre las moléculas. Esto se puede lograr haciendo descender la temperatura, aumentando la presión o ambas cosas. Alcanzada una determinada temperatura, las moléculas comienzan a sentir las fuerzas de Van der Waals y aparece el estado líquido; si se sigue enfriando aparece el sólido. El orden crece desde el gas al líquido, siendo el sólido el más ordenado. Se trata de una red tridimensional en la que los nudos o vértices del entramado están ocupados por moléculas.
Todas las sustancias conocidas pueden presentarse en cualquiera de los tres estados de la materia (estados ordinarios y cotidianos en nuestras vidas del día a día).
Si las temperaturas reinantes, como decíamos en páginas anteriores, es de miles de millones de grados, el estado de la materia es el plasma, el material más común del Universo, el de las estrellas (aparte de la materia oscura, que no sabemos ni lo que es, ni donde está, ni que “estado” es el suyo).
En condiciones ordinarias de presión, la temperatura por debajo de la cual existe el líquido y/o sólido depende del tipo de sustancia. Se denomina temperatura de ebullición o fusión la que corresponde a los sucesivos equilibrios(a presión dada) de fases: vapor <-> líquido <-> sólido. Estas temperaturas son muy variadas. Por ejemplo, para los gases nobles son muy bajas; también para el oxígeno (O2) e hidrógeno (H2). En cambio, la mayoría de las sustancias son sólidos en condiciones ordinarias (grasas, ceras, etc.)
Las sustancias pueden ser simples y compuestas, según que la molécula correspondiente tenga átomos iguales o diferentes. El número de las primeras es enormemente inferior al de las segundas.

El concepto de molécula, como individuo-físico y químico, pierde su significado en ciertas sustancias que no hemos considerado aun. Entre ellas figuran las llamadas sales, el paradigma de las cuales es la sal de cocina. Se trata de cloruro de sodio, por lo que cualquier estudiante de E.G.B. escribiría sin titubear, su fórmula: Cl Na. Sin embargo, le podríamos poner en un aprieto si le preguntásemos donde se puede encontrar aisladamente individuos moleculares que respondan a esa composición. Le podemos orientar diciéndole que en el gas Cl H o en el vapor de agua existen moléculas como individualidades. En realidad y salvo casos especiales, por ejemplo, a temperaturas elevadas, no existen moléculas aisladas de sal, sino una especie de molécula gigante que se extiende por todo el cristal. Este edificio de cristal de sal consiste en una red o entramado, como un tablero de ajedrez de tres dimensiones, en cuyos nudos o vértices se encuentran, alternativamente, las constituyentes, que no son los átomos de Cl y Na sino los iones Cl– y Na+. El primero es un átomo de Cl que ha ganado un electrón, completándose todos los orbitales de valencia; el segundo, un átomo de Na que ha perdido el electrón del orbital s.

Cuando los átomos de Cl y Na interaccionan por aproximarse suficientemente sus nubes electrónicas, existe un reajuste de cargas, porque el núcleo de Cl atrae con más fuerza los electrones que el de Na, así uno pierde un electrón que gana el otro. El resultado es que, la colectividad de átomos se transforma en colectividad de iones, positivos los de Na y negativos los de Cl. Las fuerzas electromagnéticas entre esos iones determinan su ordenación en un cristal, el ClNa. Por consiguiente, en los nudos de la red existen, de manera alternativa, iones de Na e iones de Cl, resultando una red mucho más fuerte que en el caso de que las fuerzas actuantes fueran de Van der Waals. Por ello, las sales poseen puntos de fusión elevados en relación con los de las redes moleculares.
Hablemos de cuerpos.

Me referiré en primer lugar a los que constituyen nuestro entorno ordinario, que sería todo el entorno que abarca nuestro planeta. En segundo lugar considerare los demás cuerpos y objetos del Universo. El análisis de muestras de esos diversos cuerpos ha puesto de manifiesto que, en función de la composición, los cuerpos pueden ser simples y compuestos. Los primeros son, precisamente, los llamados elementos químicos, a las que el insigne Lavoisier (conocido como padre de la Química), consideró como el último término a que se llega mediante la aplicación del análisis químico.
Hoy sabemos que son colectividades de átomos isotópicos.
La mayoría de ellos son sólidos y se encuentran en la Naturaleza (nuestro entorno terráqueo) en estado libre o en combinación química con otros elementos, formando los diversos minerales.
La ordenación de los iones en las redes se manifiesta externamente en multitud de formas y colores. No obstante, debo señalar que, aun siendo abundante esta variedad, no es tan rica como la que corresponde a los cuerpos vivos, tanto animales como vegetales. La explicación se basa en que el número de especimenes moleculares y su complejidad son mucho mayores que en el reino inorgánico.
Sería conveniente, salir al paso de una posible interpretación errónea. Me refiero a que pudiera pensarse que los reinos que acabamos de mencionar constituyen clases disyuntas, esto es, sin conexión mutua. Y no lo digo porque esté considerando el hecho de que el carbono forma compuestos inorgánicos y orgánicos (lo que también hace el silicio), sino porque haya existido, y aún pueda existir, una conclusión, mejor conexión evolutiva del mundo inorgánico y el viviente que no se puede descartar, de hecho, yo particularmente, estoy seguro de ello. Estamos totalmente conectados con los ríos, las montañas y los valles, con la tierra que pisamos, el aire que respiramos y con todo el resto del Universo del que formamos parte.

La teoría de Cairos Swith considera que el eslabón entre ambos mundos se halla localizado en los microcristales de arcilla. Mi teoría particular es que no hay eslabón perdido en dicha conexión, sino que es el tiempo el que pone, en cada momento, una u otra materia en uno u otro lugar. Ahora, nos ha tocado estar aquí como ser complejo, pensante y sensitivo. El eón que viene nos puede colocar formando parte de un enorme árbol, de un monte, o, simplemente estar reposando como fina arena en el lecho de un río. Sin dudarlo, J. M. y P. formarán parte de un hermoso jardín perfumado y lleno de aromas que la brisa regalará a los que pasen cerca de allí.
El granito, por ejemplo, consiste básicamente en una mezcla de tres cuerpos compuestos: cuarzo, mica y feldespato. ¿Quién puede decir hoy lo que seremos mañana?

En todos los cuerpos que hemos estado considerando hasta ahora, las moléculas, los átomos o los iones se hallan situados en los nudos de la correspondiente red, así que, los electrones de esos individuos se encuentran también localizados en el entorno inmediato de esos lugares. Podríamos decir que la densidad electrónica es una función periódica espacial, lo que significa que al recorrer la red siguiendo una determinada dirección irían apareciendo altibajos, es decir, crestas y valles de la densidad electrónica.
La estructura de los cuerpos metálicos, así como las aleaciones, merecen una consideración especial. La estructura de los metales y aleaciones difiere de la de los demás cuerpos en un aspecto muy importante que consideraré a continuación.

Supongamos, para fijar las ideas, que tenemos un trozo de plata metálica pura. En los nudos de la red correspondientes los átomos han perdido su electrón de …
Me refiero a que en los cuerpos metálicos existe una deslocalización de los electrones que están menos fuertemente enlazados en los correspondientes núcleos, es decir, de los electrones de valencia.
Vamos a precisar un poco. Supongamos, para fijar las ideas, que tenemos un trozo de plata metálica pura. En los nudos de la red correspondientes los átomos han perdido su electrón de valencia, pero ocurre que cada uno de estos electrones forma una colectividad que se halla desparramada o dispersa por todo el sólido. Una primera imagen de esta situación fue establecida por el gran físico italiano Enrico Fermi, por lo que se habla de un gas electrónico, llamado también de Fermi, que llenaría los espacios libres, es decir, no ocupados por los iones metálicos.
Este gas electrónico es el responsable de las propiedades metálicas, tales como el brillo, conductibilidades eléctrica y térmica, etc. La aplicación de la mecánica cuántica a la descripción del estado metálico conduce a la obtención del mapa de la densidad electrónica, o, como decía antes, a las características de la información correspondiente.
Sin entrar en detalles que desviarían nuestra atención hacia otros conceptos fuera de los límites de lo que ahora estoy pretendiendo, utilizaré el mismo lenguaje que para las estructuras de núcleos y átomos.

Recordemos que en la sociedad de los nucleones y electrones existen las relaciones verticales y las de estratificación, que se manifiestan en las capas y subcapas. En el caso de los metales tendríamos una colectividad de núcleos, arropados con sus capas cerradas, ocupando los nudos de la red; únicamente los electrones de valencia de cada átomo forman la colectividad del gas electrónico.
La pregunta que nos debemos hacer es: ¿estos electrones, en número igual, por lo menos, al de los átomos, se hallan estratificados? La respuesta es que sí. Existe una estratificación de estos electrones en las llamadas bandas. El concepto de banda energética resulta de la consideración simultánea de dos aspectos: la cuantización energética (o la estratificación de los niveles energéticos en los átomos) y el grandísimo número de electrones existentes. Este colectivo no podría ubicarse en un número finito y escaso de niveles. Esta dificultad queda soslayada si se admite que cada uno de esos niveles atómicos de los N átomos que forman el cuerpo se funde en otros tantos niveles de cierta anchura donde ya pueden alojarse los electrones disponibles.

Esa fusión de los niveles atómicos da lugar a las bandas. Esta imagen equivaldría a considerar un metal como un átomo gigante en el que los niveles energéticos poseyeran una anchura finita.
En cuanto a la información que puede soportar un metal, podríamos señalar que sería parecida a la del correspondiente átomo, pero mucha más extendida espacialmente. Una información puntual, la del átomo, daría paso a otra espacial, si bien vendría a ser una mera repetición periódica de aquella.
¿Y los cuerpos que pueblan el resto del Universo?
Cuando un cuerpo sobrepasa unas determinadas dimensiones, aparece algo que conocemos como fuerza gravitatoria y que se deja sentir en la forma que todos conocemos y, que da lugar, primeramente a la fusión de los diversos materiales que forman los cuerpos.
Así, por ejemplo, en el cuerpo que llamamos Tierra, la presión crece con la profundidad, por lo que, a partir de un determinado valor de ésta, aparece el estado líquido y con él una estratificación que trata de establecer el equilibrio hidrostático.
Dentro de nuestro sistema planetario se distinguen los planetas rocosos, hasta Marte y meteoritos inclusive, y el resto de ellos, desde Júpiter en adelante, incluido este. Estos últimos difieren esencialmente de los primeros en su composición. Recuérdese que la de Júpiter es mucho más simple que la de los planetas rocosos. Consta fundamentalmente de hidrógeno, helio, agua, amoniaco y metano, con un núcleo rocoso en su interior. El hidrógeno que rodea a este núcleo se encuentra en forma de hidrógeno atómico sólido.

También la composición del Sol (y todas las estrellas que brillan) es más simple que la de los planetas rocosos, su estado físico es el de plasma y su contenido está reducido (mayormente) a hidrógeno y helio. Mas variedad de materiales existe en las estrellas supernovas, donde el primitivo hidrógeno ha evolucionado de la manera que expliqué en otra parte de este trabajo.
En cuanto a los derechos de la evolución estelar, enanas blancas, estrellas de neutrones y agujeros negros, señalaré que la composición de la primera es sencilla en cuanto al numero de “elementos” constituyentes; la segunda ya lo indica su propio nombre, constan de nucleones, particularmente neutrones que están fuertemente empaquetados (muy juntos) por la gravedad. Una estrella de neutrones puede tener una densidad superior a la del agua, en millones de veces y del mismo orden que la de los núcleos atómicos. El agujero negro, es un fenómeno aparte, su inmensa fuerza gravitatoria es tal que, ni la luz puede escapar de ella, es decir, su velocidad de escape es superior a 300.000 km/s, y, como según la relatividad, nada es en nuestro Universo, superior en velocidad, a la luz, resulta que nada podrá escapar de un agujero negro.
Allí dentro, en el interior del agujero negro, no existen ni el tiempo ni el espacio, es como un objeto que estando en nuestro Universo (deja sentir su fuerza gravitatoria y engulle estrellas), al mismo tiempo, no está aquí. Son muchas las cosas que aún nos queda por dedcubrir.
emilio silvera
Ene
24
Plasma, Nebulosas, Gases, elementos, moléculas.
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Alquimia estelar ~
Clasificado en Alquimia estelar ~
 Comments (0)
Comments (0)
Plasma, ese otro estado de la Materia (el cuarto dicen) que, según sabemos, resulta ser el más abundante del Universo. Todos desde pequeños aprendimos aquellos tres estados de la materia que cantábamos en el patio del centro educativo durante el recreo, donde todos a una gritábamos como papagayos: “Sólido, líquido y gaseoso”. Nada nos decían del Plasma, ese estado que, en realidad, cubre el 99% del estado de la materia en nuestro Universo (bueno, hablamos de la materia conocida, esa que llamamos bariónica y está formada por átomos de Quarks y Leptones). Sospecho que hay otros estados de la materia que nos son desconocidos.

Filamentos de plasma en los remanentes de Supernovas
Según la energía de sus partículas, los plasmas (como digo) constituyen el cuarto estado de agregación de la materia, tras los sólidos, líquidos y gases. Para cambiar de uno al otro, es necesario que se le aporte energía o que disminuya o aumente la temperatura. Si aumentamos de manera considerable la temperatura de un gas, sus átomos o moléculas adquieren energía suficiente para ionizarse al chocar entre sí. de modo que a ~ 20.000 K muchos gases presentan una ionización elevada. Sin embargo, átomos y moléculas pueden ionizarse también por impacto electrónico, absorción de fotones, reacciones químicas o nucleares y otros procesos.

Aquí podemos contemplar una enorme región ionizada en la Nebulosa del Pelícano. Estrellas nuevas emiten potente radiación ultravioleta que ataca el espesor de la Nebulosa molecular y hace que, el gas se ionice fuertemente creando una luminosidad que “viste” de azul claro todo el contorno que circunda el radio de acción de las estrellas.

Un plasma es un gas muy ionizado, con igual número de cargas positivas y negativas. Las cargas otorgan al Plasma un comportamiento colectivo, por las fuerzas de largo alcance existente entre ellas. En un gas, cada partícula, independientemente de las demás, sigue una trayectoria rectilínea, hasta chocar con otra o con las grandes paredes que la confinan. En un plasma, las cargas se desvían atraídas o repelidas por otras cargas o campos electromagnéticos externos, ejecutando trayectorias curvilíneas entre choque y choque. Los gases son buenos aislantes eléctricos, y los plasmas, buenos conductores.

En la Tierra, los plasmas no suelen existir en la naturaleza, salvo en los relámpagos, que son trayectorias estrechas a lo largo de las cuales las moléculas de aire están ionizadas aproximadamente en un 20%, y en algunas zonas de las llamas. Los electrones libres de un metal también pueden ser considerados como un plasma. La mayor parte del Universo está formado por materia en estado de plasma. La ionización está causada por las elevadas temperaturas, como ocurre en el Sol y las demás estrellas, o por la radiación, como sucede en los gases interestelares o en las capas superiores de la atmósfera (ver trabajo más abajo), donde produce el fenómeno denominado aurora.

En aquellos primeros momentos el plasma era lo que prevalecía como materia cósmica primera
“Las partículas del gas no tienen tiempo de recombinarse. La presencia de partículas ionizadas (electrones, protones) se da en el espacio, por ejemplo. –O sea que el universo es un plasma. –El 99,99 por ciento de la materia visible del universo está en estado de plasma: el Sol, las estrellas, la materia interestelar…”
Así que, aunque escasos en la Tierra, el Plasma constituye la materia conocida más abundante del Universo, más del 99%. Abarcan desde altísimos valores de presión y temperatura, como en los núcleos estelares, hasta otros asombrosamente bajos en ciertas regiones del espacio. Uno de sus mayores atractivos es que emiten luz visible, con espectros bien definidos, particulares en cada especie. Algunos objetos radiantes, como un filamento incandescente, con espectro continuo similar al cuerpo negro, o ciertas reacciones químicas productoras de especies excitadas, no son plasmas, sin embargo, lo son la mayoría de los cuerpos luminosos.

Bombilla de incandescencia
Los Plasmas se clasifican según la energía media (o temperatura) de sus partículas pesadas (iones y especies neutras). Un primer tipo son los Plasmas calientes, prácticamente ionizados en su totalidad, y con sus electrones en equilibrio térmico con las partículas más pesadas. Su caso extremo son los Plasmas de Fusión, que alcanzan hasta 108 K, lo que permite a los núcleos chocar entre sí, superando las enormes fuerzas repulsivas inter-nucleares, y lograr su fusión. Puede producirse a presiones desde 1017 Pa, como en los núcleos estelares, hasta un Pa, como en los reactores experimentales de fusión.
Alcator C-Mod tokamak | Research | MIT Plasma Science and Fusion Center

Los reactores de fusión nuclear prácticos están ahora un poco más cerca de la realidad gracias a nuevos experimentos con el reactor experimental Alcator C-Mod del MIT. Este reactor es, de entre todos los de fusión nuclear ubicados en universidades, el de mayor rendimiento en el mundo.
Los nuevos experimentos han revelado un conjunto de parámetros de funcionamiento del reactor, lo que se denomina “modo” de operación, que podría proporcionar una solución a un viejo problema de funcionamiento: cómo mantener el calor firmemente confinado en el gas caliente cargado (llamado plasma) dentro del reactor, y a la vez permitir que las partículas contaminantes, las cuales pueden interferir en la reacción de fusión, escapen y puedan ser retiradas de la cámara.
Otros Plasmas son los llamados térmicos, con e ~lectrones y especies pesadas en equilibrio, pero a menor temperatura ~ 103 – 104 K, y grados de ionización intermedios, son por ejemplo los rayos de las tormentas o las descargas en arcos usadas en iluminación o para soldadura, que ocurren entre 105 y ~ 102 Pa. Otro tipo de Plasma muy diferente es el de los Plasmas fríos, que suelen darse a bajas presiones ( < 102 Pa), y presentan grados de ionización mucho menores ~ 10-4 – 10-6. En ellos, los electrones pueden alcanzar temperaturas ~ 105 K, mientras iones y neutros se hallan a temperatura ambiente. Algunos ejemplos son las lámparas de bajo consumo y los Plasmas generados en multitud de reactores industriales para producción de películas delgadas y tratamientos superficiales.
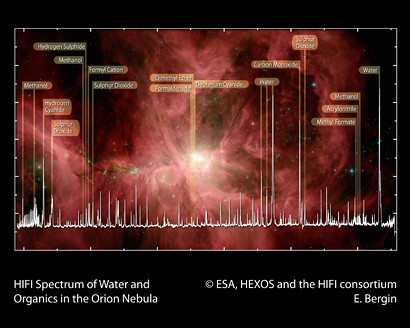
El Observatorio Espacial Herschel de la ESA ha puesto de manifiesto las moléculas orgánicas que son la llave para la vida en la Nebulosa de Orión, una de las regiones más espectaculares de formación estelar en nuestra Vía Láctea. Este detallado espectro, obtenido con el Instrumento Heterodino para el Infrarrojo Lejano (Heterodyne Instrument for the Far Infrared, HIFI) es una primera ilustración del enorme potencial de Herschel-HIFI para desvelar los mecanismos de formación de moléculas orgánicas en el espacio. Y, para que todo eso sea posible, los Plasmas tienen que andar muy cerca.
En los Plasmas calientes de precursores moleculares, cuanto mayor es la ionización del gas, más elevado es el grado de disociación molecular, hasta poder constar solo de electrones y especies atómicas neutras o cargadas; en cambio, los Plasmas fríos procedentes de especies moleculares contienen gran proporción de moléculas y una pequeña parte de iones y radicales, que son justamente quienes proporcionan al Plasma su característica más importante: su altísima reactividad química, pese a la baja temperatura.
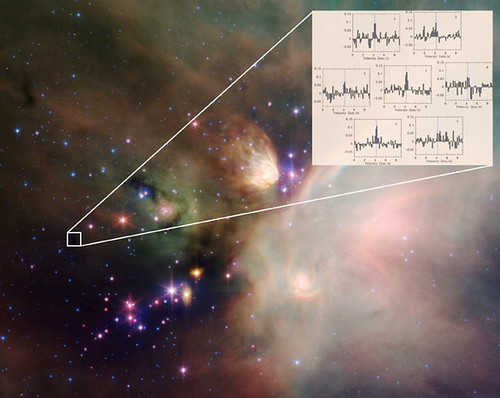
En la Naturaleza existen Plasmas fríos moleculares, por ejemplo, en ciertas regiones de las nubes interestelares y en las ionosfera de la Tierra y otros planetas o satélites. Pero también son producidos actualmente por el ser humano en gran variedad para investigación y multitud de aplicaciones.
En un número de la Revista Española de Física dedicado al vacío, el tema resulta muy apropiado pues no pudieron generarse Plasmas estables en descargas eléctricas hasta no disponer de la tecnología necesaria para mantener presiones suficientemente bajas; y en el Universo, aparecen Plasmas fríos hasta presiones de 10 ⁻ ¹⁰ Pascales, inalcanzable por el hombre.
Lo que ocurre en las Nubes moleculares es tan fantástico que, llegan a conseguir los elementos necesarios para la vida prebiótica que, más tarde situados en el planeta y ambiente adecuados, tras cumplirse las reglas y cubrir los parámetros adecuados, dan lugar al surgir de la vida.
El papel de las moléculas en Astronomía se ha convertido en un área importante desde el descubrimiento de las primeras especies poliatómicas en el medio interestelar. Durante más de 30 años, han sido descubiertas más de 150 especies moleculares en el medio interestelar y gracias al análisis espectral de la radiación. Muchas resultan muy exóticas para estándares terrestres (iones, radicales) pero buena parte de estas pueden reproducirse en Plasma de Laboratorio. Aparte del interés intrínseco y riqueza de procesos químicos que implican, estas especies influyen en la aparición de nuevas estrellas por su capacidad de absorber y radiar la energía resultante del colapso gravitatorio, y de facilitar la neutralización global de cargas, mucho más eficientemente que los átomos.

Su formación en el espacio comienza con la eyección de materia al medio interestelar por estrellas en sus últimas fases de evolución y la transformación de éstas por radiación ultravioleta, rayos cósmicos y colisiones; acabando con su incorporación a nuevas estrellas y Sistemas planetarios, en un proceso cíclico de miles de millones de años.

En las explosiones supernovas se producen importantes transformaciones en la materia que, de simple se transforma en compleja y dan lugar a todas esas nuevas especies de moléculas que nutren los nuevos mundos en los que podemos encontrar elementos como el oro y el platino que han sido creados en sucesos de una magnitud aterradora donde las fuerzas desatadas del Universo han quedado sueltas para transformarlo todo.
El H₂ y otras moléculas diatómicas homo-nucleares carecen de espectro rotacional. Detectando las débiles emisiones cuadru-polares del H₂ en infrarrojo, se ha estimado una proporción de H₂ frente a H abrumadoramente alto ( ~ 104) en Nubes Interestelares con densidades típicas de ~ 104 partículas /cm3; pero dada la insuficiente asociación radiactiva del H para formar H2, ya mencionada, el H2 debe producirse en las superficies de granos de polvo interestelar de Carbono y Silicio, con diámetros ~ 1 nm — μm, relativamente abundantes en estas nubes.

Experimentos muy recientes de desorción programada sobre silicatos ultra-fríos, demuestran que tal recombinación ocurren realmente vía el mecanismo de Langmuir-Hinshelwood, si bien los modelos que expliquen las concentraciones de H2 aún deben ser mejorados.
Por otro lado, ciertas regiones de las nubes en etapas libres de condensación estelar presentan grados de ionización ~ 10-8 – 10-7 a temperaturas de ~ 10 K. La ionización inicial corresponde principalmente al H2 para formar H2 +, que reacciona eficientemente con H2, dando H3 + + H (k = 2• 10-9 cm3 • s-1.
El H3, de estructura triangular, no reacciona con H2 y resulta por ello muy “estable” y abundante en esas regiones de Nebulosas intelestelares, donde ha sido detectado mediante sus absorciones infrarrojas caracterizadas por primera vez en 1980 en descargas de H2 en Laboratorio.
La constelación de Orión contiene mucho más de lo que se puede ver, ahí están presentes los elementos que como el H2 que venimos mencionando, tras procesos complejos y naturales llegan a conseguir otras formaciones y dan lugar a la parición de moléculas significativas como el H2O o HCN y una gran variedad de Hidrocarburos, que podrían contribuir a explicar en un futuro próximo, hasta el origen de la vida.

La detección por espectroscopia infrarroja de COH+ y N2H+, formados en reacciones con H3 + a partir de CO y N2, permite estimar la proporción de N2/CO existente en esas regiones, ya que el N2 no emite infrarrojos. Descargas de H2 a baja presión con trazas de las otras especies en Laboratorio conducen casi instantáneamente a la aparición de tales iones y moléculas, y su caracterización puede contribuir a la comprensión de este tipo de procesos.
Así amigos míos, hemos llegado a conocer (al menos en parte), algunos de los procesos asombrosos que se producen continuamente en el Espacio Interestelar, en esa Nebulosas que, captadas por el Hubble u otros telescopios, miramos asombrados maravillándonos de sus colores que, en realidad, llevan mensajes que nos están diciendo el por qué se producen y que elementos son los causantes de que brillen deslumbrantes cuando la radiación estelar choca de lleno en esas nubes en la que nacen las estrellas y los nuevos mundos…y, si me apurais un poco, también la vida.
emilio silvera
Jul
18
¡Los Elementos!
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Alquimia estelar ~
Clasificado en Alquimia estelar ~
 Comments (1)
Comments (1)
Ya he escrito en otras ocasiones sobre el gran astrofísico Fred Hoyle , que tenía un dominio de la física nuclear no superado entre los astrónomos, hombre de espíritu independiente, que por pura energía intelectual se había abierto camino desde los grises valles del norte de Inglaterra hasta llegar a ser un distinguido profesor de Cambridgue. Hoyle era individualista hasta el punto de la iconoclasia, y tam combativo como si hubiese ganado luchando su título de sir. Sus clases eran carismáticas, con acento de clase obrera que parecía ahondar sus credenciales eruditas acumuladas, y era igualmente eficaz con la palabra escrita; publicaba penetrante artículos especializados, fascinantes obras de divulgación ciantífica y animadas narraciones de ciencia-ficción en la que encontraba una puerta de escape para exponer ideas avanzadas que, científicamente, no estaban contrastadas.

SIR FRED HOYLE
Su burla era temible y sus críticas de la teoría del big bang hizo época por su mordacidad. Hoyle condenó la teoría por considerarla epistemológicamente estéril, ya que parecía poner una limitación temporal inviolable a la indagación científica: el big bang era una muralla de fuego, más allá de la cual la ciencia de la çepoca no sabía como investigar. Él no concebía y juzgó “sumamente objetable que las leyes de la física nos condujeran a una situación en la que se nos prohíbe calcular que ocurrió en cierto momento del tiermpo”. En aquel momento, no estaba falto de razón.

Pero no es ese el motivo de este trabajo, ya os decía antes que Hoyle tenía un dominio de la física nuclear nunca superado entre los astrónomos de su generación, había empezado a trabajar en la cuestión de las reacciones de la fusión estelar a mediado de los cuarenta. Pero había publicado poco, debido a una batalla continua con los “arbitros”, colegas anónimos que leían los artículos y los examinaban para establecer su exactitud, cuya hostilidad a las ideas más innovadoras de Hoyle hizo hizo que éste dejara de presentar sus trabajos a los periódicos. Hoyle tuvo que pagar un precio por su rebeldía, cuando, en 1951, mientras él, permanecía obstinadamente entre bastidores, Ernest Opik y Edwin Sepeter hallaron la síntesis en las estrellas de átomos desde el Berilio hasta el Carbono. Lamentando la perdida, Hoyle rompió entonces su silencio y en un artículo de 1954 demostró como las estrellas gigantes rojas podían corvertir Carbono en Oxígeno 16.
 |
| El tamaño variable de S Orionis comparado con el Sistema Solar interior. La gigante roja pulsa desde el disco amarillo hasta el disco rojo interior. En 5 mil millones de años el Sol evolucionará a esta etapa antes de enfriarse como enana blanca. Las distancias están a escala, aunque los diámetros del Sol, planetas y puntos máser (en rojo y verde) no lo están. : ESO |
Quedaba aún el obstáculo insuperable del hierro. El hierro es el más estable de todos los elementos; fusionar núcleos de hierro para formar nucleos de un elemento más pesado consume energía en vez de liberarla; ¿cómo, pues, podían las estrellas efectuar la fusión del hierro y seguir brillando? Hoyle pensó que las supernovas podían realizar la tarea, que el extraordinario calor de una estrella en explosión podía servir para forjar los elementos más pesados que el hierro, si el de una estrella ordinaria no podía. Pero no lo pido probar.
Luego, en 1956, el tema de la producción estelar de elementos recibió nuevo ímpetu cuando el astrónomo norteamerciano Paul Merril identificó las reveladoras líneas del Tecnecio 99 en los espectros de las estrellas S. El Tecnecio 99 es más pesado que el hierro. También es un elemento inestable, con una vida media de sólo 200.000 años. Si los átomos de Tecnecio que Merril detectó se hubiesen originado hace miles de millones de años en el big bang, se habrían desintegrado desde entonces y quedarían hoy muy pocos de ellos en las estrellas S o en otras cualesquiera. Sin emabrgo, allí estaban. Evidentemente, las estrellas sabían como construir elementos más allá del hierro, aunque los astrofísicos no lo supiesen.

Las estrellas de tecnecio son estrellas cuyo espectro revela la presencia del elemento tecnecio. Las primeras estrellas de este tipo fueron descubiertas en 1952, proporcionando la primera prueba directa de la nucleosíntesis estelar, es decir, la fabricación de elementos más pesados a partir de otros más ligeros en el interior de las estrellas. Como los isótopos más estables de tecnecio tienen una vida media de sólo un millón de años, la única explicación para la presencia de este elemento en el interior de las estrellas es que haya sido creado en un pasado relativamente reciente. Se ha observado tecnecio en algunas estrellas M, estrellas MS, estrellas MC, estrellas S, y estrellas C.
Estimulado por el descubrimiento de Merril, Hoyle reanudó sus investigaciones sobre la nucleosíntesis estelar. Era una tarea que se tomó muy en serio. De niño, mientras se ocultaba en lo alto de una muralla de piedra jugando al escondite, miró hacia lo alto, a las estrellas, y resolvió descubrior qué eran, y el astrofísico adulto nunca olvidó su compromiso juvenil. Cuando visitó el California Institute Of Technology, Hoyle estuvo en compañía de Willy Fowler, un miembro residetente de la facultad con un conocimiento enciclopédico de la física nuclear, y Geoffrey y Margaret Burbidge, un talentoso equipo de marido y mujer que, como Hoyle, eran excépticos ingleses en la relativo al big bang.
Hubo un cambio cuando Geoffrey Burbidge, examinando datos a los que recientemente se había eximido de las normas de seguridad de una prueba atómica en el atolón Bikini, observó que la vida media de uno de los elementos radiactivos producidos por la explosión, el californio 254, era de 55 días. Esto sonó familiar: 55 días era justamente el período que tardó en consumirse una supernova que estaba estudiando Walter Baade. El californio es uno de los elementos más pesados; si fuese creado en el intenso calor de estrellas en explosión, entonces, suguramente los elementos situados entr el hierro y el californio -que comprenden, a fin de cuentas, la mayoría de la Tabla Periódica- también podrían formarse allí. Pero ¿cómo?.


Las estrellas que son unas ocho veces más masivas que el Sol representan sólo una fracción muy pequeña de las estrellas en una galaxia espiral típica. A pesar de su escasez, estas estrellas juegan un papel importante en la creación de átomos complejos y su dispersión en el espacio.
Elementos necesarios como carbono, oxígeno, nitrógeno, y otros útiles, como el hierro y el aluminio. Elementos como este último, que se cocinan en estas estrellas masivas en la profundidad de sus núcleos estelares, puede ser gradualmente dragado hasta la superficie estelar y hacia el exterior a través de los vientos estelares que soplan impulsando los fotones. O este material enriquecido puede ser tirado hacia afuera cuando la estrella agota su combustible termonuclear y explota. Este proceso de dispersión, vital para la existencia del Universo material y la vida misma, puede ser efectivamente estudiado mediante la medición de las peculiares emisiones radiactivas que produce este material. Las líneas de emisión de rayos gamma del aluminio, que son especialmente de larga duración, son particularmente apreciadas por los astrónomos como un indicador de todo este proceso. El gráfico anterior muestra el cambio predicho en la cantidad de un isótopo particular de aluminio, Al26, para una región de la Vía Láctea, que es particularmente rica en estrellas masivas. La franja amarilla es la abundancia de Al26 para esta región según lo determinado por el laboratorio de rayos gamma INTEGRAL. La coincidencia entre la abundancia observada y la predicha por el modelo re-asegura a los astrónomos de nuestra comprensión de los delicados lazos entre la evolución estelar y la evolución química galáctica.
Pero sigamos con la historia recorrida por Hoy y sus amigos. Felizmente, la naturaleza proporcionó una piedra Rosetta con la cual Hoyle y sus colaboradores podían someter a prueba sus ideas, en la forma de curva cósmica de la abundancia. Ésta era un gráfico del peso de los diversos átomos -unas ciento veinte especies de núcleos, cuando se tomaban en cuanta los isótopos- en función de su abundancia relativa en el universo, establecido por el estudio de las rocas de la Tierra, meteoritos que han caido en la Tierra desde el espacio exterior y los espectros del Sol y las estrellas.

El deslumbrante brillo delata la presencia de la Supernova en una galaxia
Supernova que calcina a un planeta cercano. Ahí, en esa explosión se producen transiciones de fase que producen materiales pesados y complejos.n En una supernova, en orden decreciente tenemos la secuencia de núcleos H, He, O, C, N, Fe, que coincide bastante bien con una ordenación en la tabla periódica que es: H, He, (Li, Be, B) C, N, O… Fe.
¿Apreciáis la maravilla?
Las estrellas brillan en el cielo para hacer posible que nosotros estemos aquí descubriendo los enigmas del universo y… de la vida inteligente. Esos materiales para la vida sólo se pudieron fabricar el las estrellas, en sus nucleares y en las explosiones supernovas al final de sus vidas. Esa era la meta de Hoyle, llegar a comprender el proceso y, a poder demostrarlo.
“El problema de la síntesis de elementos -escribieron- está estrechamente ligado al problema de la evolcuión estelar.” La curva de abundancia cósmica de elementos que mostraba las cantidades relativas de las diversas clases de átomos en el universo a gran escala. Pone ciertos límites a la teoría de cómo se formaron los elementos, y, en ella aparecen por orden creciente:
En las distintas secuencias presentes en las estrrellas… dintintos elementos
Hidrógeno, Helio, Carbono, Litio, Berilio, Boro, Oxígeno, Neón, Silicio, Azufre, Hierro (damos un salto), Plomo, Torio y Uranio. Las diferencias de abundancias que aparecen en el gráfico son grandes -hay, por ejemplo, dos millones de átomos de níquel por cada cuatro átomos de plata y cincuenta de tunsgteno en la Via Láctea- y por consiguiente la curva e abundancia presenta una serie de picos dentados más accidentados que que la Cordillera de los Andes. Los picos altos corresponden al Hidrógeno y al Helio, los átomos creados en el big bang -más del p6 por ciento de la materia visible del universo- y había picos menores pero aún claros para el Carbono, el Oxígeno, el Hierro y el Plamo. La acentuada claridad de la curva ponía límites definidos a toda teoría de la síntesis de elementos en las estrellas. Todo lo que era necesario hacer -aunque dificultoso) era identificar los procesos por los cuales las estrellas habían llegado preferentemente a formar algunos de los elementos en cantidades mucho que otros. Aquí estaba escrita la genealogía de los átomos, como en algún jeroglífico aún no traducido: “La historia de la materia éscribió Hoyle, Fwler y los Burbidge_…está oculta en la distribuciíon de la anundancia de elementos”
En el Big Bang: Hidrógeno, Helio, Litio.
En las estrellas de la serie principal: Carbono, Nitrógeno, Oxígeno.
En las estrellas moribundas: Sodio, Magnesio, Aluminio, Silicio, Azufre, Cloro, Argón, Potasio, Titanio, Hierro, Cobalto, Níquel, Cobre, Cinc, Plomo, Torio y Uranio.
Como habeis podido comprobar, nada sucede por que sí, todo tiene una explicación satisfactoria de lo que, algunas veces, decimos que son misterios escondidos de la Naturaleza y, sin embargo, simplemente se trata de que, nuestra ignorancia, no nos deja llegar a esos niveles del saber que son necesarios para poder explicar algunos fenómenos naturales que, exigen años de estudios, observaciones, experimentos y, también, mucha imaginación.
emilio silvera
Jul
1
Las moléculas portadoras de información
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Alquimia estelar ~
Clasificado en Alquimia estelar ~
 Comments (1)
Comments (1)

El ADN transporta la información que nos habla del pasado y dekl origen
Mediante el estudio y la observación se pudo comprobar que la cantidad de ADN era la misma para todas las células somáticas de los individuos de una determinada especie, mientras que los gametos sólo tenían la mitad. Así mismo, los estudios de Erwin Chargaff sobre las similitudes en las proporciones de bases nitrogenadas presentes en el ADN de los individuos de la misma especie parecían confirmar la relación existente entre esta molécula y la información genética.
La prueba definitiva fue obtenida en 1952 por Alfred Hershey y Martha Chase, quienes demostraron de forma concluyente que el ADN, y no una proteína, era el material genético del bacteriófago T2. Al año siguiente, James Watson y Francis Crick elaboraron su famoso modelo de doble hélice 
Representación esquemática de la molécula de ADN, la molécula portadora de la información genética. Las moléculas se forman por la Asociación de dos o más átomos, que se mantienen juntas por medio de enlaces químicos. Podríamos decir que algunas moléculasd de vida serían:



– Agua.
– Hidratos de carbono.
– Lípidos.
– Proteínas.
– Acidos Nucleicos.



Principios inmediatos o biomoléculas: una de las sustancias que componen la materia viva.
– Simples: O2
– inorgánicos: agua…
– Compuestos:
– orgánicos: glúcidos, lípidos,
proteínas, ac. nucleicos
La enorme variedad de formas, colores, comportamientos, etc que acompaña a los objetos, incluidos los vivientes, sería una consecuencia de la riqueza en la información que soportan las moléculas (y sus agregados) que forman parte de dichos objetos. Ello explicaría que las moléculas de la vida sean en general de grandes dimensiones (macromoléculas). La inmensa mayoría de ellas contiene carbono. Debido a su tetravalencia y a la gran capacidad que posee dicho átomo para unirse consigo mismo, dichas moléculas pueden considerarse un esqueleto formado por cadenas de esos átomos.

El carbono no es el único átomo con capacidad para formar los citados esqueletos. Próximos al carbono en la tabla periódica, el silicio, fósforo y boro comparten con dicho átomo esa característica, si en un grado mucho menor. Refiriéndonos al silicio, señalaremos que las “moléculas” que dicho átomo forma con el oxígeno y otros átomos, generalmente metálicos poseyendo gran nivel de información, difieren en varios aspectos de las moléculas orgánicas, es decir, de las que poseen un esqueleto de átomos de carbono.

El mundo de los silicatos es de una gran diversidad, existiendo centenares de especies minerológicas. Esas diferencias se refieren fundamentalmente a que el enlace químico en el caso de las moléculas orgánicas es covalente, y cuando se forma la sustancia correspondiente (cuatrillones de moléculas) o es un líquido, como es el caso de los aceites, o bien un sólido que funde fácilmente. Entre las moléculas que lo forman se ejercen unas fuerzas, llamadas de Van der Waals, que pueden considerarse como residuales de las fuerzas electromagnéticas, algo más débiles que éstas. En cambio, en los silicatos sólidos (como en el caso del topacio) el enlace covalente o iónico no se limita a una molécula, sino que se extiende en el espacio ocupado por el sólido, resultando un entramado particularmente fuerte.
Al igual que los cristales de hielo, en la mayoría de los silicatos la información que soportan es pequeña, aunque conviene matizar este punto. Para un cristal ideal así sería en efecto, pero ocurre que en la realidad el cristal ideal es una abstracción, ya que en el cristal real existen aquí y allá los llamados defectos puntuales que trastocan la periodicidad espacial propia de las redes ideales. Precisamente esos defectos puntuales podían proporcionar una mayor información.

El cristal ideal no existe, en su natural, todos tienen inperfecciones y, sólo el elaborado, se podría decir que son cristales perfectos y, sin embargo, la mano del hombre lo que ha producido con tal intervención es perder una valiosa información inserta en ese cuerpo natural.
Si prescindimos de las orgánicas, el resto de las moléculas que resultan de la combinación entre los diferentes átomos no llega a 100.000, frente a los varios millones de las primeras. Resulta ranozable suponer que toda la enorme variedad de moléculas existentes, principalmente en los planetas rocosos, se haya formado por evolución de los átomos, corresponde a un proceso evolutivo. La molécula poseería mayor orden que los átomos de donde procede, esto es, menor entropía. En su formación, el ambiente se habría desordenado al ganar entropía en una cierta cantidad tal, que arrojase un balance total positivo.
No puedo dejar pasar la oportunidad, aunque sea de pasada, de mencionar las sustancias.


Las así llamadas, son cuerpos formados por moléculas idénticas, entre las cuales pueden o no existir enlaces químicos. Veremos varios ejemplos. Las sustancias como el oxígeno, cloro, metano, amoníaco, etc, se presentan en estado gaseoso en condiciones ordinarias de presión y temperatura. su confinamiento se embotellan, aunque existen casos en que se encuentran mezcladas en el aire (os podéis dar una vueltecita por el polo químico de Huelva en España).
En cualquier caso, un gas como los citados consiste en un enjambre de las moléculas correspondientes. Entre ellas no se ejercen fuerzas, salvo cuando colisionan, lo que hacen con una frecuencia que depende de la concentración, es decir, del de ellas que están concentradas en la unidad de volumen; número que podemos calcular conociendo la presión y temperatura de la masa de gas confinada en un volumen conocido.

Nubes moleculares en Orión
Decía que no existen fuerzas entre las moléculas de un gas. En realidad es más exacto que el valor de esas fuerzas es insignificante porque las fuerzas residuales de las electromagnéticas, a las que antes me referí, disminuyen más rápidamente con la distancia que las fuerzas de Coulomb; y distancia es ordinariamente de varios diámetros moleculares.
Podemos conseguir que la intensidad de esas fuerzas aumente tratando de disminuir la distancia media entre las moléculas. Esto se puede lograr haciendo descender la temperatura, aumentando la presión o ambas cosas. Alcanzada una determinada temperatura, las moléculas comienzan a sentir las fuerzas de Van der Waals y aparece el líquido; si se sigue enfriando aparece el sólido. El orden crece desde el gas al líquido, siendo el sólido el más ordenado. Se trata de una red tridimensional en la que los nudos o vértices del entramado están ocupados por moléculas.
Todas las sustancias conocidas pueden presentarse en cualquiera de los tres estados de la materia (estados ordinarios y cotidianos en nuestras vidas del día a día).

En la Naturaleza existen Plasmas fríos moleculares, por ejemplo, en ciertas regiones de las nubes interestelares y en las ionosfera de la Tierra y otros planetas o satélites. plasma-ese-estado-de-la-materia-del-que-estan-hechas-las-estrellas/#”>Pero también son producidos actualmente por el ser humano en gran variedad para investigación y multitud de aplicaciones.
también son producidos actualmente por el ser humano en gran variedad para investigación y multitud de aplicaciones.

El plasma está presente en los filamentos de los remanentes de Supernovas

Lo que ocurre en las Nubes moleculares es tan fantástico que llegan a conseguir los elementos necesarios plasma-ese-estado-de-la-materia-del-que-estan-hechas-las-estrellas/#”>para la vida prebiótica y, allí, en esas inmensas masas de materiales donde nacen las estrellas y los mundos, que, con los parámetros adecuados se producen todas las complejas transiciones de fase que dan lugar al surgir de la vida.
la vida prebiótica y, allí, en esas inmensas masas de materiales donde nacen las estrellas y los mundos, que, con los parámetros adecuados se producen todas las complejas transiciones de fase que dan lugar al surgir de la vida.
El papel de las moléculas en Astronomía se ha convertido en un área importante desde el descubrimiento de las primeras especies poliatómicas en el medio interestelar. Durante más de 30 plasma-ese-estado-de-la-materia-del-que-estan-hechas-las-estrellas/#”>años , han sido descubiertas más de 150 especies moleculares en el medio interestelar y gracias al análisis espectral de la radiación. Muchas resultan muy exóticas para estándares terrestres (iones, radicales) pero buena parte de estas pueden reproducirse en Plasma de Laboratorio. Aparte del interés intrínseco y riqueza de procesos químicos que implican, estas especies influyen en la aparición de nuevas estrellas por su capacidad de absorber y radiar la energía resultante del colapso gravitatorio, y de facilitar la neutralización global de cargas, mucho más eficientemente que los átomos.
, han sido descubiertas más de 150 especies moleculares en el medio interestelar y gracias al análisis espectral de la radiación. Muchas resultan muy exóticas para estándares terrestres (iones, radicales) pero buena parte de estas pueden reproducirse en Plasma de Laboratorio. Aparte del interés intrínseco y riqueza de procesos químicos que implican, estas especies influyen en la aparición de nuevas estrellas por su capacidad de absorber y radiar la energía resultante del colapso gravitatorio, y de facilitar la neutralización global de cargas, mucho más eficientemente que los átomos.

En el espacio el plasma está presente en muchos lugares
El Plasma de las estrellas y otros cuerpos estelares forman el estado más común de la materia en nuestro Universo -al menos la que vemos-
Si las temperaturas reinantes, son de miles de millones de grados, el estado de la materia es el plasma, el material más común del universo, el de las estrellas (aparte de la materia oscura, que no sabemos ni lo que es, ni donde está, ni que “estado” es el suyo).
En ordinarias de presión, la temperatura por debajo de la cual existe el líquido y/o sólido depende del tipo de sustancia. Se denomina temperatura de ebullición o fusión la que corresponde a los sucesivos equilibrios (a presión dada) de fases: vapor ↔ líquido ↔ sólido. Estas temperaturas son muy variadas, por ejemplo, para los gases nobles son muy bajas; también para el oxígeno (O2) e hidrógeno (H2). En cambio, la mayoría de las sustancias son sólidos en condiciones ordinarias (grasas, ceras, etc).
Compuestas:

Las sustancias pueden ser simples y compuestas, según que la molécula correspondiente tenga átomos iguales o diferentes. El de las primeras es enormemente inferior al de las segundas.
El concepto de molécula, individuo físico y químico, pierde su significado en ciertas sustancias que no hemos considerado aún. Entre ellas figuran las llamadas sales, el paradigma de las cuales es la sal de cocina.


Es requerida por el organismo mantener la volemia y procurar el adecuado equilibrio electrolítico. Además, conserva isotonicidad entre plasma e intersticio, así como también mantiene equilibrio con la célula. Implicada directa en el mantenimiento de la media y en el equilibrio osmolar. Su disociación en sangre es parcial (sólo un 93 porciento).
Se trata de cloruro de sodio, por lo que cualquier estudiante de E.G.B. escribiría sin titubear su fórmula: Cl Na. Sin embargo, le podríamos poner en un aprieto si le preguntásemos dónde se puede encontrar aisladamente individuos moleculares que respondan a esa composición. Le podemos orientar diciéndole que en el gas Cl H o en el vapor de agua existen moléculas individualidades. En realidad y salvo casos especiales, por ejemplo, a temperaturas elevadas, no existen moléculas aisladas de sal, sino una especie de molécula gigante que se extiende por todo el cristal. Este edificio de cristal de sal consiste en una red o entramado, como un tablero de ajedrez de tres dimensiones, en cuyos nudos o vértices se encuentran, alternativamente, las constituyentes, que no son los átomos de Cl y Na sino los iones Cl– y Na+. El primero es un átomo de Cl que ha ganado un electrón, completándose todos los orbitales de valencia; el segundo, un átomo de Na que ha perdido el electrón del orbital s.


Por esta zona de Huelva, conocida Marismas del Odiel, llevaba con frecuencia a mis hijos pequeños que, jugando por aquellos parajes, se lo pasaban estupendamente, y, de camino, tenía la oportunidad de despertarles la curiosidad de cómo se producía la Sal.
los átomos de Cl y Na interaccionan por aproximarse suficientemente sus nubes electrónicas, existe un reajuste de cargas, porque el núcleo de Cl atrae con más fuerza los electrones que el de Na, así uno pierde un electrón que gana el otro. El resultado es que la colectividad de átomos se transforma en colectividad de iones, positivos los de Na y negativos los de Cl. Las fuerzas electromagnéticas esos iones determinan su ordenación en un cristal, el Cl Na. Por consiguiente, en los nudos de la red existen, de manera alternativa, iones de Na e iones de Cl, resultando una red mucho más fuerte que en el caso de que las fuerzas actuantes fueran de Van der Waals. Por ello, las sales poseen puntos de fusión elevados en relación con los de las redes moleculares.

Aparte de los familiares estados de la materia que más conocemos: sólido, líquido y gaseoso, plasma-ese-estado-de-la-materia-del-que-estan-hechas-las-estrellas/#”>también están el Plasma y el Condensado de Bose-Einstein. El plasma (plasma-ese-estado-de-la-materia-del-que-estan-hechas-las-estrellas/#”>como
están el Plasma y el Condensado de Bose-Einstein. El plasma (plasma-ese-estado-de-la-materia-del-que-estan-hechas-las-estrellas/#”>como decía al principio), es un estado de gas ionizado los átomos y moléculas que lo componen han perdido gran plasma-ese-estado-de-la-materia-del-que-estan-hechas-las-estrellas/#”>parte
decía al principio), es un estado de gas ionizado los átomos y moléculas que lo componen han perdido gran plasma-ese-estado-de-la-materia-del-que-estan-hechas-las-estrellas/#”>parte de sus electrones. Está compuesto por electrones, cationes (iones con carga positiva) y neutrones. No sabemos si es posible que puedan existir otros estados de la materia aún no hallados, como por ejemplo, la materia extraña hecha de Quarks-Gluones.
de sus electrones. Está compuesto por electrones, cationes (iones con carga positiva) y neutrones. No sabemos si es posible que puedan existir otros estados de la materia aún no hallados, como por ejemplo, la materia extraña hecha de Quarks-Gluones.
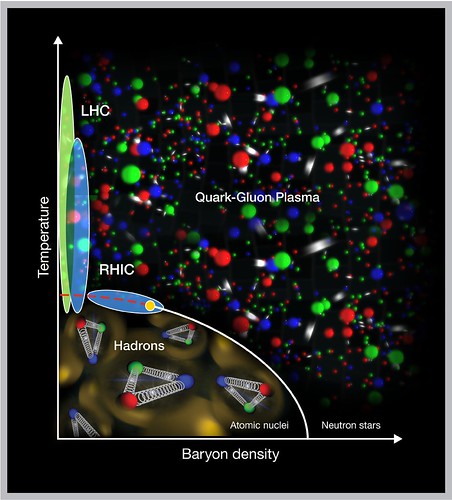
Así amigos míos, hemos llegado a conocer (al plasma-ese-estado-de-la-materia-del-que-estan-hechas-las-estrellas/#”>menos en parte), algunos de los procesos asombrosos que se producen continuamente en el Espacio Interestelar, en esa Nebulosas que captadas por el Hubble y otros telescopios, miramos asombrados maravillándonos de sus colores que, en realidad, llevan mensajes que nos están diciendo el por qué se producen y que elementos son los causantes de que brillen deslumbrantes cuando la radiación estelar choca de lleno en esas nubes en la que nacen las estrellas y los nuevos mundos…y, si me apurais un poco…, también la vida.
en parte), algunos de los procesos asombrosos que se producen continuamente en el Espacio Interestelar, en esa Nebulosas que captadas por el Hubble y otros telescopios, miramos asombrados maravillándonos de sus colores que, en realidad, llevan mensajes que nos están diciendo el por qué se producen y que elementos son los causantes de que brillen deslumbrantes cuando la radiación estelar choca de lleno en esas nubes en la que nacen las estrellas y los nuevos mundos…y, si me apurais un poco…, también la vida.

Y mientras que vamos descubriendo los secretos de la Naturaleza y se van realizando múltiples avances en las disciplinas científicas que nuestra especie ha logrado encausar plasma-ese-estado-de-la-materia-del-que-estan-hechas-las-estrellas/#”>para conocer cómo funciona el universo, al mismo tiempo y de forma paralela, nuestras ciudades crecen y se modernizan, las sociedades cambian y las costumbres de los pueblos también. El mundo, nuestro pequeño mundo situado en una sistema planetario presidido por una estrella ordinaria, de las que existen cientos de miles en nuestra propia Galaxia, aunque lo es todo para nosotros, no por ello deja de ser una mínima fracción de la Galaxia y una ínfima mota de polvo enel contexto del Universo. Sin embargo nosotros, creemos ser tan importantes que, no pocas veces, confundimos la realidad y mirándonos el ombligo, creemos ser el centro de todo, cuando en realidad… ¡somos tan frágiles! ¡somos tan poca cosa en ese inmenso océano que llamamos universo!
conocer cómo funciona el universo, al mismo tiempo y de forma paralela, nuestras ciudades crecen y se modernizan, las sociedades cambian y las costumbres de los pueblos también. El mundo, nuestro pequeño mundo situado en una sistema planetario presidido por una estrella ordinaria, de las que existen cientos de miles en nuestra propia Galaxia, aunque lo es todo para nosotros, no por ello deja de ser una mínima fracción de la Galaxia y una ínfima mota de polvo enel contexto del Universo. Sin embargo nosotros, creemos ser tan importantes que, no pocas veces, confundimos la realidad y mirándonos el ombligo, creemos ser el centro de todo, cuando en realidad… ¡somos tan frágiles! ¡somos tan poca cosa en ese inmenso océano que llamamos universo!
El día que la Humanidad desaparezca… ¡Ninguna estrella llorará por ella! Todo seguirá su ritmo y otras especies surgirán. Claro que, aunque sepamos eso, nada podrá frenar nuestra curiosidad y seguiremos esa aventura que la incansable Humanidad está viviendo mientras persigue el saber del “mundo”.
emilio silvera















 Totales: 75.377.127
Totales: 75.377.127 Conectados: 97
Conectados: 97