Feb
3
La necesidad agudiza la imaginación
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en El saber del mundo ~
Clasificado en El saber del mundo ~
 Comments (7)
Comments (7)
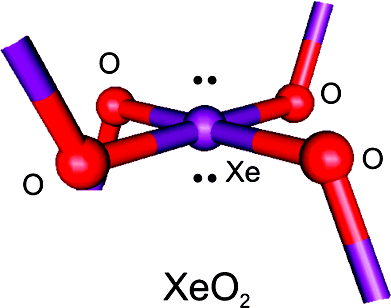
La fuerza nuclear débil nos habla de materiales que, de manera natural, emiten radiación y se desintegran. Al pensar en la desintegración me ha traído a la memoria aquellos libros de Asimov que nos explicaba cuestiones de ciencia y nos decía existen materiales que también se desintegran de manera natural y que son materiales fértiles, o que sin serlo, se pueden transformar en otros que sí lo son.
Al hablar de material fértil me estoy refiriendo a núclidos que pueden absorber neutrones para formar material fisible. El uranio-238, por ejemplo, absorbe un neutrón para formar uranio-239, que se desintegra en plutonio-239. Este es el tipo de conversión que la imaginación del hombre hace que ocurra en un reactor reproductor.

Lo explicaré con más detalles: El Reactor Reproductor Rápido es un reactor de neutrones rápidos diseñado para producir combustible generando más material fisible del que consume. El FBR es uno de los tipos posibles de reactores reproductores.
Veámos: El uranio-235 es un combustible práctico, es decir, los neutrones lentos son capaces de hacer que el uranio-235 se fisione, o lo que es lo mismo, se rompan sus átomos en dos, produciendo neutrones lentos, que a su vez inducen otras fisiones atómicas. El uranio-233 y el plutonio-239 son también combustibles nucleares prácticos por las mismas razones.
Desgraciadamente, el uranio-233 y el plutonio-239 no existen en estado natural sino en trazas mínimas, y el uranio-235, aunque existe en cantidades apreciables, no deja de ser raro. En cualquier muestra de uranio natural, sólo siete de cada mil átomos son de uranio-235, el resto es uranio-238.

Uranio
El uranio natural extraído de las minas contiene un 99´3 % de U-238 y apenas el 0´7 % de U-235.
El uranio-238, la variedad común de uranio, no es un combustible nuclear práctico. Así que, el uranio que más abunda en la naturaleza no sirve como combustible nuclear. Podemos conseguir que se fisione, pero sólo con neutrones rápidos. Los átomos de uranio-238 que se rompen en dos, producen neutrones lentos, que no bastan para producir o inducir nuevas fisiones. El uranio-238 cabría compararlo a la madera húmeda: es posible hacer que arda, pero acabará por apagarse.

El uranio es un elemento químico metálico de color plateado-grisáceo de la serie de los actínidos, su símbolo químico es U y su número atómico es 92. Por ello posee 92 protones y 92 electrones, con una valencia de 6. Su núcleo puede contener entre 142 y 146 neutrones, sus isótopos más abundantes son el 238U que posee 146 neutrones y el 235U con 143 neutrones. El uranio tiene el mayor peso atómico de entre todos los elementos que se encuentran en la naturaleza. El uranio es aproximadamente un 70% más denso que el plomo, aunque menos denso que el oro o el wolframio. Es levemente radioactivo. Fue descubierto como óxido en 1789 por M. H. Klaproth que lo llamó así en el honor del planeta Urano que acababa de ser descubierto en 1781.
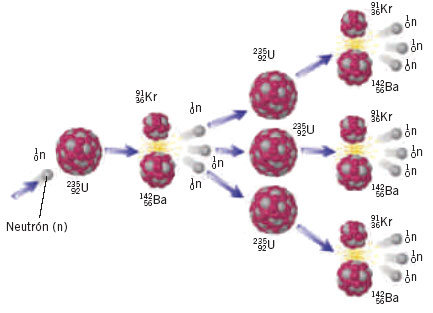
Supongamos, sin embargo, que se separa el uranio-235 del uranio-238 (trabajo más bien difícil) y que se utiliza aquel para hacer funcionar un reactor nuclear. Los átomos de uranio-235 que forman el combustible del reactor se fisionan y esparcen miríadas de neutrones lentos en todas direcciones. Si el reactor está rodeado por una capa de uranio ordinario (que en su mayor parte es uranio-238), los neutrones que van a parar allí son absorbidos por el uranio-238 y, aunque no pueden hacer que el uranio-238 se fisione, sí pueden provocar otros cambios que finalmente, producirán plutonio-239. Separando este plutonio-239 del uranio (tarea muy fácil), puede ser utilizado como combustible nuclear practico para la fisión.
De esta manera, el reactor nuclear genera nuevo combustible a partir de un material (uranio-238) que no lo es. Este es el motivo de que al reactor nuclear que hace posible la transformación se le llame “reactor generador”.
Un reactor generador bien diseñado puede producir más plutonio-239 que el uranio-234 consumido para ello. De este modo, las reservas totales de uranio de la Tierra (y no sólo las de uranio-235) se convierten en potenciales de combustible nuclear.

Torio
Carlo Rubbia, exdirector del CERN (los mismos que hicieron el Colisionador de Hadrones) y ganador del premio Nobel de física en 1984, ha trabajado buena parte de su carrera en el desarrollo de tecnologías para la producción de energía a partir de torio y calcula que con un reactor adecuado, este proceso de fisión podría generar a partir de 1 tonelada del elemento la misma cantidad de energía que 200 toneladas de uranio y 3.500.000 toneladas de carbón.
El torio, tal como se da en la naturaleza, consiste todo él en torio-232, que al igual que el uranio-238, no es un combustible nuclear práctico, porque requiere neutrones rápidos para fisionarse. Pero si se coloca torio-232 alrededor de un reactor nuclear, sus átomos absorberán los neutrones y, sin experimentar fisión alguna, se convertirán en átomos de uranio-233. Como el uranio-233 es un combustible práctico que se puede separar fácilmente del torio, el resultado es otra variedad del reactor generador, que convierte las reservas de torio en un combustible nuclear en potencia.


Hasta que no se descubra otra manera de producir energía, el Uranio seguirá
La cantidad total de uranio y de torio que hay en la Tierra es unas 800 veces mayor que las reservas de uranio-235, lo que significa que el buen uso de los reactores generadores podría multiplicar por 800 la oferta potencial de energía extraída de plantas de fisión nuclear.
En este punto, sin dejar de elogiar la inteligencia del hombre que ha sabido encontrar la manera de transformar una materia inservible en otra practica, hay que decir que la energía de fisión nuclear genera también muchos problemas.
Como estará comprobando al lector de este trabajo, el autor ha querido esta vez diversificar los temas y plasmar una variedad múltiple que facilite el conocimiento de distintas cosas que ocurren en la naturaleza, o que la mano del hombre hace que ocurran, y todas estas cuestiones tratadas aquí van encaminadas a resolver preguntas que en alguna ocasión nos hemos podido hacer, tales como:
¿Por qué al calentar un metal se pone primero rojo, luego naranja, después amarillo, pero a continuación blanco en lugar de seguir el espectro y ponerse verde?
¿Y el color en las estrellas?
Cuando un herrero está trabajando, el metal adquiere diferentes colores según recibe el calor de la fragua. Primero se mostrará de un rojo intenso, para ir progresivamente adoptando tonos más claros, pasando del anaranjado al amarillo, y por fin al blanco.
Si se pudiera seguir calentando el hierro, éste adquiriría tonos azulados. Estos cambios en la coloración son una consecuencia directa del aumento de la temperatura, que permitirá mayor maleabilidad. El Cúmulo del Joyero (en la constelación de la Cruz del Sur), fotografiado arriba, muestra cómo ocurre lo mismo con las estrellas, de manera que encontraremos estrellas azules, las más calientes, blancas, amarillas, anaranjadas y rojas, las más “frías”. A veces, estos colores pueden percibirse a simple vista, como Antares (Alpha Scorpii) que es de color rojo, o Rigel (Beta Orionis) blanco-azulada.
En la Naturaleza rigen las mismas leyes para todos y, en todas partes se producen los mismos fenómenos debidos a las mismas causas, en este caso: ¡La Temperatura!
Cualquier objeto, a cualquier energía superior al cero absoluto, radia ondas electromagnéticas. Si su temperatura es muy baja, emite sólo ondas de radio largas, muy pobres en energías. Al aumentar la temperatura, radia una cantidad mayor de ondas, pero también empieza a radiar ondas de radio más cortas (y más energéticas). Si la temperatura sigue subiendo, empiezan a radiarse microondas aún más energéticas y después radiaciones infrarrojas.

Esto no quiere decir que a una temperatura dada sólo se emitan ondas de radio largas, un poco más arriba sólo ondas de radio cortas, luego sólo microondas y después sólo infrarrojos. En realidad, se emite toda la gama de radiaciones, pero siempre hay una radiación máxima, es decir, una gama de longitudes de onda que son las más radiadas, flanqueadas por cantidades menores en el lado de las energías bajas y por cantidades todavía más pequeñas en el de las altas.
Cuando un objeto alcanza la temperatura del cuerpo humano (37°C), el máximo de radiación se encuentra en los infrarrojos largos. El cuerpo humano también radia ondas de radio, pero las longitudes de ondas más cortas y más energéticas son siempre las más fáciles de detectar por ser los más potentes.

Cuando la temperatura alcanza aproximadamente los 600°C, el máximo de radiación se halla en el infrarrojo corto. Pero a estas alturas la pequeña cantidad de radiación que se halla en el lado de las energías altas adquiere una importancia especial, porque entra ya en la región de la luz visible roja. El objeto reluce entonces con un rojo intenso.
Este rojo constituye sólo un pequeño porcentaje de la radiación total, pero como da la casualidad de que nuestro ojo lo percibe, le otorgamos toda nuestra atención y decimos que el objeto está al “rojo vivo”.
Si la temperatura sigue subiendo, el máximo de radiación continúa desplazándose hacia las longitudes de ondas cortas y cada vez se emite más luz visible de longitudes cada vez menores. Aunque el objeto radia más luz roja, se van agregando poco a poco luz anaranjada y luz amarilla en cantidades menores pero significativas. Al llegar a los 1.000°C la mezcla de colores la percibimos como naranja, y a los 2.000°C como amarilla. Lo cual no significa que a los 1.000°C sólo se radie luz naranja y a los 2.000°C sólo se radie luz amarilla, porque si fuese así, habría efectivamente que esperar que lo siguiente fuese “color verde”. Lo que en realidad vemos son mezclas de colores.

Al llegar a los 6.000°C (la temperatura superficial del Sol), el máximo de radiación está en el amarillo visible y lo que llega a nuestros ojos son grandes cantidades de luz visible, desde el violeta hasta el rojo. La incidencia simultánea de toda la gama de luz visible sobre nuestra retina nos da la sensación de blanco, y de ahí el color del Sol.
Los objetos más calientes aún que el Sol radian todas las longitudes de ondas de luz visible y en cantidades todavía mayores, pero el máximo de radiación se desplaza al azul, de modo que la mezcla se desequilibra y el blanco adquiere un tinte azulado.
Toda esta travesía se produce para objetos calientes que emiten “espectros continuos”, es decir, que radian luz en la forma de una ancha banda de longitudes de ondas. Ciertas sustancias en condiciones adecuadas, radian sólo luz de determinadas longitudes de onda. El nitrato de bario radia luz verde cuando se calienta, y con ese fin se lo utiliza en los fuegos de artificio, “calor verde”, podríamos decir.


Nitrato de Bario que produce el color verde en los bonitos fuegos artificiales
¡Qué bonito es saber!

En alguna ocasión todos hemos oído mencionar la palabra “gases nobles”, y sin embargo no siempre sabemos lo que son y el por qué le llaman así. Los elementos que reaccionan difícilmente o que no reaccionan en absoluto con otros elementos se denominan “inertes”. El nitrógeno y el platino son ejemplos de elementos inertes.
En la última década del siglo pasado se descubrieron en la atmósfera una serie de gases que no parecían intervenir en ninguna reacción química. Estos nuevos gases (helio, neón, argón, kripton, xenón y radón) son más inertes que cualquier otro elemento y se agrupan bajo el nombre de gases inertes.
Los elementos inertes reciben a veces el calificativo de “nobles” porque esa resistencia a reaccionar con otros elementos recordaba un poco a la altanería de la aristocracia. El oro y el platino son ejemplos de “metales nobles”, y por la misma razón se llaman a veces “gases nobles” a los gases inertes. Hasta 1.962, el nombre más común era el de gases inertes, quizá porque lo de nobles parecía poco apropiados en sociedades democráticas.

Es apropiado incluir una descripción de este grupo de elementos conocido en un capítulo dedicado a los halógenos, porque el flúor es el único elemento conocido que entra en combinación química directa con los dos gases nobles más pesados, el xenón y el criptón, resultando en compuestos estables.
Los gases nobles surgen en la naturaleza como constituyentes menos abundantes de la atmósfera. La primera indicación de la existencia de los gases nobles fue divulgada por el químico ingles Cavendish, en 1784.
La razón de que los gases inertes sean inertes es que el conjunto de electrones de cada uno de sus átomos está distribuido en capas especialmente estables. La más exterior, en concreto, tiene 8 electrones. Así la distribución electrónica del neón es (2,8) y la del argón (2,8,8). Como la adición o sustracción de electrones rompe esta distribución estable, no pueden producirse cambios electrónicos. Lo cual significa que no pueden producirse reacciones químicas y que estos elementos son inertes.
Ahora bien, el grado de inercia depende de la fuerza con que el núcleo, cargado positivamente y situado en el centro del átomo sujeta a los 8 electrones de la capa exterior. Cuantas más capas electrónicas haya entre la exterior y el centro, más débil será la atracción del núcleo central sobre los electrones de esa última capa de electrones.

El Radón es un gas radiactivo de origen natural procedente de la desintegración radiactiva de pequeñas cantidades de uranio presentes en rocas y suelo, es el responsable de miles de muertes por cáncer de pulmón en Europa cada año. El gas se filtra en los edificios a través del suelo y de los sótanos, puede acumularse llegando a niveles elevados, especialmente en espacios cerrados y poco ventilados.
Quiere esto decir que el gas inerte más complejo es también el menos inerte. El gas inerte de estructura atómica más complicada es el radón. Sus átomos tienen una distribución electrónica de (2,8,18,32,18,8). El radón, sin embargo está sólo constituido por isótopos radiactivos y es un elemento con el que difícilmente se pueden hacer experimentos químicos. El siguiente en orden de complejidad es el xenón, que es estable. Sus átomos tienen una distribución electrónica de (2,8,18,18,8).
Se sabe desde hace décadas que la abundancia en la Tierra del xenón es menor de lo que debería ser según las proporciones observadas del resto de gases nobles. Las abundancias de estos gases se usan por los geoquímicos para evaluar y datar los principales procesos terrestres, incluyendo la formación de la atmósfera. Para poder hacerlo parten de una hipótesis básica: que los gases nobles son inertes en toda circunstancia. Un trabajo realizado por Gary Schrobilgen y David Brock, de la Universidad McMaster (Canadá), cuyos resultados se publican en el Journal of the American Chemical Society explica la baja abundancia del xenón y pone en evidencia que el xenón no es tan noble como se suponía.
Los electrones más exteriores de los átomos de xenón y radón están bastante alejados del núcleo y, por consiguiente, muy sueltos. En presencia de átomos que tienen una gran apetencia de electrones, son cedidos rápidamente. El átomo con mayor apetencia de electrones es el flúor, y así fue como en 1.962 el químico canadiense Neil Bartlett consiguió formar compuestos de xenón y flúor.
Desde entonces se han conseguido formar también compuestos de radón y kriptón. Por eso los químicos rehúyen el nombre de gases inertes, porque a fin de cuentas, esos gases no son completamente inertes. Hoy día se ha impuesto la denominación de “gases nobles”, y existe toda una rama de la química que se ocupa de los “compuestos de gases nobles”.

Naturalmente, cuanto más pequeño es el átomo de un gas noble, más inerte es, y no se ha encontrado nada que sea capaz de arrancarles algún electrón. El argón, cuya distribución electrónica es de 2,8,8 y el neón, con 2,8 electrones respectivamente, sigue siendo completamente inerte. Y el más inerte de todos es el helio, cuyos átomos contienen una sola capa electrónica con dos electrones (que es lo máximo que puede alojar esta primera capa) que al estar en la primera linea cerca del núcleo positivo, están fuertemente atraídos al tener su carga eléctrica el signo negativo.
Para finalizar diré que los gases nobles (gases inertes, gases raros) están clasificados en el grupo 18 (antiguamente 0) de la tabla periódica de dos elementos y se definen por símbolos que responden a: helio (He), neón (Ne), argón (Ar), kriptón (Kr), xenón (Xe) y radón (Rn).

Ya se dijo antes la configuración electrónica de cada uno de ellos y todas las capas internas están completamente ocupadas, lo que hace que estos elementos, por tanto, constituyan la terminación de un periodo y posean configuración de capa completa, por lo que sus energías de ionización son muy elevadas y su reactividad química escasa.
Como son monoatómicos, las moléculas de los gases nobles poseen simetría esférica, y las fuerzas intermoleculares son muy débiles, por lo que sus entalpías de vaporización son muy bajas.
Con todo lo anteriormente expuesto sobre los gases nobles, espero que el lector del trabajo aquí reflejado pueda tener una idea más amplia y un conocimiento más certero sobre lo que en realidad son los denominados como “gases nobles”.
En comparación con la inmensidad del universo, nos queda aún muchísimo que aprender. Si nos limitamos a nuestro entorno más cercano, la Tierra, ¿cómo hemos podido llegar tan lejos?
¡La curiosidad! y ¡La necesidad! ¡El Instinto! y ¡La Evolución! Todo ello, amigos míos, nos lleva a querer saber y, para ello, debemos desvelar los secretos de la Naturaleza, como que, por cierto, no resulta nada fácil, llevamos miles de años intentando comprender y, de momento, sólo sabemos… ¡Algunas cosas!
emilio silvera
Oct
5
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en El saber del mundo ~
Clasificado en El saber del mundo ~
 Comments (0)
Comments (0)
![]()
Icono conmemorativo del Primer Concilio de Nicea
Los cristianos calculaban la edad del mundo consultando las cronologías bíblicas de los nacimientos y muertes de los seres humanos, agregando los “engendrados”, como decían ellos. Este fue el método de Eusebio que presidió el Concilio de Nicea convocado por el emperador Constantino en 325 d. C. para definir la doctrina cristiana, y quien estableció que habían pasado 3.184 años entre Adan y Abraham; de san Agustin de Hipona, que calculó la fecha de la Creación en alrededor del 5500 a.C.; de Kepler, que la fechó en 3993 a.C.; y de Newton, que llegó a una fecha sólo cinco años anterior a la de Kepler. Su apoteosis llegó en el siglo XVII, cuando James Ussher, obispo de Armagh, Irlanda, llegó a la conclusión de que “el comienzo del tiempo… se produjo al comienzo de la noche que precedió al día 23 de octubre del año… 4004 a.C.”.
Pasado el tiempo, la exactitud de Ussher le convirtió en el blanco de las burlas de muchos eruditos modernos, pero, a pesar de todos sus absurdos, su enfoque -y, más en general, el enfoque cristiano de la historiografía- hizo más para estimular la investigación científica del pasado que el altanero pesimismo de los griegos. Al difundir la idea de que el universo tuvo un comienzo en erl tiempo y que, por lo tanto, la edad de la Tierra era finita y medible, los cronólogos cristianos montaron sin saberlo el escenario para la época de estudio científico de la cronología que siguió.

Georges Louis Leclerc, Conde de Buffon (Montbard, 7 de septiembre de 1707 – París, 16 de abril de 1788) fue un naturalista, botánico, matemático, biólogo, cosmólogo y escritor francés.
Claro que, la diferencia estaba en que los científicos no estudiaban las Escrituras, sino las piedras. Así fué como el naturalista que arriba podeis ver, expresaba el credo de los geólogos en 1778:
““Así como en la historia civil consultamos documentos, estudiamos medallones y desciframos antiguas inscripciones, a fin de establecer las épocas de las revoluciones humanas y fijar las fechas de los sucesos morales, así también en la historia natural debemos excavar los archivos del mundo, extraer antiguas reliquias de las entrañas de la tierra [y] reunir sus fragmentos… Este es el único modo de fijar ciertos puntos en la inmensidad del espacio, y colocar una serie de mojones en el camino eterno del tiempo.”
Abraham Gottlob Werner (1749 o 1750–1817) fue un científico alemán.
Entre los primeros que aprendieron a leer el lenguaje de las piedras estaban Abraham Gottlob, un geólo alemán, y William Smith, un inglés inspector de canales e ingeniero asesor que colaboró en la excavación del canal del carbón de Somersetshire en 1793, Werner observó que los mismos estratos podían hallarse en el mismo orden en lugares muy alejados unos de otros, lo cual indicaba que el mecanismo que los había formado había operado a gran escala. Esto implicaba que los estratos locales podían brindar elementos de juicio sobre cómo había cambiado el planeta como un todo. Smith, por su parte, observó que los estratos -dispuestos, según sus palabras, como “rebanadas de pan con mantequilla”- no sólo podían ser identificados por su composición total, sino también por las diversas clases de fósiles que contenían.

¿Son los fósiles un exponente universal de la evolución? ¿Cuál es el verdadero mensaje del registro estratigráfico de la tierra y de los fósiles incorporados en el mismo? El registro fósil podría ser la piedra de toque de la teoría de la evolución.
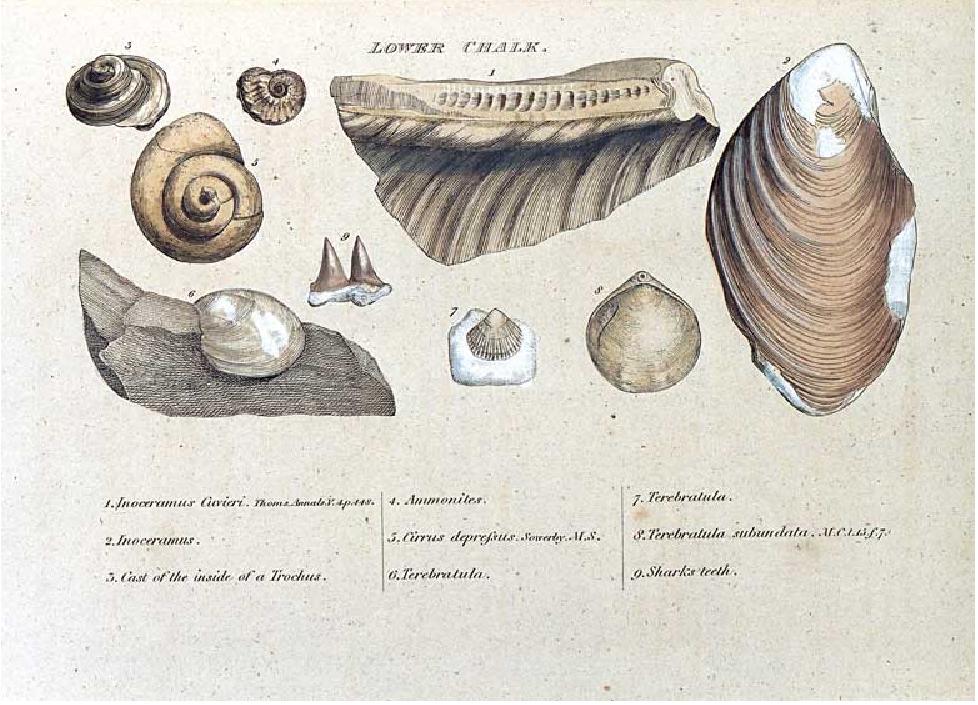
Grabado de la histórica monografía de William Smith, 1815, que dio impulso a la práctica de la correlación de estratos por los fósiles que contienen.
A partir de aquí la búsqueda de huellas del pasado se convirtió en una actividad desaforada y el registro fósil pronto empezó a ofrecer testimonio de seres que ya no se encontraban en el mundo actual. La ausencia de sus equivalentes vivos era un reto a los defensores de la versión bíblica de la historia, que afirmaba, basándose en las Escrituras, que todos los animales fueron creados al mismo tiempo y que ninguna especie se había extinguido desde entonces. A medida que pasaron los años se exploraron cada vez más profundamente las soledades del mundo y las listas de las especies que faltabn era cada vez más larga; George Cuvier, el zoólogo francés que fundó la ciencia de la paleontología, en 1801 había identificado veintitres especies de animales extinguidos en el registro fósil, y la palabra “extinguido” empezó a sonar como una campana que toca a muerto en la literatura científica y las salas universitarias. Ha seguido tocando a muerto desde entonces, y hoy se admite que el 99 por 100 de todas las especies que han vivído sobre la Tierra han desaparecido.

Casi igualmente problemática para los interpretes cristianos de la historia de la Tierra fue la desconcertante variedad de especies vivientes que los biólogos descubrían en sus laboratorios y los naturalistas al explorar las junglas de África, América del Sul y el sureste de Asia. Algunas, como los escarabajos subtropicales gigantes que mordieron al joven Darwin, eran dañinas; sus beneficios para la humanidad, para la que decía que Dios había hecho el mundo, no era evidente. Muchas eran las minúsculas que sólo podían ser detectadas con un microscopio; su papel en el plam de Dios no había sido previsto. Otras eran instintivamente inquietantes, y ninguna más que el orangután, cuyo nombre deriva de la voz malaya que significa “hombre salvaje”, y cuya mirada cálida yn casi íntima, al provenir de una especie muy cercana a la humana en la reserva genética de los primates, parecía burlarse de la pretensión de esta última de ser única.

Si se creía que ninguno de estos seres aparecía en las listas de pasajeros del Arca de Noé… ¿Qué hacían aquí? La ortodoxia religiosa se refugió temperalmente en el concepto de una “gran cadena del ser”. Éste sostenía que la jerarquía de los seres vivos, desde los más elementales microorganismos hasta los monos superiores y las grandes ballenas, habían sido creados por Dios simultáneamente, y que todos juntos formaban una maravillosa estructura, una montaña mágica, con los seres humanos en – o cerca de – su cúspide.
Es difícil sobrestimar la importancia de la gran cadena del ser en el pensamiento del siglo XVIII; figuraba en la estructura de la mayoría de las hipótesis científicas de la época. Pero la cadena no era más fuerte que su eslabón más débil; su mismo carácter completo era una prueba de la perfección de Dios y, por consiguiente, no podía haber ningún “eslabón perdido”. (El término adoptado luego por los evolucionistas proviene de aquí.) Como escribió John Locke:
“En todo el mundo corpóreo visible no vemos simas o abismos. Toda la escala descendente a partir de nosotros es muy gradual, es una serie continua que en cada paso difiere muy poco del anterior. Hay peces que tienen alas y no son extraños al aire, y hay algunos pájaros que son habitantes del agua, cuya sangre es tan fría como la de los peces… Cuando consideramos el poder y la sabiduría infinitos del Hacedor, tenemos razones para pensar que es propio de la magnifica armonía del universo, y al gran designio e infinita bondad de su arquitecto, que las especies de seres asciendan, en suaves transiciones, desde nosotros hacia su infinita perfección, como vemos que desdcienden gradualmente a partir de nosotros.”

Ellos reinaron en nuestro mundo durante unos 150 millones de años. Nosotros hemos llegado aquí, como aquel que dice, antes de ayer pero, “racionales” al fin y al cabo, queremos dolucidar todo lo que, desde los comienzos, pudo pasar y, para ello, el mejor camino será el de la ciencia, ya que, la religión, no puede emitir veredictos fehacientes y, en lugar de basarse en las pruebas, lo hace en la fe que, desde luego, no ofrece ninguna garantía de que lo que afirma, sea lo que en realidad se ajuste a la historia que buscamos saber. Ya sabeis, aquel obispo decía que… “el comienzo del tiempo… se produjo al comienzo de la noche que precedió al día 23 de octubre del año… 4004 a.C.”.
Bueno, no me río pero no por falta de ganas sino por respeto hacia la persona que emitió aquellas palabras y, en consideración al tiempo y al contexto donde las mismas fueron pronunciadas. Lo penoso es que ahora, después de pasados algunos siglos, existan personas que siguen erre que erre insistiendo en los mismos errores. Parece que el tiempo no pasa para ellos y se aferran a unos argumentos “divinos” de trasnochados pensamientos que, alejados de la realidad científica sólo nos pueden conducir hacia la confusión.
emilio silvera















 Totales: 74.942.743
Totales: 74.942.743 Conectados: 120
Conectados: 120