Feb
27
Simetría CP y otros aspectos de la Física
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Física ~
Clasificado en Física ~
 Comments (9)
Comments (9)

Dicen que las matemáticas de la teoría relativista no impide los viajes en el Tiempo, y, sobre el tema, la desbocada imaginación, ha construido cientos de historias más o menos sugestivas con sus paradojas de todo tipo. Lo que realmente creo Yo sobre el tema es que, viajar a un Tiempo que se fue, que no existe (el Pasado se extinguió y solo quedó en el recuerdo), y, de la misma manera, pretender viajar a un Tiempo por venir, que tampoco existe…
Creo que debe existir una especie de Conciencia Cósmica que impida dichos viajes para que, aberraciones irracionales de los sucesos pasados, no puedan cambiar nunca. Y, transportarse a un Tiempo Futuro, mirar qué número salió en le Euro-millón, volver y ganar el Premio, es como cerrar los ojos y ver a la Humanidad viviendo dentro de 4.000 millones de años en un planeta a 2.300 años luz de la Tierra.
Pero somos así.
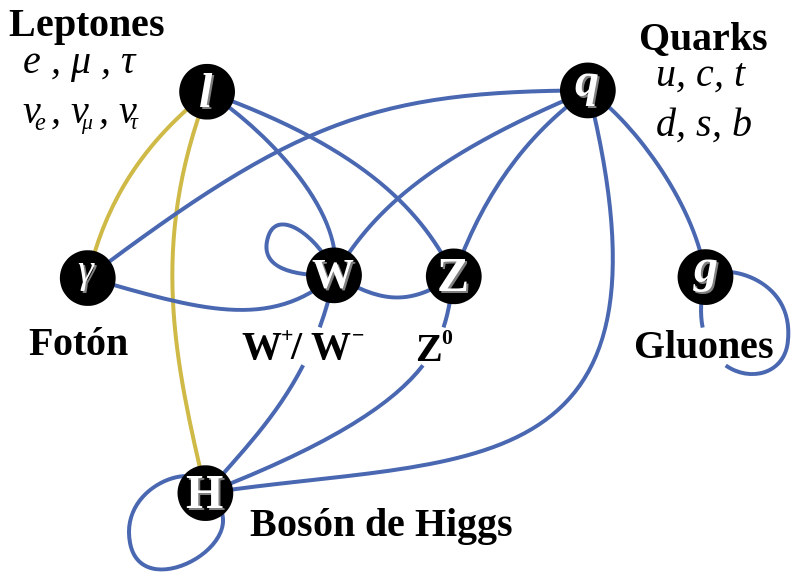
Los quarks al otro lado del espejo. Científicos del Laboratorio Nacional Jefferson Lab (EEUU) han verificado la rotura de la simetría de paridad (también llamada simetría del espejo) en los quarks mediante el bombardeo de núcleos de deuterio con electrones de alta energía. Los núcleos de deuterio están formados por un protón y un neutrón, es decir, por tres quarks arriba y tres quarks abajo. La dispersión inelástica entre un electrón y un quark, es decir, su colisión, está mediada por la interacción electrodébil, tanto por la fuerza electromagnética como por la fuerza débil. Esta última es la única interacción fundamental que viola la simetría de paridad.
Tenemos que saber cómo la violación de la simetría CP (el proceso que originó la materia) aparece, y, lo que es más importante, hemos de introducir un nuevo fenómeno, al que llamamos campo de Higgs, para preservar la coherencia matemática del modelo estándar. La idea de Higgs, y su partícula asociada, el bosón de Higgs, cuenta en todos los problemas que he mencionado antes. Parece, con tantos parámetros imprecisos (19) que, el modelo estándar se mueve bajo nuestros pies.

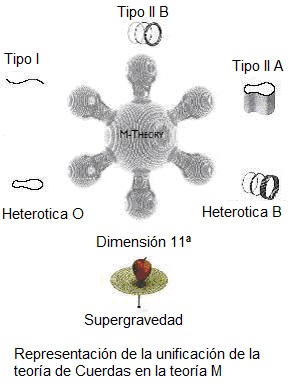
Entre los teóricos, el casamiento de la relatividad general y la teoría cuántica es el problema central de la física moderna. A los esfuerzos teóricos que se realizan con ese propósito se les llama “super-gravedad”, “súper-simetría”, “supercuerdas” “teoría M” o, en último caso, “teoría de todo o gran teoría unificada”.
La Física nos lleva de vez en cuando a realizar viajes alucinantes. Se ha conseguido relacionar y vibrar a dos diamantes en el proceso conocido como entrelazamiento cuántico. El misterioso proceso, al que el propio Einstein no supo darle comprensión completa, supone el mayor avance la fecha y abre las puertas de la computación cuántica. que nos hagamos una idea del hallazgo, en 1935 Einstein lo llegó a denominar la “acción fantasmal a distancia”. Un efecto extraño en donde se conecta un objeto con otro de manera que incluso si están separados por grandes distancias, una acción realizada en uno de los objetos afecta al otro.

Ahí tenemos unas matemáticas exóticas que ponen de punta hasta los pelos de las cejas de algunos de los mejores matemáticos del mundo (¿y Perelman? ¿Por qué nos se ha implicado?). Hablan de 10, 11 y 26 dimensiones, siempre, todas ellas espaciales menos una que es la temporal. Vivimos en cuatro: tres de espacio (este-oeste, norte-sur y arriba-abajo) y una temporal. No podemos, ni sabemos o no es posible instruir, en nuestro cerebro (también tridimensional), ver más dimensiones. Pero llegaron Kaluza y Klein y compactaron, en la longitud de Planck las dimensiones que no podíamos ver. ¡Problema solucionado! Pero se sigue hablando de partículas super-simétricas.
¿Quién puede ir a la longitud de Planck para verlas?

La puerta de las dimensiones más altas quedó abierta y, a los teóricos, se les regaló una herramienta maravillosa. En el Hiperespacio, todo es posible. Hasta el matrimonio de la relatividad general y la mecánica cuántica, allí si es posible encontrar esa soñada teoría de la Gravedad cuántica.
Así que, los teóricos, se han embarcado a la búsqueda de un objetivo audaz: buscan una teoría que describa la simplicidad primigenia que reinaba en el intento calor del universo en sus primeros tiempos, una teoría carente de parámetros, donde estén presentes todas las respuestas. Todo debe ser contestado a partir de una ecuación básica.
¿Dónde radica el problema?
El problema está en que la única teoría candidata no tiene conexión directa con el mundo de la observación, o no lo tiene todavía si queremos expresarnos con propiedad. La energía necesaria para ello, no la tiene ni la nueva capacidad energético del acelerador de partículas LHC . Ni sumando todos los aceleradores de partículas de nuestro mundo, podríamos lograr una energía de Planck (1019 GeV), que sería necesaria para poder llegar hasta las cuerdas vibrantes de la Teoría. Ni en las próximas generaciones seremos capaces de poder utilizar tal energía.
1.956 × 109 J ≈ 1.22 × 1019 GeV
La verdad es que, la teoría que ahora tenemos, el Modelo Estándar, concuerda de manera exacta con todos los datos a bajas energías y contesta cosas sin sentido a altas energías. Sabemos sobre las partículas elementales que conforman la materia bariónica, es decir, los átomos que se juntan para formar moléculas, sustancias y cuerpos… ¡La materia! Pero, no sabemos si, pudiera haber algo más elemental aún más allá de los Quarks y, ese algo, pudieran ser esas cuerdas vibrantes que no tenemos capacidad de alcanzar.
¡Necesitamos algo más avanzado!
Se ha dicho que la función de la partícula de Higgs es la de dar masa a las Cuando su autor lanzó la idea al mundo, resultó además de nueva muy extraña. El secreto de todo radica en conseguir la simplicidad: el átomo resulto ser complejo lleno de esas infinitesimales partículas electromagnéticas que bautizamos con el nombre de electrones, resultó que tenía un núcleo que contenía, a pesar de ser tan pequeño, casi toda la masa del átomo. El núcleo, tan pequeño, estaba compuesto de otros objetos más pequeños aún, los quarks que estaban instalados en nubes de otras partículas llamadas gluones y, ahora, queremos continuar profundizando, sospechamos, que después de los quarks puede haber algo más.
Con 7 TeV ha sido suficiente para encontrar la famosa partícula de Higgs pero…
Bueno, la idea nueva que surgió es que el espacio entero contiene un campo, el campo de Higgs, que impregna el vacío y es el mismo en todas partes. Es decir, que si miramos a las estrellas en una noche clara estamos mirando el campo de Higgs. Las partículas influidas por este campo, toman masa. Esto no es por sí mismo destacable, pues las partículas pueden tomar energía de los campos (gauge) de los que hemos comentado, del campo gravitatorio o del electromagnético. Si llevamos un bloque de plomo a lo alto de la Torre Eiffel, el bloque adquiriría energía potencial a causa de la alteración de su posición en el campo gravitatorio de la Tierra.
Como E=mc2, ese aumento de la energía potencial equivale a un aumento de la masa, en este caso la masa del Sistema Tierra-bloque de plomo. Aquí hemos de añadirle amablemente un poco de complejidad a la venerable ecuación de Einstein. La masa, m, tiene en realidad dos partes. Una es la masa en reposo, m0, la que se mide en el laboratorio cuando la partícula está en reposo. La partícula adquiere la otra parte de la masa en virtud de su movimiento (como los protones en el acelerador de partículas, o los muones, que aumentan varias veces su masa cuando son lanzados a velocidades cercanas a c) o en virtud de su energía potencial de campo. Vemos una dinámica similar en los núcleos atómicos. Por ejemplo, si separamos el protón y el neutrón que componen un núcleo de deuterio, la suma de las masas aumenta.


Peor la energía potencial tomada del campo de Higgs difiere en varios aspectos de la acción de los campos familiares. La masa tomada de Higgs es en realidad masa en reposo. De hecho, en la que quizá sea la versión más apasionante de la teoría del campo de Higgs, éste genera toda la masa en reposo. Otra diferencia es que la cantidad de masa que se traga del campo es distinta para las distintas partículas.
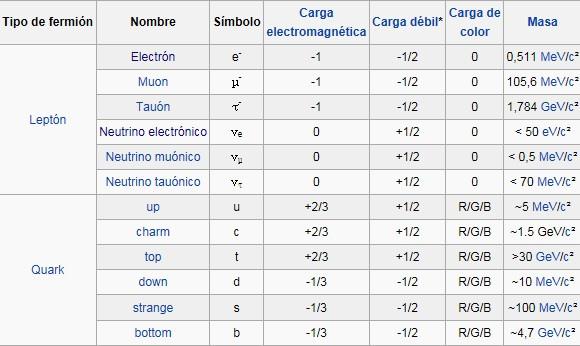
Los teóricos dicen que las masas de las partículas de nuestro modelo estándar miden con qué intensidad se acoplan éstas al campo de Higgs.
La influencia de Higgs en las masas de los quarks y de los leptones, nos recuerda el descubrimiento por Pietez Zeeman, en 1.896, de la división de los niveles de energía de un electrón cuando se aplica un campo magnético al átomo. El campo (que representa metafóricamente el papel de Higgs) rompe la simetría del espacio de la que el electrón disfrutaba.
Hasta ahora no tenemos ni idea de que reglas controlan los incrementos de masa generados por el Higgs (de ahí la expectación creada por el nuevo acelerador de partículas LHC). Pero el problema es irritante: ¿por qué sólo esas masas -Las masas de los W+, W–, y Zº, y el up, el down, el encanto, el extraño, el top y el bottom, así como los leptones – que no forman ningún patrón obvio?
Las masas van de la del electrón 0’0005 GeV, a la del top, que tiene que ser mayor que 91 GeV. Deberíamos recordar que esta extraña idea (el Higgs) se empleó con mucho éxito para formular la teoría electrodébil (Weinberg-Salam). Allí se propuso el campo de Higgs como una forma de ocultar la unidad de las fuerzas electromagnéticas y débiles. En la unidad hay cuatro partículas mensajeras sin masa -los W+, W–, Zº y fotón que llevan la fuerza electrodébil. Además está el campo de Higgs, y, rápidamente, los W y Z chupan la esencia de Higgs y se hacen pesados; el fotón permanece intacto. La fuerza electrodébil se fragmenta en la débil (débil porque los mensajeros son muy gordos) y la electromagnética, cuyas propiedades determina el fotón, carente de masa. La simetría se rompe espontáneamente, dicen los teóricos. Prefiero la descripción según la cual el Higgs oculta la simetría con su poder dador de masa.
Las masas de los W y el Z se predijeron con éxito a partir de los parámetros de la teoría electrodébil. Y las relajadas sonrisas de los físicos teóricos nos recuerdan que Gerard ^t Hooft y Veltman dejaron sentado que la teoría entera esta libre de infinitos.

Todos los intentos y los esfuerzos por hallar una pista del cuál era el origen de la masa fallaron. Feynman escribió su famosa pregunta: “¿Por qué pesa el muón?”. Ahora, por lo menos, tenemos una respuesta parcial, en absoluto completa. Una vez potente y segura nos dice: “!Higgs¡” Durante más de 60 años los físicos experimentadores se rompieron la cabeza con el origen de la masa, y ahora el campo Higgs presenta el problema en un contexto nuevo; no se trata sólo del muón. Proporciona, por lo menos, una fuente común para todas las masas. La nueva pregunta feynmariana podría ser: ¿Cómo determina el campo de Higgs la secuencia de masas, aparentemente sin patrón, que da a las partículas de la matería?
La variación de la masa con el estado de movimiento, el cambio de masa con la configuración del sistema y el que algunas partículas (el fotón seguramente y los neutrinos posiblemente) tengan masa en reposo nula son tres hechos que ponen entre dicho que el concepto de masa sea una tributo fundamental de la materia. Habrá que recordar aquel cálculo de la masa que daba infinito y nunca pudimos resolver; los físicos sólo se deshicieron del “re-normalizándolo”, ese truco matemático que emplean cuando no saben hacerlo bien.
Ese es el problema de trasfondo con el que tenemos que encarar el problema de los quarks, los leptones y los vehículos de las fuerzas, que se diferencian por sus masas. Hace que la historia de Higgs se tenga en pie: la masa no es una propiedad intrínseca de las partículas, sino una propiedad adquirida por la interacción de las partículas y su entorno.
La idea de que la masa no es intrínseca como la carga o el espín resulta aún más plausible por la idílica idea de que todos los quarks y fotones tendrían masa cero. En ese caso, obedecerían a una simetría satisfactoria, la quiral, en laque los espines estarían asociados para siempre con su dirección de movimiento. Pero ese idilio queda oculto por el fenómeno de Higgs.
¡Ah, una cosa más! Hemos hablado de los bosones gauge y de su espín de una unidad; hemos comentado también las partículas fermiónicas de la materia (espín de media unidad). ¿Cuál es el pelaje de Higgs? Es un bosón de espín cero. El espín supone una direccionalidad en el espacio, pero el campo de Higgs de masa a los objetos dondequiera que estén y sin direccionalidad. Al Higgs se le llama a veces “bosón escalar” [sin dirección] por esa razón.
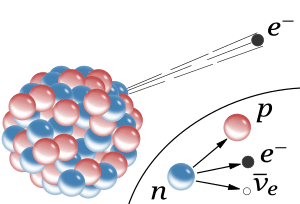
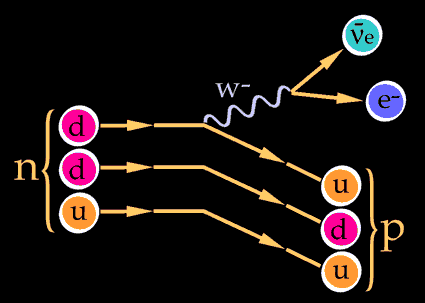
Pues justamente esto es lo que ocurre en la naturaleza cuando entra en acción la fuerza nuclear débil. Un quark tipo u cambia a uno tipo d por medio de la interacción débil así
Las otras dos partículas que salen son un anti-electrón y un neutrino. Este mismo proceso es el responsable del decaimiento radiactivo de algunos núcleos atómicos. Cuando un neutrón se convierte en un protón en el decaimiento radiactivo de un núcleo, aparece un electrón y un neutrino. Este es el origen de la radiación beta (electrones).
La interacción débil, recordareis, fue inventada por E. Fermi para describir la desintegración radiactiva de los núcleos, que era básicamente un fenómeno de poca energía, y a medida que la teoría de Fermi se desarrolló, llegó a ser muy precisa a la hora de predecir un enorme número de procesos en el dominio de energía de los 100 MeV. Así que ahora, con las nuevas tecnologías y energías del LHC, las esperanzas son enormes para, por fin, encontrar el bosón Higgs origen de la masa… y algunas cosas más.

Hay que responder montones de preguntas. ¿Cuáles son las propiedades de las partículas de Higgs y, lo que es más importante, cuál es su masa? ¿Cómo reconoceremos una si nos la encontramos en una colisión de LHC? ¿Cuántos tipos hay? ¿Genera el Higgs todas las masas, o solo las hace incrementarse? ¿Y, cómo podemos saber más al respecto? Como s su partícula, nos cabe esperar que la veamos ahora después de gastar más de 50.000 millones de euros en los elementos necesarios para ello.
También a los cosmólogos les fascina la idea de Higgs, pues casi se dieron de bruces con la necesidad de tener campos escalares que participasen en el complejo proceso de la expansión del Universo, añadiendo, pues, un peso más a la carga que ha de soportar el Higgs.
El campo de Higgs, tal y como se lo concibe ahora, se puede destruir con una energía grande, o temperaturas altas. Estas generan fluctuaciones cuánticas que neutralizan el campo de Higgs. Por lo tanto, el cuadro que las partículas y la cosmología pintan juntas de un universo primitivo puso y de resplandeciente simetría es demasiado caliente para Higgs. Pero cuando la temperatura cae bajo los 10′5 grados kelvin o 100 GeV, el Higgs empieza a actuar y hace su generación de masas. Así por ejemplo, antes de Higgs teníamos unos W, Z y fotones sin masa y la fuerza electrodébil unificada.
El Universo se expande y se enfría, y entonces viene el Higgs (que engorda los W y Z, y por alguna razón ignora el fotón) y de ello resulta que la simetría electrodébil se rompe.
Tenemos entonces una interacción débil, transportada por los vehículos de la fuerza W+, W–, Z0, y por otra parte una interacción electromagnética, llevada por los fotones. Es como si para algunas partículas del campo de Higgs fuera una especie de aceite pesado a través del que se moviera con dificultad y que las hiciera parecer que tienen mucha masa. Para otras partículas, el Higgs es como el agua, y para otras, los fotones y quizá los neutrinos, es invisible.
De todas las maneras, es tanta la ignorancia que tenemos sobre el origen de la masa que, nos agarramos como a un clavo ardiendo el que se ahoga, en este caso, a la partícula de Higgs que, algunos, han llegado a llamar, de manera un poco exagerada:
¡La partícula Divina!

¡Ya veremos en que termina todo esto! Y que explicación se nos ofrece desde el CERN en cuanto al auténtico escenario que según ellos, existe en el Universo para que sea posible que las partículas tomen su masa de ese oceáno de Higgs, en el que, según nuestro amigo Ramón Márquez, las partículas se frenan al interaccionar con el mismo y toman su masa, el lo llama el “efecto frenado”.
Peter Higgs, de la Universidad de Edimburgo, introdujo la idea en la física de partículas. La utilizaron los teóricos steven Weinberg y Abdus Salam, que trabajaban por separado, para comprender como se convertía la unificada y simétrica fuerza electrodébil, transmitida por una feliz familia de cuatro partículas mensajeras de masa nula, en dos fuerzas muy diferentes: la QED con un fotón carente de masa y la interacción débil con sus W+, W– y Z0 de masa grande. Weinberg y Salam se apoyaron en los trabajos previos de Sheldon Glasgow, quien tras los pasos de Julian Schwinger, sabía sólo que había una teoría electrodébil unificada, coherente, pero no unió todos los detalles. Y estaban Jeffrey Goldstone y Martino Veltman y Gerard’t Hooft. También hay otras a los que había que mencionar, pero lo que siempre pasa, quedan en el olvido de manera muy injusta. Además, ¿Cuántos teóricos hacen falta para encender una bombilla?
La verdad es que, casi siempre, han hecho falta muchos. Recordemos el largo recorrido de los múltiples detalle sueltos y físicos que prepararon el terreno para que, llegara Einstein y pudiera, uniéndolo todos, exponer su teoría relativista. (Mach, Maxwell, Lorentz… y otros).
Sobre la idea de Peter Higgs, Veltman, uno de sus arquitectos, dice que es una alfombra bajo la que barremos nuestra ignorancia. Glasgow es menos amable y lo llamó retrete donde echamos las incoherencias de nuestras teorías actuales. La objeción principal: que no tenemos la menor prueba experimental.

Ahora, por fin la tenemos con el LHC, y ésta pega, se la traspasamos directamente a la teoría de supercuerdas y a la materia oscura que, de momento, están en la sombra y no brillan con luz propia, toda vez que ninguna de ellas ha podido ser verificada, es decir, no sabemos si el Universo atiende a lo que en ellas se predice.
El modelo estándar es lo bastante fuerte para decirnos que la partícula de Higgs de menor masa (podría haber muchas) debe “pesar” menos de 1 TeV. ¿Por qué? Si tiene más de 1 TeV, el modelo estándar se vuelve incoherente y tenemos la crisis de la unitariedad.
Después de todo esto, llego a la conclusión de que, el campo de Higgs, el modelo estándar y nuestra idea de cómo pudo surgir el Universo dependen de que se encuentre el bosón de Higgs, Se averigüe si realmente existe la materia oscura, Sepamos llegar al fondo de la Teoría de Cuerdas y confirmarla, Poder crear esa Teoría cuántica de la Gravedad…Y, en fin, seguir descubriendo los muchos misterios que no nos dejan saber lo que el Universo es. Ahora, por fin, tenemos grandes aceleradores y Telescopios con la energía necesaria y las condiciones tecnológicas suficientes para que nos muestre todo eso que queremos saber y nos digan dónde reside esa verdad que incansables perseguimos.
¡La confianza en nosotros mismos, no tiene límites! Pero, no siempre ha estado justificada.
¿Los secretos del Universo? ¡Persistirán como el Tiempo!
Emilio Silvera Vázquez
Feb
26
Tratamos de comprender la Mente y el Mundo II
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Física ~
Clasificado en Física ~
 Comments (5)
Comments (5)

En pie contra una subestación eléctrica de Endesa situada junto a tres centros educativos.
Vecinos de Torrox exigen detener las obras de la subestación eléctrica. Temen por consecuencias en la salud, como la leucemia o patologías cardiacas
imientos para asegurarlo, todos apuntan en la misma dirección: El medio ambiente que nos rodea (ambioma), es determinante en la aparición de ciertos trastornos. Las pruebas más frecuentes están relacionadas con Urbanizaciones y centros escolares situados en zonas de tendidos eléctricos de potente voltaje. Otras, como la emanación de gases de centros industriales, también están entre las causas más frecuentes de trastornos físicos. Claro que, las grandes empresas, niegan cualquier incidencia.
Se define como ambioma al conjunto de elementos no genéticos, cambiantes, que rodean el individuo y que contribuyen a conformar el desarrollo y construcción del ser humano y por lo tanto el estado de salud o la aparición de enfermedad.
No podemos cerrar los ojos a esta realidad, esta nueva área de conocimientos, el ambioma, nos llevará a darnos cuenta que tiene ingredientes que influyen, y a veces poderosamente, en el individuo y en su desarrollo a lo largo de su vida, hasta tal punto que, se cree pueda ser el factor determinante para acortarla en el tiempo.
La acción poderosa y nociva que una radiación continuada puede inferir en nuestros frágiles organismos, son incalculables y, no siempre, dichas radiaciones, pueden ser medidas con claridad, no todas las radiaciones gritan su presencia como en el caso de la fisión nuclear:
Es posible comenzar un trabajo con una idea preconcebida y, que dicho trabajo, tome sus propios caminos que, en realidad, vienen a converger siempre en ese punto central que era la idea original, ya que, todo esta conexionado de alguna manera misteriosa.
Empezamos hablando de la mente, de las sensaciones y de la conciencia, del ente sensible y complejo que guardamos en la poderosa “máquina creadora de pensamientos” que todos llevamos sobre los hombros y, estamos tocando temas relacionados que, de alguna manera, inciden en el avance de esa prodigiosa estructura del entendimiento, y de las ideas y sensaciones.
Podríamos poner aquí miles de ejemplos de idas brillantes salidas de mentes humanas. Sin embargo, me viene a la memoria un titular: “Los descubridores del PEGAMENTO que une la materia ganan el Nobel de Física” (decía un periódico allá por el último trimestre de 2.004).



Gross Politzer Wilczek

La noticia se refería a David Gross, David Poltczer y Frank Wilczek, los descubridores del funcionamiento de la fuerza que cohesionan a los quarks, las partículas más elementales (de momento), donde ellos hablan de libertad asintítuca y perfeccionan la cromodinámica cuántica.
Cualquiera que haya leído sobre temas de ciencia de la materia, sabe que desde los tiempos de la antigua Grecia hasta el de Einstein, el gran sueño de todos los sabios que han estudiado la naturaleza ha sido una descripción precisa y completa de nuestro Universo, las constantes de la Naturaleza y las fuerzas fundamentales, algo que ya está más cerca gracias al trabajo de estos tres científicos estadounidenses.
Hace más de treinta años que Gross, Politzer y Wilczek desvelaron el enigmático funcionamiento de la llamada interacción fuerte, una de las cuatro fuerzas fundamentales que rigen el Universo, y que actúa como un pegamento cósmico para mantener unida la materia. Su trabajo reveló como los quarks, las diminutas partículas que forman los nucleones de los átomos, interaccionan entre sí para mantenerse unidos.
Las fuerzas que podemos sentir en la vida cotidiana, es decir, la Gravedad y el Electromagnetismo, aumentan con la cercanía: así, cuanto más cerca está un clavo de una imán o una manzana del suelo, más se verán atraídos. Por el contrario, la interacción fuerte disminuye cuanto más cerca y juntas están las partículas en el interior de los átomos, y, por el contrario de las otras fuerzas, aumenta cuanto más se alejan las unas de las otras.
El descubrimiento de esta extraña propiedad, llamada libertad asintótica, supuso toda una revolución teórica en los años 70 (se publicó en 1.973), pero ya plenamente respaldada por los experimentos en los aceleradores de partículas, aconsejó, a la Academia, conceder 30 años más tarde, el Premio Nobel de Física a sus autores.

“Ha sido un gran alivio. He estado pensando en ello durante mucho tiempo”, comentó al enterarse de la noticia Franck Wilczek.
“No estaba claro que fuera un adelanto en aquel momento. La teoría que propusimos era descabellada en muchos aspectos y tuvimos que dar muchas explicaciones”, reconoció el investigador.
Tanto Wilczek como Politzer eran aún aspirantes a doctores en 1.973, cuando publicaron su descubrimiento en Physical Review letters. Junto a su informe, la misma revista incluyó el trabajo de David Gross, que unido al de los dos estudiantes ha dado lugar a la celebrada teoría de la Cromodinámica Cuántica (QCD).
La carga de color de un quark puede tener tres valores diferentes: “rojo”, “verde”, o “azul”; y un anti-quark puede tener tres “anti-colores” diferentes, en ocasiones llamados “anti-rojo”, “anti-verde” y “anti-azul” (a veces representados por cian, magenta y amarillo).
Siguiendo una arraigada costumbre de la Física de partículas, los investigadores emplearon nombres comunes y desenfadados para señalar sus nuevos descubrimientos y llamaron “colores” a las intrincadas propiedades de los quarks.
Por ello, su teoría es conocida en la actualidad por el nombre de Cromodinámica (cromo significa “color” en griego), a pesar de que no tienen nada que ver con lo que entendemos y llamamos color en nuestra vida cotidiana, sino con el modo en que los componentes del núcleo atómico permanecen unidos. En este sentido, resulta mucho más intuitiva, aunque no menos divertida, la denominación de las partículas que hacen posible la interacción fuerte, llamadas gluones (glue es “pegamento” en inglés).
Al igual que en la teoría electromagnética, las partículas pueden tener carga positiva o negativa, los componentes más diminutos del núcleo atómico pueden ser rojos, verdes o azules.
Además, de manera análoga a como las cargas opuestas se atraen en el mundo de la electricidad y el magnetismo, también los quarks de distinto color se agrupan en tripletes para formar protones y neutrones del núcleo atómico.
Pero estas no son las únicas similitudes, ni siquiera las más profundas, que existen entre las distintas fuerzas que rigen el Universo. De hecho, los científicos esperan que, en última instancia, todas las interacciones conocidas sean en realidad la manifestación variada de una sola fuerza que rige y gobierna todo el cosmos.
Según la Academia Sueca, el trabajo premiado a estos tres Físicos, “constituye un paso importante dentro del esfuerzo para alcanzar la descripción unificada de todas las fuerzas de la Naturaleza”. Lo que llamamos teoría del todo.

Los Quarks están sujetos y confinados en un mar de gluones
Según Frank Wiczek, que ahora pertenece al Instituto Tecnológico de Massachussets (MIT), su descubrimiento “reivindica la idea de que es posible comprender a la Naturaleza racionalmente”. El físico también recordó que “fue una labor arraigada en el trabajo experimental, más que en la intuición”, y agradeció “a Estados Unidos por un sistema de enseñanza pública que tantos beneficios me ha dado”.
Sabemos que los quarks (hasta el momento) son las partículas más elementales del núcleo atómico donde forman protones y neutrones. La interacción fuerte entre los quarks que forman el protón es tan intensa que los mantiene permanentemente confinados en su interior, en una región muy pequeña dentro del núcleo. Y, allí, la fuerza crece con la distancia, si los quarks tratan de separarse, la fuerza aumenta (confinamiento de los quarks), si los quarks están juntos los unos a los otros, la fuerza decrece (libertad asintótica de los quarks). Nadie ha sido capaz de arrancar un quak libre fuera del protón.
Con aceleradores de partículas a muy altas energías, es posible investigar el comportamiento de los quarks a distancias muchos más pequeñas que el tamaño del protón.
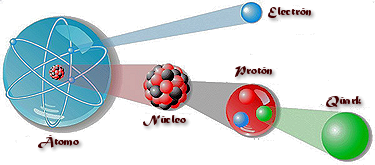
Así, el trabajo acreedor al Nobel demostró que la fuerza nuclear fuerte actúa como un muelle de acero, si lo estiramos (los quarks se separan), la fuerza aumenta, si lo dejamos en reposo, en su estado natural, los anillos juntos (los quarks unidos), la fuerza es pequeña.
Así que la Cromodinámica Cuántica (QCD) describe rigurosamente la interacción fuerte entre los quarks y, en el desarrollo de esta teoría, como se ha dicho, jugaron un papel fundamental los tres ganadores del Nobel de Física de 2004.
Trabajos y estudios realizados en el acelerador LEP del CERN durante la década de los 90 han hecho posible medir con mucha precisión la intensidad de la interacción fuerte en las desintegraciones de las partículas z y t, es decir a energías de 91 y 1’8 Gev, los resultados obtenidos están en perfecto acuerdo con las predicciones de ACD, proporcionando una verificación muy significativa de libertad asintótica.
====== Mini Big Bang a 100 metros bajo tierra ======
Habiendo mencionado el CERN (Centro Europeo de Investigación Nuclear.), me parece muy oportuno recordar aquí que acabó de ponerse en marcha hace ua algún tiempo el LHC (el Gran colisionador de Hadrones), el acelerador de partículas más grande del mundo. Las pruebas llevadas a cabo han sido varias y a distintas energías, alcanzando los 7 TeV. De momento, no sabemos si realmente encontró lo que buscaba.
Simular el nacimiento del Universo no resulta nada sencillo. Primero hay que excavar un túnel subterráneo de 100 m. de profundidad, en cuyo interior se debe construir un anillo metálico de 27 kilómetros enfriado por imanes superconductores cuya función es mantener una temperatura bastante fuera, nada menos que 271 grados bajo cero.


Imanes de nueva generación impulsan la actualización del Gran Colisionador de Hadrones.
En el CERN, la Cadena IT (Inner Triplet), una instalación de pruebas única, ha sido el centro de estas innovaciones. La prueba de los imanes cuadrupolares superconductores, fabricados con niobio-estaño, representa un avance crucial. Estos imanes son capaces de generar campos magnéticos de hasta 11,3 teslas, una mejora significativa frente a los imanes actuales de niobio-titanio, que generan un campo de 8,6 teslas con temperaturas muy elevadas bajo cero.
Los nuevos imanes del LHC de alta luminosidad generan campos magnéticos de 11,3 teslas.
A continuación, hay que añadir a la ecuación dos puñados de protones, lanzados al vacío de este tubo subterráneo en direcciones opuestas, y a una velocidad inimaginable que prácticamente debe rozar la velocidad de c. la velocidad de la luz en el vacío. Es solo entonces cuando los múltiples colisiones de partículas que se produzcan en el interior del anillo producirán condiciones que existían inmediatamente después del Big Bang, ese descomunal estallido cósmico que dio el pistoletazo de salida para el surgimiento de nuestro mundo y de la via inteligente a partir de esta materia inerte creada y evolucionada después en las estrellas.
En el corazón de la cordillera del Jura, justo en la frontera entre Francia y Suiza, el Centro Europeo de Investigaciones Nucleares (CERN), llevó a cabo la construcción de esta maravilla que, cuando se finalice de instalar todos los componentes de esta faraónica obra científica (cuyo coste está ya en 40.000 millones de euros y se ha tardado 15 años en construirse), unos 10.000 investigadores de 500 instituciones académicas y empresas esperan descubrir nuevas claves sobre la naturaleza de la materia y los ladrillos fundamentales de las que se compone el Universo. Hace unos pocos días que finalizó su puesta a punto y comenzó su esperada puesta en marcha.
¿Podremos encontrar por fin, en 2.008, cuando funcione este Gran Acelerador de Hadrones, esa esperada y soñada partícula, a la que algunos han llegado a llamar La “Partícula Divina”, conocida por partícula de Higgss y que se tiene por la partícula que proporciona las masas a todas las demás ?
Este acelerador tan largamente esperado, ha comenzado a funcionar en 2.008 y, las partículas que se inyecten en su interior colisionaran aproximadamente seiscientos millones de veces por segundo, desencadenando la mayor cantidad de energía jamás observada en las condiciones de un laboratorio, aunque aun estará muy alejada de la energía necesaria para comprobar la existencia de las cuerdas vibrantes. Pero eso sí nos dejará ver otras partículas nuevas hasta ahora esquivas, pertenecientes al grupo más elemental de los componentes de la materia.
El LHC ha producido ya tantos datos que necesitan una pila de CD de 20 km. de altura para almacenar tanta información generada por los experimentos y, una legión de físicos para estudiar resultados, será fascinante.
El trabajo que se lleva a cabo en el CERN constituye una contribución muy importante al conocimiento de la Humanidad para comprender el mundo que nos rodea.
Todo es materia que es lo mismo que decir que son Quarks y Leptones
La pregunta clave: ¿De qué se compone la materia de nuestro Universo? Y ¿Cómo llegó a convertirse en lo que es?
Es increíble el logro de conocimiento y tecnología que el hombre tiene conquistado a principios del siglo XXI, este mismo artilugio al que llaman acelerador LHC, es la mejor prueba de ello: Por ejemplo, los sistemas criogénicos que deben mantener ese inimaginable frío de 271 grados bajo cero o los campos electromagnéticos que deben asegura que la aceleración de los haces de partículas las recorran los 27 km del anillo subterráneo a un 99’99% de la velocidad de la luz.
Si todo sale como está previsto y se cumplen todas las expectativas de los científicos, se calcula que cada segundo, un protón dará 11.245 vueltas al anillo del LHC. Teniendo en cuenta que cada haz de estas partículas tendrá una duración de 10 horas, se estima que recorrerá un total de 10.000 millones de kilómetros (suficiente para llegar a Neptuno y volver).
La energía requerida por el haz de protones a viajar por el acelerador es el equivalente a un coche viajando a 1 .600 km/h por el carril rápido de una autopista imposible, o la cantidad de energía almacenada en los imanes superconductores que mantendrán la temperatura a-271° sería suficiente para derretir 50 toneladas de cobre.

El LHC está dividido en 8 sectores de 3’3 km cada uno, y, de momento, sólo se ha logrado el enfriamiento de uno de los sectores a la temperatura necesaria para llevar a cabo las colisiones que simularán, en miniatura, las condiciones del Big Bang.
El Bosón de Higgss, el tesoro más buscado, será el premio. Una partícula que predice el modelo teórico actual de la Física, pero para el que hasta ahora no existe evidencia alguna. Se supone que este “ladrillo” fundamental del cosmos (cuyo nombre proviene del físico escocés que propuso su existencia en 1.964, Peter Higgss) es crucial para comprender cómo la materia adquiere su masa.
John Ellis, uno de los investigadores del CERN, ha dicho: ²si no encontramos la partícula de Higgs, esto supondría que todos los que nos dedicamos a la Física teórica llevamos 35 años diciendo tonterías”.
Espero que no sea así y que la dichosa partícula aparezca. Herman Tey Kate, otro físico del CERN, se atreve a predecir que, la partícula de Higgs aparecerá antes de que pasen los 12 meses a partir del comienzo de la búsqueda en 2.008.
Creo que me he extendido demasiado en el ejemplo, cuando me introduzco en temas de Física se me va el santo al cielo, pero estamos tratando sobre nosotros y la manera en que evolucionamos para adquirir los conocimientos y sensaciones que tenemos.
Emilio Silvera Vázquez
Feb
26
Los Quarks invisibles
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Física Cuántica ~
Clasificado en Física Cuántica ~
 Comments (0)
Comments (0)
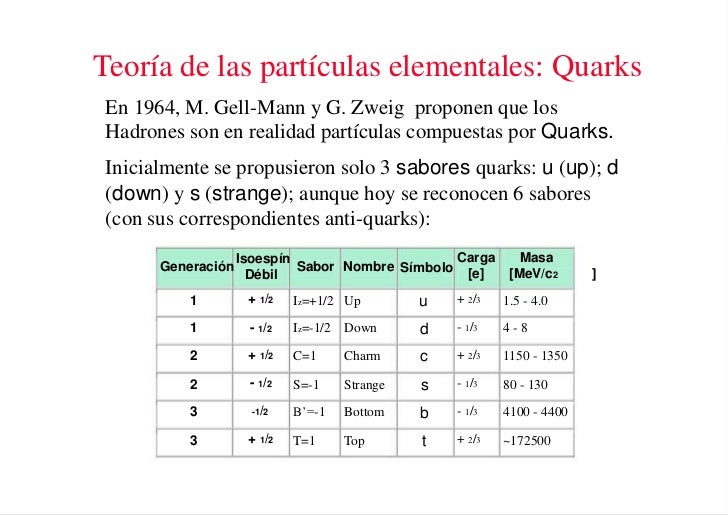
Una vez que se ha puesto orden entre las numerosas especies de partículas, se puede reconocer una pauta. Igual que Dimitri Ivanovich Mendeleev descubrió el sistema periódico de los elementos químicos en 1869, así también se hizo visible un sistema similar para las partículas. Esta pauta la encontraron independientemente el americano Murray Gell-Mann y el israelí Yuval Ne’eman. Ocho especies de mesones, todos con el mismo espín, u ocho especies de bariones, con el mismo espín, se podían reagrupar perfectamente en grupos que llamaremos multipletes. El esquema matemático correspondiente se llama SU(3). Grupletes de ocho elementos forman un octete “fundamental”. Por esta razón Gell-Mann llamó a esta teoría el “óctuplo camino”. Lo tomó prestado del budismo de acuerdo con el cual el camino hacia el nirvana es el camino óctuplo.

Pero las matemáticas SU(3) también admiten multipletes de diez miembros. Cuando se propuso este esquema se conocían nueve bariones con espín 3/2. Los esquemas SU(3) se obtienen al representar dos propiedades fundamentales de las partículas, la extrañeza S frente al iso-espín I₃ , en una gráfica.

La cámara de burbujas es un detector de partículas cargadas eléctricamente. La cámara la compone una cuba que contiene un fluido transparente, generalmente hidrógeno líquido, que está a una temperatura algo más baja que su temperatura de ebullición. Una partícula cargada deposita la energía necesaria para que el líquido comience a hervir a lo largo de su trayectoria, formando una línea de burbujas.


Las partículas cargadas van dejando una huella que se marca para poder comprobarla
Cuando las partículas entran en el compartimento, un pistón disminuye repentinamente la presión dentro del compartimiento. Esto causa que el líquido pase a un estado sobrecalentado, en el cual un efecto minúsculo, tal como el paso de una partícula cargada cerca de un átomo, es suficiente para originar la burbuja de líquido vaporizado. Esta traza puede fotografiarse, pues la cámara tiene en su parte superior una cámara fotográfica. La cámara se somete a un campo magnético constante, lo cual hace que las partículas cargadas viajen en trayectorias helicoidales cuyo radio queda determinado por el cociente entre la carga y la masa de la partícula. De esta manera se pueden obtener la masa y la carga de las partículas que entran en la cámara. Sin embargo, no hay manera de medir con eficacia su velocidad (con lo cual se podría determinar su energía cinética).
Imagen de trazas en la cámara de burbujas del primer evento observado incluyendo bariones Ω, en el Laboratorio Nacional Brookhaven. Dependiendo de su masa y tamaño las partículas producen distintos remolinos en la cámara de burbujas.
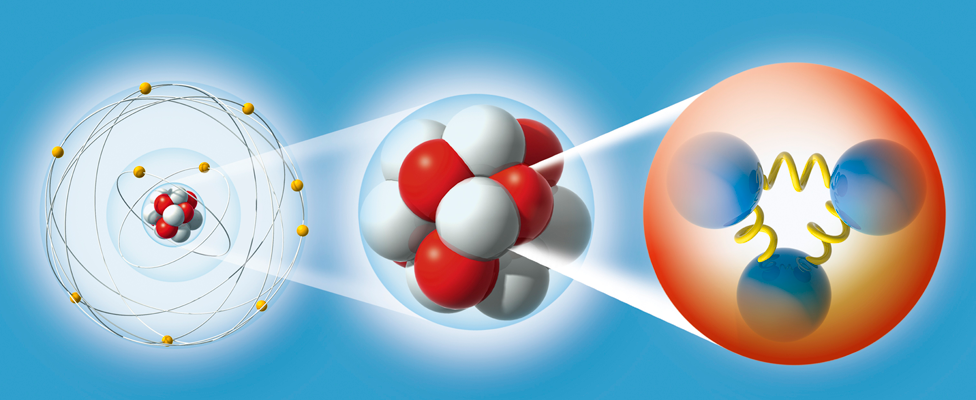
De esta manera, Gell-Mann predijo un décimo barión, el omega-menos (Ω–), y pudo estimar con bastante precisión su masa porque las masas de los otros nueve bariones variaban de una forma sistemática en el gráfico (también consiguió entender que las variaciones de la masa eran una consecuencia de una interacción simple). Sin embargo, estaba claro que la Ω-, con una extrañeza S = -3, no tenía ninguna partícula en la que desintegrarse que no estuviera prohibida por las leyes de conservación de la interacción fuerte. De modo que, la Ω- sólo podía ser de tan sólo 10¯²³ segundos como los demás miembros del multiplete, sino que tenía que ser del orden de 10¯¹⁰ segundos. Consecuentemente, esta partícula debería viajar varios centímetros antes de desintegrarse y esto la haría fácilmente detectable. La Ω¯ fue encontrada en 1964 con exactamente las mismas propiedades que había predicho Gell-Mann.
Se identificaron estructuras multipletes para la mayoría de los demás bariones y mesones y Gell-Mann también consiguió explicarlas. Sugirió que los mesones, igual que los bariones, debían estar formados por elementos constitutivos “más fundamentales aún”. Gell-Mann trabajaba en el Instituto de Tecnología de California en Pasadena (CalTech), donde conversaba a menudo con Richard Feynman. Eran ambos físicos famosos pero con personalidades muy diferentes. Gell-Mann, por ejemplo, es conocido como un entusiasta observador de Pájaros, familiarizado con las artes y la literatura y orgulloso de su conocimiento de lenguas extranjeras.
A comienzos de los años sesenta, un profesor del Instituto de Tecnología de California (Caltech) imparte un curso completo de física ante una cada día más numerosa. Su nombre: Richard Feynman
Feynman fue un hombre hecho a sí mismo, un analista riguroso que se reía de cualquier cosa que le recordara la autoridad establecida. Hay una anécdota que parece no ser cierta de hecho, pero que me parece tan buena que no puedo evitar el contarla; podía haber sucedido de esta forma. Gell-Mann le dijo a Feynman que tenía un problema, que estaba sugiriendo un nuevo tipo de ladrillos constitutivos de la materia y que no sabía qué nombre darles. Indudablemente debía haber de haber pensado en utilizar terminología latina o griega, como ha sido costumbre siempre en la nomenclatura científica. “Absurdo”, le dijo Feynman; “tú estás hablando de cosas en las que nunc ase había pensado antes. Todas esas preciosas pero anticuadas palabras están fuera de lugar. ¿Por qué no los llamas simplemente “shrumpfs”, “quacks” o algo así?”.

Los pequeños componentes de la materia ordinaria
Cuando algún tiempo después le pregunté a Gell-Mann, éste negó que tal conversación hubiera tenido lugar. Pero la palabra elegida fue quark, y la explicación de Gell-Mann fue que la palabra venía de una frase de Fynnegan’s Wake de James Joyce; “¡Tres quarks para Muster Mark!”. Y, efectivamente así es. A esas partículas les gusta estar las tres juntas. Todos los bariones están formados por tres quarks, mientras que los mesones están formados por un quark y un anti-quark.
Los propios quarks forman un grupo SU(3) aún más sencillo. Los llamaremos “arriba (u)”, “abajo” (d), y “extraño” (s). Las partículas “ordinarias” contienen solamente quarks u y d. Los hadrones “extraños” contienen uno o más quarks s (o antiquarks ŝ).
La composición de quarks de espín 3/2 se puede ver en cualquier tabla de física.. La razón por la que los bariones de espín ½ sólo forman un octete es más difícil de explicar. Está relacionada con el hecho de que en estos estados, al menos dos de los quarks tienen que ser diferentes unos de otros.
Junto con los descubrimientos de los Hadrones y de sus componentes, los Quarks, durante la primera mitad del sigo XX, se descubrieron otras partículas. Los Hadrones forman dos ramas, los mesones formados por dos qiuarks y los bariones por tres.
Realmente, la idea de que los hadrones estuvieran formados por ladrillos fundamentales sencillos había sido también sugerida por otros. George Zweig, también en el Cal Tech, en Pasadena, había tenido la misma idea. Él había llamado a los bloques constitutivos “ases!, pero es la palabra “quark” la que ha prevalecido. La razón por la que algunos nombres científicos tienen más éxito que otros es a veces difícil de comprender.
Pero en esta teoría había algunos aspectos raros. Aparentemente, los quarks (o ases) siempre existen en parejas o tríos y nunca se han visto solos. Los experimentadores habían intentado numerosas veces detectar un quark aislado en aparatos especialmente diseñados para ello, pero ninguno había tenido éxito.
Loa quarks –si se pudieran aislar- tendrían propiedades incluso más extrañas. Por ejemplo, ¿Cuáles serían sus cargas eléctricas? Es razonable suponer que tanto los quarks u como los quarks s y d deban tener siempre la misma carga. La comparación de la tabla 5 con la tabla 2 sugiere claramente que los quarks d y s tienen carga eléctrica -1/3 y el quark u tiene carga +2/3. Pero nunca se han observado partículas que no tengan carga múltiplo de la del electrón o de la del protón. Si tales partículas existieran, sería posible detectarlas experimentalmente. Que esto haya sido imposible debe significar que las fuerzas que las mantienen unidas dentro del hadrón son necesariamente increíblemente eficientes.
Todos sabemos que los Lepotines son: El elentrón, el Muón y la partícula Tau y, cada una de ellas tiene su tipo de neutrino: el electrónico, el muónico y el tauónico.
Aunque con la llegada de los quarks se ha clarificado algo más la flora y la fauna de las partículas subatómicas, todavía forman un conjunto muy raro, aún cuando solamente unas pocas aparezcan en grandes cantidades en el universo (protones, neutrones, electrones y fotones). Como dijo una vez Sybren S. de Groot cuando estudiaba neutrinos, uno realmente se enamora de ellos. Mis estudiantes y yo amábamos esas partículas cuyo comportamiento era un gran misterio. Los leptones, por ser casi puntuales, son los más sencillos, y por tener espín se ven afectados por la interacción que actúa sobre ellos de forma muy complicada, pero la interacción débil estaba bastante bien documentada por entonces.

Los hadrones son mucho más misteriosos. Los procesos de choque entre ellos eran demasiado complicados para una teoría respetable. Si uno se los imagina como pequeñas esferas hachas de alguna clase de material, aún quedaba el problema de entender los quarks y encontrar la razón por la que se siguen resistiendo a los intentos de los experimentadores para aislarlos.
Emilio Silvera Vázquez
Si queréis saber más sobre el tema, os recomiendo leer el libro Partículas de Gerard ´t Hooft
Feb
24
Buscando lo desconocido
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Física Cuántica ~
Clasificado en Física Cuántica ~
 Comentarios desactivados en Buscando lo desconocido
Comentarios desactivados en Buscando lo desconocido

No pocas veces nos han explicado lo que pasaría cerca de un objeto masivo

La gravedad y el magnetismo son dos fuerzas que pueden parecer similares a primera vista, sin embargo, éstas se manejan bajo principios completamente distintos, aunque estén relacionados entre sí. Mientras que la fuerza de gravedad ve su origen en la masa de los cuerpos y funciona con un nivel de aceleración, el magnetismo se origina desde la energía eléctrica. El magnetismo no influye sólo en la energía, también tiene cabida en otros temas como la química, ya que está presente en la unión de los átomos, la formación de moléculas y los diferentes estados de la materia.
Fuente: Diferencia entre gravedad y magnetismo
https://gravedad.net/diferencia-entre-gravedad-y-magnetismo
Las fuerzas que podemos sentir en la vida cotidiana, es decir, la Gravedad y el electromagnetismo, aumentan con la cercanía: así, cuando más cerca está un clavo de un imán o una manzana del suelo, más se verán atraídos.
Por el contrario, la interacción fuerte, encargada de mantener estable el núcleo de los átomos, disminuye cuanto más cerca y juntas están las partículas en el interior de los átomos, aumentando cuando las partículas se alejan las unas de las otras. Si los Quarks que forman los protones y también los neutrones, están juntos, la fuerza es débil. Sin embargo, cuando los Quarks se quieren separar los unos de los otros, los Gluones los agarran con la fuerza más poderosa del Universo y los mantiene confinados en su sitio para que la estabilidad atómica sea posible.
Es en el límite de distancias pequeñas entre quarks o, equivalentemente, de altas energías, que los quarks interactúan débilmente entre sí. La interacción fuerte puede estudiarse aproximada-mente en el límite de altas energías.
El descubrimiento de esta extraña propiedad, llamada libertad asintótica, supuso toda una revolución teórica en los años 70 (se publicó en 1.973), pero ya plenamente respaldada por los experimentos en los aceleradores de partículas, aconsejó, a la Academia, conceder 30 años más tarde, el Premio Nobel de Física a sus autores.
“Ha sido un gran alivio. He estado pensando en ello durante mucho tiempo”, comentó al enterarse de la noticia Franck Wilczek, uno de los tres premiados.
“No estaba claro que fuera un adelanto en aquel momento. La teoría que propusimos era descabellada en muchos aspectos y tuvimos que dar muchas explicaciones”, reconoció el investigador.”
Tanto Wilczek como Politzer eran aun aspirantes a doctores en 1.973, cuando publicaron su descubrimiento en Physical Review letters. Junto a su informe, la misma revista incluyó el trabajo de David Gross, que unido al de los dos estudiantes ha dado lugar a la celebrada teoría de la Cromodinámica Cuántica (QCD).
Siguiendo una arraigada costumbre de la Física de partículas, los investigadores emplearon nombres comunes y desenfadados para señalar sus nuevos descubrimientos y llamaron “colores” a las intrincadas propiedades de los quarks.
Por ello, su teoría es conocida en la actualidad por el nombre de Cromodinámica (cromo significa “color” en griego), a pesar de que no tienen nada que ver con lo que entendemos y llamamos color en nuestra vida cotidiana, sino con el modo en que los componentes del núcleo atómico permanecen unidos. En este sentido, resulta mucho más intuitiva, aunque no menos divertida, la denominación de las partículas que hacen posible la interacción fuerte, llamadas gluones (glue es “pegamento” en inglés).
Al igual que en la teoría electromagnética, las partículas pueden tener carga positiva o negativa, los componentes más diminutos del núcleo atómico pueden ser rojos, verdes o azules.
Además, de manera análoga a como las cargas opuestas se atraen en el mundo de la electricidad y el magnetismo, también los quarks de distinto color se agrupan en tripletes para formar protones y neutrones del núcleo atómico.
Pero estas no son las únicas similitudes, ni siquiera las más profundas, que existen entre las distintas fuerzas que rigen el Universo. De hecho, los científicos esperan que, en última instancia, todas las interacciones conocidas sean en realidad la manifestación variada de una sola fuerza que rige y gobierna todo el cosmos.


Según la Academia Sueca, el trabajo premiado a estos tres Físicos, “constituye un paso importante dentro del esfuerzo para alcanzar la descripción unificada de todas las fuerzas de la Naturaleza”. Lo que llamamos teoría del todo.

Según Frank Wiczek, que ahora pertenece al Instituto Tecnológico de Massachussets (MIT), su descubrimiento “reivindica la idea de que es posible comprender a la Naturaleza racionalmente”. El físico también recordó que “fue una labor arraigada en el trabajo experimental, más que en la intuición”, y agradeció “a Estados Unidos por un sistema de enseñanza pública que tantos beneficios me ha dado”.
Sabemos que los quarks (hasta el momento) son las partículas más elementales del núcleo atómico donde forman protones y neutrones. La interacción fuerte entre los quarks que forman el protón es tan intensa que los mantiene permanentemente confinados en su interior, en una región ínfima. Y, allí, la fuerza crece con la distancia, si los quarks tratan de separarse, la fuerza aumenta (confinamiento de los quarks), si los quarks están juntos los unos a los otros, la fuerza decrece (libertad asintótica de los quarks). Nadie ha sido capaz de arrancar un quark libre fuera del protón.


Con aceleradores de partículas a muy altas energías, es posible investigar el comportamiento de los quarks a distancias muchos más pequeñas que el tamaño del protón.
Así, el trabajo acreedor al Nobel demostró que la fuerza nuclear fuerte actúa como un muelle de acero, si lo estiramos (los quarks se separan), la fuerza aumenta, si lo dejamos en reposo, en su estado natural, los anillos juntos (los quarks unidos), la fuerza es pequeña.
Así que la Cromodinámica Cuántica (QCD) describe rigurosamente la interacción fuerte entre los quarks y, en el desarrollo de esta teoría, como se ha dicho, jugaron un papel fundamental los tres ganadores del Nobel de Física de 2004 cuyas fotos y nombres hemos puesto antes.

Trabajos y estudios realizados en el acelerador LEP del CER durante la década de los 90 han hecho posible medir con mucha precisión la intensidad de la interacción fuerte en las desintegraciones de las partículas z y t, es decir a energías de 91 y 1,8 Gev, los resultados obtenidos están en perfecto acuerdo con las predicciones de ACD, proporcionando una verificación muy significativa de libertad asintótica.
Ahora, estamos a la espera de utilizar la más alta energía jamás empleada en un Acelerador y, el LHC, se prepara para los 8 TeV que, ya veremos que nos podrá traer si, el Bosón de Higgs del que ya han podido atisbar algunos indicios o, por el contrario, partículas exóticas que, como los hipotéticos axiones nos lleven a otras teorías.
Emilio Silvera Vázquez
Feb
22
El “universo” de las partículas
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Física Cuántica ~
Clasificado en Física Cuántica ~
 Comments (1)
Comments (1)

Solo el 1% de las formas de vida que han vivido en la Tierra están ahora presentes, el 99%, por una u otra razón se han extinguido. Sin embargo, ese pequeño tanto por ciento de la vida actual, supone unos cinco millones de especies según algunas estimaciones. La Tierra acoge a todas esas especies u palpita de vida que prolifera por doquier. Hay seres vivos por todas partes y por todos los rincones del inmenso mosaico de ambientes que constituye nuestro planeta encontramos formas de vida, cuyos diseños parecen hechos a propósito para adaptarse a su hábitat, desde las profundidades abisales de los océanos hasta las más altas cumbres, desde las espesas selvas tropicales a las planicies de hielo de los casquetes polares. Se ha estimado la edad de 3.800 millones de años desde que aparecieron los primeros “seres vivos” sobre el planeta (dato de los primeros microfósiles). Desde entonces no han dejado de aparecer más y más especies, de las que la mayoría se han ido extinguiendo. Desde el siglo XVIII en que Carlos Linneo propuso su Systema Naturae no han cesado los intentos por conocer la Biodiversidad…, de la que por cierto nuestra especie, bautizada como Homo sapiens por el propio Linneo, es una recién llegada de apenas 200.000 años.

Ahora, hablaremos de la vida media de las partículas elementales (algunas no tanto). Cuando hablamos del tiempo de vida de una partícula nos estamos refiriendo al tiempo de vida media, una partícula que no sea absolutamente estable tiene, en cada momento de su vida, la misma probabilidad de desintegrarse. Algunas partículas viven más que otras, pero la vida media es una característica de cada familia de partículas.
También podríamos utilizar el concepto de “semivida”. Si tenemos un gran número de partículas idénticas, la semivida es el tiempo que tardan en desintegrarse la mitad de ese grupo de partículas. La semivida es 0,693 veces la vida media.
Si miramos una tabla de las partículas más conocidas y familiares (fotón, electrón muón tau, la serie de neutrinos, los mesones con sus piones, kaones, etc., y, los Hadrones bariones como el protón, neutrón, lambda, sigma, psi y omega, en la que nos expliquen sus propiedades de masa, carga, espín, vida media (en segundos) y sus principales maneras de desintegración, veríamos como difieren las unas de las otras.”
Algunas partículas tienen una vida media mucho más larga que otras. De hecho, la vida media difiere enormemente. Un neutrón por ejemplo, vive 10¹³ veces más que una partícula Sigma⁺, y ésta tiene una vida 10⁹ veces más larga que la partícula sigma cero. Pero si uno se da cuenta de que la escala de tiempo “natural” para una partícula elemental (que es el tiempo que tarda su estado mecánico-cuántico, o función de ondas, en evolucionar u oscilar) es aproximadamente 10ˉ²⁴ segundos, se puede decir con seguridad que todas las partículas son bastantes estables. En la jerga profesional de los físicos dicen que son “partículas estables”.

¿Cómo se determina la vida media de una partícula? Las partículas de vida larga, tales como el neutrón y el muón, tienen que ser capturadas, preferiblemente en grandes cantidades, y después se mide electrónicamente su desintegración. Las partículas comprendidas entre 10ˉ¹⁰ y 10ˉ⁸ segundos solían registrarse con una cámara de burbujas, pero actualmente se utiliza con más frecuencia la cámara de chispas. Una partícula que se mueve a través de una cámara de burbujas deja un rastro de pequeñas burbujas que puede ser fotografiado. La Cámara de chispas contiene varios grupos de de un gran número de alambres finos entrecruzados entre los que se aplica un alto voltaje. Una partícula cargada que pasa cerca de los cables produce una serie de descargas (chispas) que son registradas electrónicamente. La ventaja de esta técnica respecto a la cámara de burbujas es que la señal se puede enviar directamente a una computadora que la registra de manera muy exacta.

Una partícula eléctricamente neutra nunca deja una traza directamente, pero si sufre algún tipo de interacción que involucre partículas cargadas (bien porque colisionen con un átomo en el detector o porque se desintegren en otras partículas), entonces desde luego que pueden ser registradas. Además, realmente se coloca el aparato entre los polos de un fuerte imán. Esto hace que la trayectoria de las partículas se curve y de aquí se puede medir la velocidad de las partículas. Sin embargo, como la curva también depende de la masa de la partícula, es conveniente a veces medir también la velocidad de una forma diferente.

Una colisión entre un protón y un antiprotón registrada mediante una cámara de chispas del experimento UA5 del CERN.
En un experimento de altas energías, la mayoría de las partículas no se mueven mucho más despacio que la velocidad de la luz. Durante su carta vida pueden llegar a viajar algunos centímetros y a partir de la longitud media de sus trazas se puede calcular su vida. Aunque las vidas comprendidas entre 10ˉ¹³ y 10ˉ²⁰ segundos son muy difíciles de medir directamente, se pueden determinar indirectamente midiendo las fuerzas por las que las partículas se pueden transformar en otras. Estas fuerzas son las responsables de la desintegración y, por lo tanto, conociéndolas se puede calcular la vida de las partículas, Así, con una pericia ilimitada los experimentadores han desarrollado todo un arsenal de técnicas para deducir hasta donde sea posible todas las propiedades de las partículas. En algunos de estos procedimientos ha sido extremadamente difícil alcanzar una precisión alta. Y, los datos y números que actualmente tenemos de cada una de las partículas conocidas, son los resultados acumulados durante muchísimos años de medidas experimentales y de esa manera, se puede presentar una información que, si se valorara en horas de trabajo y coste de los proyectos, alcanzaría un precio descomunal pero, esa era, la única manera de ir conociendo las propiedades de los pequeños componentes de la materia.
¿Cómo se determina la vida media de una partícula? Las partículas de vida larga, tales como el neutrón y el muón, tienen que ser capturadas, …
Que la mayoría de las partículas tenga una vida media de 10ˉ⁸ segundos significa que son ¡extremadamente estables! La función de onda interna oscila más de 10²² veces/segundo. Este es el “latido natural de su corazón” con el cual se compara su vida. Estas ondas cuánticas pueden oscilar 10ˉ⁸ x 10²², que es 1¹⁴ o 100.000.000.000.000 veces antes de desintegrarse de una u otra manera. Podemos decir con toda la seguridad que la interacción responsable de tal desintegración es extremadamente débil.
Se habla de ondas cuánticas y también, de ondas gravitacionales. Las primeras han sido localizadas y las segundas están siendo perseguidas.
Aunque la vida de un neutrón sea mucho más larga (en promedio un cuarto de hora), su desintegración también se puede atribuir a la interacción débil. A propósito, algunos núcleos atómicos radiactivos también se desintegran por interacción débil, pero pueden necesitar millones e incluso miles de millones de años para ello. Esta amplia variación de vidas medias se puede explicar considerando la cantidad de energía que se libera en la desintegración. La energía se almacena en las masas de las partículas según la bien conocida fórmula de Einstein E = Mc². Una desintegración sólo puede tener lugar si la masa total de todos los productos resultantes es menor que la masa de la partícula original. La diferencia entre ambas masas se invierte en energía de movimiento. Si la diferencia es grande, el proceso puede producirse muy rápidamente, pero a menudo la diferencia es tan pequeña que la desintegración puede durar minutos o incluso millones de años. Así, lo que determina la velocidad con la que las partículas se desintegran no es sólo la intensidad de la fuerza, sino también la cantidad de energía disponible.
Si no existiera la interacción débil, la mayoría de las partículas serían perfectamente estables. Sin embargo, la interacción por la que se desintegran las partículas π°, η y Σ° es la electromagnética. Se observará que estas partículas tienen una vida media mucho más corta, aparentemente, la interacción electromagnética es mucho más fuerte que la interacción débil.
Durante la década de 1950 y 1960 aparecieron tal enjambre de partículas que dio lugar a esa famosa anécdota de Fermi cuando dijo: “Si llego a adivinar esto me hubiera dedicado a la botánica.”

Si la vida de una partícula es tan corta como 10ˉ²³ segundos, el proceso de desintegración tiene un efecto en la energía necesaria para producir las partículas ante de que se desintegre. Para explicar esto, comparemos la partícula con un diapasón que vibra en un determinado modo. Si la “fuerza de fricción” que tiende a eliminar este modo de vibración es fuerte, ésta puede afectar a la forma en la que el diapasón oscila, porque la altura, o la frecuencia de oscilación, está peor definida. Para una partícula elemental, esta frecuencia corresponde a su energía. El diapasón resonará con menor precisión; se ensancha su curva de resonancia. Dado que para esas partículas extremadamente inestable se miden curvas parecidas, a medida se las denomina resonancias. Sus vidas medias se pueden deducir directamente de la forma de sus curvas de resonancia.
Bariones Delta. Un ejemplo típico de una resonancia es la delta (∆), de la cual hay cuatro especies ∆ˉ, ∆⁰, ∆⁺ y ∆⁺⁺(esta última tiene doble carga eléctrica). Las masas de las deltas son casi iguales 1.230 MeV. Se desintegran por la interacción fuerte en un protón o un neutrón y un pión.
Existen tanto resonancias mesónicas como bariónicas . Las resonancias deltas son bariónicas. Las resonancias deltas son bariónicas. (También están las resonancias mesónicas rho, P).
Las resonancias parecen ser solamente una especie de versión excitada de los Hadrones estable. Son réplicas que rotan más rápidamente de lo normal o que vibran de diferente manera. Análogamente a lo que sucede cuando golpeamos un gong, que emite sonido mientras pierde energía hasta que finalmente cesa de vibrar, una resonancia termina su existencia emitiendo piones, según se transforma en una forma más estable de materia.
Por ejemplo, la desintegración de una resonancia ∆ (delta) que se desintegra por una interacción fuerte en un protón o neutrón y un pión, por ejemplo:
∆⁺⁺→р + π⁺; ∆⁰→р + πˉ; o п+π⁰
En la desintegración de un neutrón, el exceso de energía-masa es sólo 0,7 MeV, que se puede invertir en poner en movimiento un protón, un electrón y un neutrino. Un Núcleo radiactivo generalmente tiene mucha menos energía a su disposición.
El estudio de los componentes de la materia tiene una larga historia en su haber, y, muchos son los logros conseguidos y muchos más los que nos quedan por conseguir, ya que, nuestros conocimientos de la masa y de la energía (aunque nos parezca lo contrario), son aún bastante limitados, nos queda mucho por descubrir antes de que podamos decir que dominamos la materia y sabemos de todos sus componentes. Antes de que eso llegue, tendremos que conocer, en profundidad, el verdadero origen de la Luz que esconde muchos secretos que tendremos que desvelar.
Esperemos que con los futuros experimentos del LHC y de los grandes Aceleradores de partículas del futuro, se nos aclaren algo las cosas y podamos avanzar en el perfeccionamiento del Modelo Estándar de la Física de Partículas que, como todos sabemos es un Modelo incompleto que no contiene a todas las fuerzas de la Naturaleza y, cerca de una veintena de sus parámetros son aleatorios y no han sido explicados. Uno de ellos, el Bosón de Higgs, dicen que ha sido encontrado. Sin embargo, a mí particularmente me quedan muchas dudas al respecto.
Emilio Silvera Vázquez
















 Totales: 75.005.222
Totales: 75.005.222 Conectados: 25
Conectados: 25