Ene
1
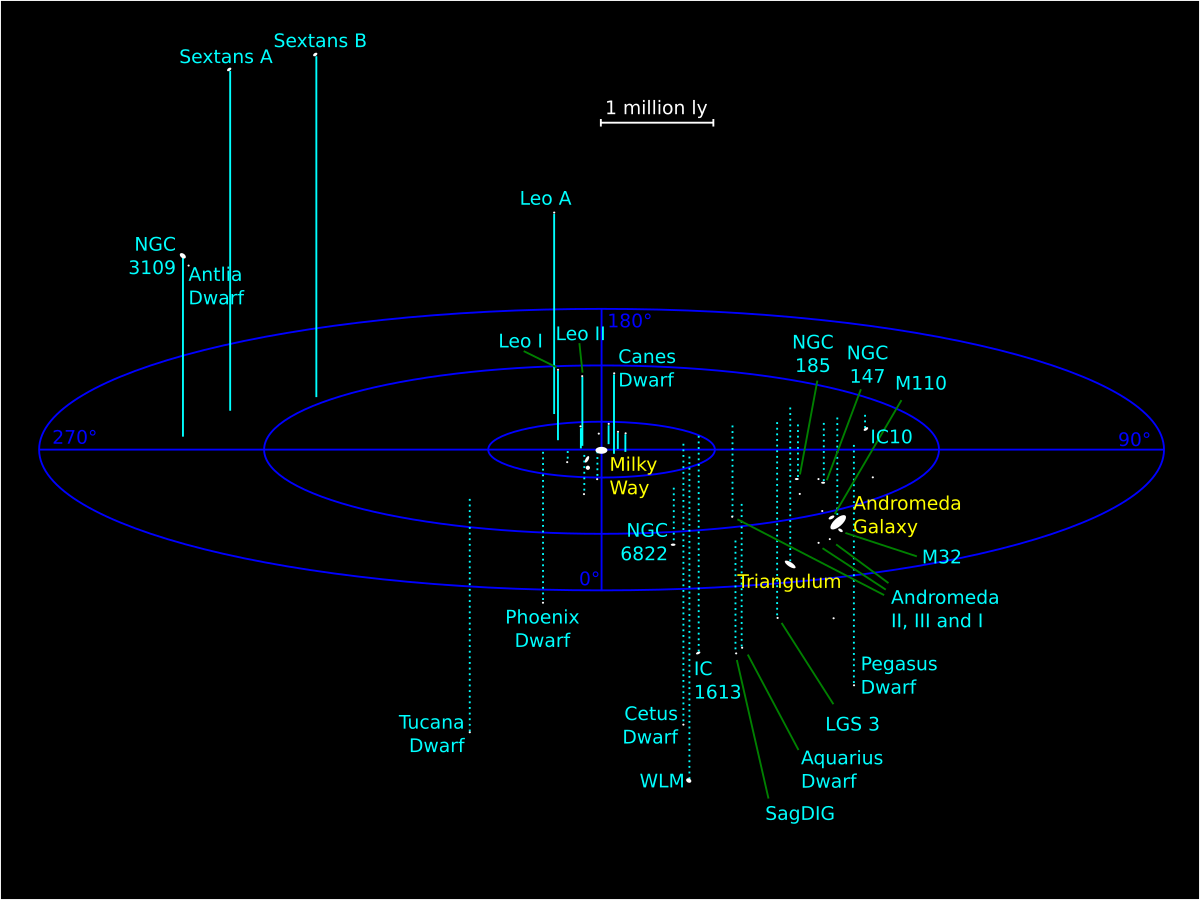
El Universo y la Vida… ¡Nuestra imaginación!
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en El Universo y la Vida ~
Clasificado en El Universo y la Vida ~
 Comments (0)
Comments (0)
Estamos tratando de recrear la creación



Si nos adentramos en el Espacio en una nave del suturo que pueda desplazarse a todas partes con la prestación de burlar a la velocidad de la luz (no de vencerla que es imposible), y, nos permitiría contemplar maravillados, paisajes de fantasía y objetos maravillosos, sería un viaje alucinante.



“Una inteligencia que conociese, en un momento determinado, todas las fuerzas que operan en la Naturaleza, así como las posiciones momentáneas de todas las cosas que constituyen el universo, sería capaz de condensar en una sola fórmula los movimientos de los cuerpos más grandes del mundo y los de los átomos más ligeros, siempre que su intelecto sea bastante poderoso para someter a análisis todos los datos
; para él nada sería incierto, el pasado y el futuro estarían presentes ante sus ojos.”

Inmensas galaxias cuajadas de estrellas, nebulosas y mundos. Espacios interestelares en los que se producen transmutaciones de materia que realizan el asombroso “milagro” de convertir unas cosas en otras distintas. Un Caos que lleva hacia la normalidad. Estrellas que explosionan y riegan el espacio de gas y polvo constituyentes de materiales en el que se forjarán nuevas estrellas, nuevos mundos y nuevas formas de vida.
la normalidad. Estrellas que explosionan y riegan el espacio de gas y polvo constituyentes de materiales en el que se forjarán nuevas estrellas, nuevos mundos y nuevas formas de vida.

No pocas veces nos tenemos que maravillar ante las obras de la Naturaleza, en ocasiones, con pinceladas de las propias obras que nosotros mismos hemos sido capaces de crear. Así, no es extraño que algunos piensen que la Naturaleza nos creó para conseguir sus fines, que el universo nos trajo aquí para poder contemplarse así mismo. Claro que, también habrá podido crear a otras criaturas con el mismo fin.
conseguir sus fines, que el universo nos trajo aquí para poder contemplarse así mismo. Claro que, también habrá podido crear a otras criaturas con el mismo fin.
Siempre hemos tratado de saber lo que el Universo es, lo que la Naturaleza esconde para conocer los mecanismos de que ésta se vale para poder hacer las maravcillas que podemos contemplar tanto en la tierra como en el cielo. Valles, ríos y montañas, hermosos bosques de lujuriante belleza , océanos inmensos llenos de formas de vida y, criaturas que, conscientes de todo eso, aunque algunas veces temerosas ante tanto poder, no por ello dejan de querer saber el origen de todo.

Es posible que nos creemos más de lo que en realidad somos. Queremos jugar con fuerzas que no hemos llegado a comprender y, desde las estrellas y las inmensas galaxias, hasta los mundos y las fuerzas que todo lo rigen en el Universo, hemos querido conocer para poder, con esos conocimientos, crear la misma creación. Los científicos han dado ya el primer paso para la creación de la vida sintética, han sido capaces de crear un cromosoma completo a partir de una célula de levadura. El logro es considerado un gran hallazgo dentro de la biología sintética, que busca diseñar organismos desde sus principios más básicos.
los mundos y las fuerzas que todo lo rigen en el Universo, hemos querido conocer para poder, con esos conocimientos, crear la misma creación. Los científicos han dado ya el primer paso para la creación de la vida sintética, han sido capaces de crear un cromosoma completo a partir de una célula de levadura. El logro es considerado un gran hallazgo dentro de la biología sintética, que busca diseñar organismos desde sus principios más básicos.
¿Hasta dónde queremos llegar?

A veces, viendo como se desarrollan las cosas y cómo se desenvuelven los hechos a medida que el Tiempo transcurre, no tenemos más remedio que pensar que parece como sí, la Naturaleza supiera que estamos aquí y, desde luego, nos tiene impuesto límites que no podemos traspasar hasta que “ella” no considera que estamos preparado para ello. Un amigo asiduo a éste lugar nos decía que la Naturaleza nos preserva de nosotros mismos. Nosotros, los humanos, no conocemos ninguna regla que nos prohíba intentar todo aquello que podamos imaginar y, de esa manera, a veces, jugamos a ser dioses.
luego, nos tiene impuesto límites que no podemos traspasar hasta que “ella” no considera que estamos preparado para ello. Un amigo asiduo a éste lugar nos decía que la Naturaleza nos preserva de nosotros mismos. Nosotros, los humanos, no conocemos ninguna regla que nos prohíba intentar todo aquello que podamos imaginar y, de esa manera, a veces, jugamos a ser dioses.

Pero, ¿acaso no somos, nosotros mismos universo? Dicen que genio es aquel que puede plasmar en realidad sus pensamientos y, aunque nos queda mucho camino por recorrer, lo cierto es que, hasta el momento
plasmar en realidad sus pensamientos y, aunque nos queda mucho camino por recorrer, lo cierto es que, hasta el momento presente, mucho de eso se ha plasmado ya. Es decir, hemos sabido de qué están hechas las estrellas, conocemos la existencias de las grandes estructuras del Universo constituidas por cúmulos y supercúmulos de galaxias, sabemos de mundos en los que, con mucha probabilidad puedan existir criaturas diversas que, conscientes o no, piensen, como
presente, mucho de eso se ha plasmado ya. Es decir, hemos sabido de qué están hechas las estrellas, conocemos la existencias de las grandes estructuras del Universo constituidas por cúmulos y supercúmulos de galaxias, sabemos de mundos en los que, con mucha probabilidad puedan existir criaturas diversas que, conscientes o no, piensen, como nosotros, en todos los secretos que el Universo esconde.
nosotros, en todos los secretos que el Universo esconde.

Sinceramente creo que, dentro de nosotros, están todas las respuestas a las preguntas que podamos plantear, toda vez que, como parte del Universo que somos, en nuestros genes, en lo más profundo de nuestras mentes están grabados todos los recuerdos y, siendo así, solo se trata de recordar para saber lo que pasó, para comprender los orígenes y, finalmente saber, el por qué estamos aquí y para qué. Nos hemos olvidado de que somos “polvo de estrellas”, los materiales que nos conforman se forjaron en los “hornos ” nucleares de los astros que brillan en el firmamento lejano. A temperaturas de millones de grados se pudieron fusionar los elementos que hoy están en nosotros. Una Supernova, hace miles de millones de años, hizo brillar el cielo con un resplandor cegador, una enorme región quedó sembrada de materiales en forma de Nebulosa que, con el paso de los eones, conformó un sistema planetario con un Sol central que le daba luz y calor a un pequeño planeta que, mucho después, llamaron Tierra. Los seres que allí surgieron y evolucionaron, eran el producto de grandes transiciones de fase y cambios que, desde el Caos hizo todo el recorrido necesario hasta la creación de la Vida consciente.
” nucleares de los astros que brillan en el firmamento lejano. A temperaturas de millones de grados se pudieron fusionar los elementos que hoy están en nosotros. Una Supernova, hace miles de millones de años, hizo brillar el cielo con un resplandor cegador, una enorme región quedó sembrada de materiales en forma de Nebulosa que, con el paso de los eones, conformó un sistema planetario con un Sol central que le daba luz y calor a un pequeño planeta que, mucho después, llamaron Tierra. Los seres que allí surgieron y evolucionaron, eran el producto de grandes transiciones de fase y cambios que, desde el Caos hizo todo el recorrido necesario hasta la creación de la Vida consciente.
De esa manera, sin lugar a ninguna duda, podemos hablar de un Universo viviente en el que, la materia evoluciona hasta la vida y los pensamientos. En el que en un carrusel sin fin surgen nuevas estrellas y nuevos mundos en los que, como en la Tierra, pasando el tiempo, también surgirá la vida que, podrá ser… ¡de tántas maneras! Una galaxia como la Vía Láctea puede tener más de cien mil millones de estrellas, en el universo pueden estar presentes más de cien mil millones de galaxias, los mundos que existen en una sola galaxia son cientos de miles de millones y, sabiendo todo eso, ¿Cómo poder pensar que la vida sea única en la Tierra?
tener más de cien mil millones de estrellas, en el universo pueden estar presentes más de cien mil millones de galaxias, los mundos que existen en una sola galaxia son cientos de miles de millones y, sabiendo todo eso, ¿Cómo poder pensar que la vida sea única en la Tierra?

La vida se abre paso… ¡imparable! El ajuste fino lo hace posible, y, como el Universo es igual en todas parte… ¡Lo que pasa en un lugar pasará en otro.

“…en alguna pequeña charca caliente, tendrían la oportunidad de hacer el trabajo
y organizarse en sistemas vivos…” Eso comentaba Darwin sobre lo que podría ocurrir en la Naturaleza. Hemos podido constatar la persistencia con la que la vida, se abre paso en este mundo, la hemos podido hallar en lugares tan insólitos como fumarolas marinas a más de 100 ºC, o en aguas con una salinidad extrema, o, a varios kilómetros de profundidad bajo tierra, o, nutriendose de metales, o metanógenas y alófilas y tantas otras infinitesimales criaturas que nos han causado asombro y maravilla.
Si, amigos míos, en lo que a la vida se refiere, ésta se abre paso en los lugares más extremos e inesperados por muy malas condiciones
que allí puedan estar presentes.De la misma manera, podrían estar situadas en mundos lejanos que, con unas condiciones distintas a las de la Tierra, se puedan haber creado criaturas que ni nuestra desbordante imaginación pueda configurar en la mente.
Hasta que supimos que existían otros sistemas planetarios en nuestra Galaxia, ni siquiera se podía considerar esta posibilidad como una prueba de que la vida planetaria fuera algo común en la Vía Láctea. Pero se sabe que más de cien estrellas de nuestra zona de la galaxia tienen planetas que describen órbitas alrededor de ellas. Casi todos los planetas descubiertos hasta ahora son gigantes de gas, como Júpiter y Saturno (como era de esperar, los planetas grandes se descubrieron primero, por ser más fáciles de detectar que los planetas pequeños), sin embargo es difícil no conjeturar que, allí, junto a estos planetas, posiblemente estarán también sus hermanos planetarios más pequeños que, como la Tierra, pudieran tener condiciones
posibilidad como una prueba de que la vida planetaria fuera algo común en la Vía Láctea. Pero se sabe que más de cien estrellas de nuestra zona de la galaxia tienen planetas que describen órbitas alrededor de ellas. Casi todos los planetas descubiertos hasta ahora son gigantes de gas, como Júpiter y Saturno (como era de esperar, los planetas grandes se descubrieron primero, por ser más fáciles de detectar que los planetas pequeños), sin embargo es difícil no conjeturar que, allí, junto a estos planetas, posiblemente estarán también sus hermanos planetarios más pequeños que, como la Tierra, pudieran tener condiciones para generar la vida en cualquiera de sus millones de formas.
para generar la vida en cualquiera de sus millones de formas.
Es cierto que en todo el Universo rigen las mismas leyes y están presentes las mismas constantes universales que, ni con el paso del tiempo pueden variar, así la luz siempre irá a 300.000 Km/s, la carga del electrón será siempre la misma como
del electrón será siempre la misma como la masa del protón y, gracias a que eso es así, podemos estar nosotros aquí para
la masa del protón y, gracias a que eso es así, podemos estar nosotros aquí para contarlo. Sin embargo, el Universo, no es uniforme y en el inmenso espacio interestelar impera la diversidad.
contarlo. Sin embargo, el Universo, no es uniforme y en el inmenso espacio interestelar impera la diversidad.

Existe una amplia variedad de densidades dentro del medio interestelar. En la modalidad más ligera, la materia que está entre las estrellas es tan escasa que sólo hay un átomo por cada mil centímetros cúbicos de espacio: en la modalidad más densa, las nubes que están a punto de producir nuevas estrellas y nuevos planetas contienen un millón de átomos por centímetro cúbico. Sin embargo, esto es algo muy diluido si se compara con el aire que respiramos, donde cada centímetro cúbico contiene más de diez trillones de moléculas, pero incluso una diferencia de mil millones de veces en densidad sigue siendo un contraste espectacular.
mil centímetros cúbicos de espacio: en la modalidad más densa, las nubes que están a punto de producir nuevas estrellas y nuevos planetas contienen un millón de átomos por centímetro cúbico. Sin embargo, esto es algo muy diluido si se compara con el aire que respiramos, donde cada centímetro cúbico contiene más de diez trillones de moléculas, pero incluso una diferencia de mil millones de veces en densidad sigue siendo un contraste espectacular.
La cuestión es que, unos pocos investigadores destacaron allá por 1.990 en que todos estos aspectos -composición, temperatura y densidad- en el medio interestelar dista mucho de ser uniforme. Por decirlo de otra manera más firme, no está en equilibrio, y parece que lo que lo mantiene lejos del equilibrio son unos pocos de procesos asociados con la generación de las pautas espirales.
pocos investigadores destacaron allá por 1.990 en que todos estos aspectos -composición, temperatura y densidad- en el medio interestelar dista mucho de ser uniforme. Por decirlo de otra manera más firme, no está en equilibrio, y parece que lo que lo mantiene lejos del equilibrio son unos pocos de procesos asociados con la generación de las pautas espirales.

Aquí se crea entropía negativa. También nosotros, tenemos una manera de vencer a la inexorable Entropía que siempre acompaña al Tiempo, su transcurrir deja sentir sus efectos sobre las cosas que se hacen más viejas. Sin embargo, sabemos, como las galaxias, generar energía reproductora y, mientras que las galaxias crean estrellas nuevas y mundos, nosotros, recreamos la vida a partir de la unión entr hombre y mujer, y, de esa unión surgen otros seres que, perpetúan nuestra especie. Es la entropía negativa que lucha contra la extinción.
nosotros, tenemos una manera de vencer a la inexorable Entropía que siempre acompaña al Tiempo, su transcurrir deja sentir sus efectos sobre las cosas que se hacen más viejas. Sin embargo, sabemos, como las galaxias, generar energía reproductora y, mientras que las galaxias crean estrellas nuevas y mundos, nosotros, recreamos la vida a partir de la unión entr hombre y mujer, y, de esa unión surgen otros seres que, perpetúan nuestra especie. Es la entropía negativa que lucha contra la extinción.
Esto significa que la Vía Láctea (como otras galaxias espirales) es una zona de reducción de la entropía. Es un sistema auto-organizador al que mantienen lejos del equilibrio, por una parte
otras galaxias espirales) es una zona de reducción de la entropía. Es un sistema auto-organizador al que mantienen lejos del equilibrio, por una parte , un flujo de energía que atraviesa el sistema y, por otra, como ya se va viendo, la retroalimentación. En este sentido, nuestra Galaxia supera el test de Lovelock para la vida, y además prestigiosos astrofísicos han argumentado que las galaxias deben ser consideradas como sistemas vivos.
, un flujo de energía que atraviesa el sistema y, por otra, como ya se va viendo, la retroalimentación. En este sentido, nuestra Galaxia supera el test de Lovelock para la vida, y además prestigiosos astrofísicos han argumentado que las galaxias deben ser consideradas como sistemas vivos.

Puede que podamos ser más de lo que parece y que, seamos menos de lo que nosotros mismos nos podamos creer. No parece muy aconsejable que estemos situados en un plano de superioridad en el cual podamos mirarlo todo por encima del hombro. Precisamente por ser Naturaleza nosotros mismos, estamos supeditados a sus cambios y, por lo tanto, a merced de ellos.
que podamos ser más de lo que parece y que, seamos menos de lo que nosotros mismos nos podamos creer. No parece muy aconsejable que estemos situados en un plano de superioridad en el cual podamos mirarlo todo por encima del hombro. Precisamente por ser Naturaleza nosotros mismos, estamos supeditados a sus cambios y, por lo tanto, a merced de ellos.
El problema está, como dijo aquel hombre sabio: “¡Somos parte del problema que tratamos de resolver!”
Emilio Silvera V.
Ene
1
La Gravedad, esa fuerza misteriosa
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en General ~
Clasificado en General ~
 Comments (0)
Comments (0)
Hace algún tiempo que dos nuevos estudios, realizados por investigadores de Australia, Austria y Alemania han puesto en entredicho la forma en la que entendemos la física de la gravedad. Los descubrimientos, publicados en las revistas Astrophysical Journal y Monthly Notices of the Royal Astronomical Society, se basan en observaciones de galaxias enanas satélite o galaxias más pequeñas que se encuentran en el extrarradio de la gran galaxia espiral que es la Vía Láctea.
“Las galaxias enanas son las más pequeñas que se conocen, y podrían ser la clave para la comprensión de la materia oscura y del proceso por el cual se forman las galaxias más grandes. … Las galaxias satélite son pequeños objetos celestes que orbitan alrededor de las galaxias más grandes, como nuestra propia Vía Láctea.”
La Ley de la gravitación universal de Newton, publicada en 1687, sirve para explicar cómo actúa la gravedad en la Tierra, por ejemplo por qué cae una manzana de un árbol. El profesor Pavel Kroupa del Instituto de Astronomía Argelander de la Universidad de Bonn (Alemania) explicó:
«A pesar de que su ley describe los efectos cotidianos de la gravedad en la Tierra, las cosas que podemos ver y medir, cabe la posibilidad de que no hayamos sido capaces de comprender en absoluto las leyes físicas que rigen realmente la fuerza de la gravedad».
Se supone que la “materia oscura” permea todo el Universo
La ley de Newton ha sido puesta en entredicho por distintos cosmólogos modernos, los cuales han redactado teorías contradictorias sobre la gravitación que intentan explicar la gran cantidad de discrepancias que se dan entre las mediciones reales de los sucesos astronómicos y las predicciones basadas en los modelos teóricos. La idea de que la «materia oscura» pueda ser la responsable de estas discrepancias ha ganado muchos adeptos durante los últimos años. No obstante, no existen pruebas concluyentes de su existencia.
En esta investigación, el profesor Kroupa y varios colegas examinaron «galaxias enanas satélite», cientos de las cuales deberían existir en la cercanía de las principales galaxias, incluida la Vía Láctea, según indican los modelos teóricos. Se cree que algunas de estas galaxias menores contienen tan sólo unos pocos millares de estrellas (se estima que la Vía Láctea, por ejemplo, contiene más de 200.000 millones de estrellas).
No obstante, a día de hoy sólo se ha logrado detectar treinta de estas galaxias alrededor de la Vía Láctea. Esta situación se atribuye al hecho de que, al contener tan pocas estrellas, su luz es demasiado débil como para que podamos observarlas desde una distancia tan lejana. Lo cierto es que este estudio tan detallado ha deparado resultados sorprendentes.

«En primer lugar, hay algo extraño en su distribución», indicó el profesor Kroupa. «Estas galaxias satélite deberían estar distribuidas uniformemente alrededor de su galaxia madre, pero no es el caso.»
Distribución de las pequeñas galaxias alrededor de la Vía Láctea que, al ser un cuerpo de mayor masa, las atrae hacia sí como ocurre con la Pequeña Nube de Magallanes.
Los investigadores descubrieron que la totalidad de los satélites clásicos de la Vía Láctea (las once galaxias enanas más brillantes) están situados prácticamente en un mismo plano que dibuja una especie de disco. También observaron que la mayoría de estas once galaxias rotan en la misma dirección en su movimiento circular alrededor de la Vía Láctea, de forma muy similar a como lo hacen los planetas alrededor del Sol.
La explicación de los físicos a estos fenómenos es que los satélites debieron surgir de una colisión entre galaxias más jóvenes. «Los fragmentos resultantes de un acontecimiento así pueden formar galaxias enanas en rotación», explicó el Dr. Manuel Metz, también del Instituto de Astronomía Argelander. Éste añadió que «los cálculos teóricos nos indican la imposibilidad de que los satélites creados contengan materia oscura».
Estos cálculos contradicen otras observaciones del equipo. «Las estrellas contenidas en los satélites que hemos observado se mueven a mucha más velocidad que la predicha por la Ley de la gravitación universal. Si se aplica la física clásica, esto sólo puede atribuirse a la presencia de materia oscura», aseveró el Dr. Metz.
Este enigma nos indica que quizás se hayan interpretado de forma incorrecta algunos de los principios fundamentales de la física. «La única solución posible sería desechar la Ley de la gravitación de Newton», indicó el profesor Kroupa. «Probablemente habitemos un universo no Newtoniano. De ser cierto, nuestras observaciones podrían tener explicación sin necesidad de recurrir a la materia oscura.»
Hasta ahora, la Ley de la gravitación de Newton sólo ha sido modificada en tres ocasiones: para incluir los efectos de las grandes velocidades (la teoría especial de la relatividad), la proximidad de grandes masas (la teoría general de la relatividad) y las escalas subatómicas (la mecánica cuántica). Ahora, las graves inconsistencias reveladas por los datos obtenidos sobre las galaxias satélite respaldan la idea de que hay que adoptar una «dinámica newtoniana modificada» (MOND) para el espacio.
La teoría MOND, propuesta en 1981, modifica la segunda ley de la dinámica de Newton para que con ella se pueda explicar la rotación a velocidad uniforme de las galaxias, que contradice las predicciones newtonianas que afirman que la velocidad de los objetos separados del centro será menor.
Los nuevos descubrimientos poseen implicaciones de gran calado para la física fundamental y para las teorías sobre el Universo. Según el astrofísico Bob Sanders de la Universidad de Groningen (Países Bajos), «los autores de este artículo aportan argumentos contundentes. Sus resultados coinciden plenamente con lo predicho por la dinámica newtoniana modificada, pero completamente contrarios a la hipótesis de la materia oscura. No es normal encontrarse con observaciones tan concluyentes.»
Para más información, consulte:
Instituto Argelander de Astronomía:
http://www.astro.uni-bonn.de
Astrophysical Journal:
http://www.iop.org/EJ/journal/apj
Monthly Notices of the Royal Astronomical Society:
http://www.wiley.com/bw/journal.asp?ref=0035-8711
La Fuerza o Interacción Gravitacional, siempre ha causado controversias en el sentido de que, a pesar de Newton y de Einstein con su la Relatividad, contiene rincones oscuros en los que no hemos podido entrar y son causantes de dudas y controversias. Acordaos de aquella teoría de Dirac en la que decía que la Gravedad, con el paso del tiempo sería cambiante.
La Gravedad, se niega a entrar en el Modelo Estándar, y, el Gravitón no aparece
Lo cierto es que, de las cuatro fuerzas fundamentales de la Naturaleza, es la Gravedad la que siempre nos ha causado más problemas para entenderla plenamente. Claro que, la ciencia no se para, las investigaciones y las observaciones continúan sin cesar, y, surgen nuevas teorías que tratan de despejar aquellas incógnitas que todavía nos ponen ante la duda y no permiten el conocimiento pleno.
Esperemos que en un futuro próximo, lleguemos a despejar todas aquellas dudas que sobre ésta fuerza elemental de la Naturaleza aún tenemos.
Emilio Silvera
Ene
1
¿Cómo sujetar los pensamientos?
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Viajar al pasado ~
Clasificado en Viajar al pasado ~
 Comments (4)
Comments (4)
Dentro de nuestras mentes se crean torbellinos de pensamientos que debemos ordenar. Andamos sumergidos en la espesa niebla de nuestra ignorancia y no siempre, sabemos “ver” con la claridad sificiente y necesaria cómo es el mundo. En escritos míos anteriores, me he referido a la teoría expuesta de manera magistral por el reconocido físico teórico Kip S. Thorne. Él cree firmemente que en el futuro será posible viajar al pasado a través de un agujero de gusano. Para que las bocas de entrada aquí, y la de salida “allí” -pongamos por ejemplo, que el allí está en Andrómeda- se mantengan abiertas, es necesario que dispongamos de energía exótica como la que se produce en las placas del Efecto Casimir.
Es el mayor secreto que el Universo esconde, lo que pasa dentro de nuestras Mentes, los torbellinos de ideas y pensamientos que se generan en nuestros cerebros y, a veces, sentimos la frustración de no comprender.
De la manera que vemos avanzar la ciencia, negar cualquier posibilidad futura, me parece al menos arriesgado y de tal maravilla, podría ser posible algún día muy lejos en el futuro, ¿quién sabe? si puede llegar a ser realidad. Sin embargo, hay que puntualizar algunas cosas.
- Todos hemos oído contar, hemos leído o hemos visionado alguna película en la que el personaje principal viaja al pasado, se encuentra con su abuelo, se pelea con él y lo mata, y así, ni su padre ni él mismo pudieron nacer.
- También se podría viajar al pasado, matar a Hitler y evitar el holocausto judío.
- O impedir la crucifixión de Cristo.
- O…
¡Pues va a ser que no! Los mecanismos del universo no permitirían tales acciones que cambiarían el curso de una historia que ya tuvo muchas consecuencias, y, como decía Hawking, alguna clase de censura cósmica, lo impedirá.
Si Thorne tiene razón y alguna vez vamos al pasado, a un mundo que fue y que no es el nuestro, creo que las leyes de la física impedirán que nuestra presencia fuese material y que nuestras acciones pudieran incidir en los hechos para cambiar su curso; eso es imposible. Cuando el suceso pasó no estábamos allí, y, por eso pasó de esa manera y, ahora, por mucho que queramos, no podremos cambiar ese hecho pasado. El Jarrón roto y hecho añicos nunca se podrá recomponer.

El Tiempo, eso que no sabemos explicar lo que es, tiene mucho que decir. Es el único testigo con “vida” desde que se produjo el Big Bang, él estuvo presente y ha sido testigo de todo el transcurrir de acontecimientos: Formación de partículas, nacimientos de las familias de Quarks, Leptones y Hadrones, los átomos, las moléculas y los cuerpos, la liberación de los fotones, el nacimiento de las estrellas y la creación de las galaxias, los mundos y… ¡La Vida!

Es posible que algún día podamos visitar el pasado como hologramas, sin poder incidir en él
Nuestra presencia allí sería incorpórea, holográfica, o, de cualquier otra manera en la que podríamos ver, observar, mirar con fascinación de manera directa lo que allí pasó, ser testigos de hechos históricos (seguramente sería una forma de turismo del futuro), pero no nos estaría permitido intervenir. Además, si eso algún día fuese posible, también es dudoso que las personas de aquel lugar de época remota, pudieran vernos, ya que, en realidad, nosotros en aquel momento no estábamos allí.

Investigadores nipones lograron crear el primer holograma
Lo que ya pasó es irreversible. No podemos físicamente retrotraer el tiempo para borrar lo que pasó. Cuando una estrella muere por haber agotado su combustible nuclear de fusión, explota como Supernova y crea una Nebulosa y un Agujero negro… ¿Cómo podríamos cambiar eso un millón de años más tarde, aunque consiguiéramos viajar al pasado?
Cuando un astrofísico mira una galaxia que está a 1.000 millones de años-luz de nosotros, está mirando el pasado. La galaxia que ve es la galaxia que fue hace 1.000 millones de años, que es el tiempo que ha tardado su imagen en llegar a nosotros viajando a la velocidad de la luz. No estamos capacitados de ninguna manera para poder observar esa galaxia tal y como es ahora; la distancia que la separa de nosotros tiene que ser recorrida, y el viaje duró mil millones de años, así que cuando lleguemos allí, la galaxia habrá evolucionado y será muy diferente a como era cuando iniciamos el viaje.
El Universo también tiene (como todo) su lado oscuro en el que se ocultan maravillas que deseamos desvelar. Las distancias en el Cosmos (para nosotros) han sido inalcanzables y nos valemos de la tecnología para desvelar secretos bien escondidos.
Los astrónomos creen haber hallado el objeto más lejano jamás divisado en el universo: una galaxia muy distante en el tiempo y en el espacio. Semioculto en una foto captada por el Telescopio Espacial Hubble y dado a conocer este año, se encuentra un corpúsculo de luz que los astrónomos europeos calculan es una galaxia de hace 13.100 millones de años. Es un momento en que el universo era muy joven, de apenas 600 millones de años. De confirmarse, será el objeto más antiguo y más distante hallado hasta la fecha y, la galaxia, probablemente ni exista ya.

El rayo de luz que es atraído por un agujero negro y desaparece en la singularidad, no puede volver para que lo podamos ver de nuevo. Allí, en ese lugar extraño y desconocido, se pierde toda la información y, si no explota y esparce todo su contenido, la información se perderá para siempre.
La entropía del universo es irreversible; el deterioro de los sistemas cerrados es imparable. Todo se transforma para convertir las cosas en otras diferentes. Son las leyes del universo, y a nosotros, simples mortales, sólo nos queda tratar de comprenderlas para obtener de ellas “tal como son” el mayor beneficio posible. Cuando la ambición o la inconsciencia nos lleva a querer cambiar las leyes del universo y de su naturaleza, el resultado no puede ser bueno. Somos nosotros los que tenemos que adaptarnos al medio y no al revés (excepto cuando por medios artificiales preparamos el medio para nuestro beneficio, pero simplemente adaptándolo y no cambiándolo).
Todas estas razones y muchas más que podrían exponerse aquí son las que impedirán algún día muy lejano de nuestro futuro, cambiar el pasado que, según mi opinión, es inamovible. ¡Ah!, y en contra de lo que dice en su libro Jean Bouchart, creo que todo lo que ocurre está causado por lo que ocurrió. Es lo que los físicos llaman causalidad. Nada ocurre porque sí, todo tiene su causa.

- Si de verdad amas, te amarán.
- Si estudias, aprenderás.
- Si eres un vago, te llegará la miseria y la degradación.
- Si haces lo que te gusta, serás más feliz.
Todo es la consecuencia de lo que hacemos. Igualmente, en nuestro mundo y en nuestro universo, rige la misma ley: si contaminas el planeta, se deteriorará el medio ambiente y morirá la atmósfera que ahora nos da la vida. Si una estrella agota su combustible nuclear, morirá, dejará de brillar y se convertirá en un objeto diferente. Todo es así.
Mi consejo: que nuestro comportamiento no sea nunca causante de males ajenos; que nos conformemos y sepamos valorar lo que tenemos; que tratemos cada día de ser mejores adquiriendo nuevos conocimientos, el verdadero sustento del ser. Cuanto más sabemos, más podemos ofrecer a los demás y a nuestro propio “espíritu”.

Seguramente, el verdadero amor es el único que nos salvará. En el último momento, surgirá en nosotros esa llama interior que llevamos dentro en la que se concentra todo lo bueno. El mal será rechazado y estaremos en un Universo mejor, más igual para todos, más justo y en el que, la dignidad de las personas estará asegurada. Quien trata de humillar a otro y despojarle de su dignidad, no es consciente de que en realidad, es su dignidad la que se verá resentida por tan vil acción.
Vemos comportamientos que nos hacen sentir verguenza
En mi transcurrir cotidiano, por mi trabajo, veo con mucha pena cómo las personas tratan de engañarse las unas a las otras. Es la forma general, y lo excepcional es el encontrar, muy de tarde en tarde, personas decentes y honradas, mejor o peor preparadas (qué más da) pero nobles de espíritu y limpias de corazón; cuando eso ocurre, es como una ráfaga de aire fresco y perfumado que inunda los sentidos.
Como lo normal es todo lo contrario, la fealdad interior, el engaño, la ausencia de moralidad y de ética, la traición de los “amigos” o familiares, etc., mi remedio es bien sencillo: me encierro en mi mundo particular de la física, la astronomía y, en definitiva, de cualquier rama del saber que esté presente en ese momento en mis pensamientos, y de esa forma, por unos momentos, me olvido de la fea verdad que nos rodea. La bondad y el amor sólo aparecen en efímeras ráfagas que rápidamente se esfuman y desaparecen, excepto en ámbitos como el seno famliar. Ahí, dentro de la familia -la esposa, los hijos, nietos hermanos y los padres… se desencadena un alto índice de ternura que hace florecer lo lo mejor de nosotros. En el seno familiar podemos sentir las bocanadas de aire puro y perfumado inexistentes en otro lugar. En algunos casos, ese estado de amor y de ternura se extiende hacia todos los demás.
Estamos en un mundo frío, cada cual campa a lo suyo y, por lo general, los demás sólo son instrumentos para conseguir nuestros objetivos. Nuestro mundo está cambiando, ya está regido por Ordenadores personalizados que atienden a nuestras instrucciones y se ocupan de necesidades cotidianas en la casa, en la oficina, en la fábrica y que son capaces de realizar planteamientos matemáticos en minutos, cosa que los seres vivos no pueden hacer a pesar de ser ellos los inventores del prodigio. No veo nada claro el devenir de la Humanidad.
Pasemos a otras cuestiones. En enero de 2.007, comenzó y se celebró en la India el 20 International Joint Conference of Artificial Intelligence, un encuentro en el que se pusieron al día todos los avances en inteligencia artificial, y donde fue celebrado el 50 cumpleaños de su creación.
El incremento de los resultados en este campo (mucho hemos hablado aquí de ello), ha sido asombroso. Internet es una buena prueba de ello en la búsqueda de información por contenido, comercio electrónico, sistemas de recomendación, web semántica, etc. el futuro de Internet, de la industria y del comercio, de las ciudades futuras, de los viajes espaciales, de la medicina, etc., etc., etc., dependerán de los progresos que se realicen en el ámbito de la inteligencia artificial y en la nanotecnología; ahí parecen estar el progreso del futuro.

Hemos llegado a fabricar “clones” artificiales que cuesta identificar de los originales y… ¡Esto no ha hecho más que empezar! ¿Dónde acabará todo?
La inteligencia artificial, entre otras cosas, podrá llevar y facilitar información a países subdesarrollados que, de esta manera, podrá ofrecer educación a sus habitantes, mejorará la salud de la población, su agricultura, etc. la calidad de vida, en definitiva.
Ya se están desarrollando en Japón los ordenadores inteligentes (los llamados de quinta generación), y el entusiasmo de empresas informáticas japonesas y estadounidenses por la inteligencia artificial aconsejó a Europa no quedarse atrás y acometer sus propios proyectos mediante programas de investigación en estas nuevas tecnologías del futuro.

El término de inteligencia artificial, si no me falla la memoria, se acuñó en la reunión de Dartmouth en 1.956, que fue un evento único e histórico. Único porque no se volvió a celebrar, es decir, no fue el primero de una serie como ocurre con los congresos internacionales que se llevan celebrando 20 años; y fue histórico por el hecho de que allí se acuñó el término que ha prevalecido de inteligencia artificial.
En DartMouth se presentó un único resultado: un programa llamado Logic Theorist, capaz de demostrar teoremas de lógica proporcional contenidos (según leí) en la famosa obra “Principia Matematica” de Bertrand Russell y Alfred Whitehead (la obra más famosa de Newton lleva el mismo título). El programa lo desarrollaron Herbert Simón (que en 1.978 recibió el premio Nobel de Economía), Alan Newell y Clifford Shaw. Sin embargo, en éste de enero en la India, se presentaron 470 resultados seleccionados entre los casi 1.400 que recibieron.
Estatua de Alan Turing y su retrato de fondo y a la derecha su máquina precursora
Desde aquella reunión del 56, los hitos alcanzados en el campo de la IA han sido extraordinarios: desde jugar al ajedrez hasta diagnosticar enfermedades, comprender textos sobre temas concretos que implican conocimientos especializados… No obstante, el objetivo de desarrollar las inteligencias artificiales generales que los pioneros de esta ciencia, reunidos en 1.956, propusieron para ser alcanzados, quedan aún muy lejanos. Pero, todo llegará; todo es cuestión de ¡tiempo!
Esta ciencia le debe mucho a las matemáticas. Alan Turing es un ejemplo. Fue un gran matemático que formalizó conceptos tan básicos para la informática como el concepto de algoritmo y el concepto de calculabilidad mediante la denominada Máquina de Turing, lo que nos lleva a considerar a Turing como a uno de los “padres” de la informática y, más concretamente, de la informática teórica. En 1.950 publicó un ensayo, “Computing Machinery and Intelligence”, donde describió su famoso Test de Turing, según el cual se podría determinar si una máquina es o no inteligente. La IA le debe pues el test que lleva su nombre, pero la informática le debe más.

Estamos tratando de crear cerebros positrónicos en los que se desarrollen los pensamientos propios y… ¡hasta los sentimientos! ¿No estaremos queriendo ir demasiado lejos? Está claro que la IA se aliará y formará equipo con la biología y la nanotecnología, y de esta unión surgirán avances que ahora ni podemos imaginar en nuestra actual comprensión (limitada) de la inteligencia artificial.
Como siempre me ocurre, cuando me pongo a escribir mis pensamientos vuelan, parece que estoy estableciendo una conversación conmigo mismo y traslado lo que se ella surge a la pantalla del ordenador, donde quedan plasmados todos los pensamientos presentes en mi cerebro en ese momento. En esas líneas de letras quiero expresar lo que recuerdo, lo que he leído, lo que he estudiado del tema que en ese momento ocupa mi atención, y así ocurre que, no siendo infalible, los errores pueden ser muchos y algunas explicaciones o comentarios poco documentados (consulto muy poco escribiendo y me dejo llevar), por lo que pido disculpas. Sin embargo, mis lectores -que son buenos amigos-, ganan en frescura y espontaneidad; el texto es más natural y en él están ausentes las artificialidades. Creo que salen ganando.

Lo que quería decir antes -como otras veces me he ido por las ramas-, es que puedo comenzar hablando de una cuestión y terminar hablando de otra muy distinta. Me vienen a la mente temas diversos, y de manera natural, sigo mis pensamientos y así lo reflejo en la blanca pantalla.
¿No resulta más ameno? De todas formas, siempre trato de finalizar los temas. Básicamente soy un insaciable buscador de la razón de ser de las cosas; todo me parece interesante. Mi curiosidad es ilimitada y mi vehemencia y pasión me llevan, a veces, a olvidarme de comer o (más grave aún), de recoger a mi mujer, que en un pueblo cercano espera mi llegada como habíamos quedado. Son cosas corrientes de mi manera de ser, que cuando emprendo una tarea, una lectura, o un proyecto, lo quiero tener terminado antes de… ¡haberlo comenzado!

Leo cualquier titular en un periódico: “Instalan un observatorio bajo el hielo para estudiar los confines del cosmos. Cuando esté en marcha, los científicos esperan que detecte 1.000 colisiones diarias de neutrinos, partículas minúsculas que nos traen información del universo.” No puedo, a partir de ahí, evitar el comprar el periódico o la revista para leer todo el reportaje completo, aunque sé que no dirán nada que ya no sepa sobre los neutrinos y la manera de cazarlos en las profundidades de la Tierra, en profundas minas abandonadas en las que colocan tanques de agua pesada que, conectados a potentes ordenadores, detectan la presencia de estas diminutas partículas -al parecer- carentes de masa que pertenecen a la familia de los leptones.
Cada segundo que pasa, billones de estas minúsculas partículas invisibles llamadas neutrinos, atraviesan nuestros cuerpos, en muchos casos, después de haber recorrido de un confín a otro todo el universo. Sin que nos demos cuenta estamos conectados con el otro extremo del Cosmos por medio de las conexiones invisibles que su Naturaleza impone. De hecho, somos parte de ese inmenso Universo que tratamos de conocer.
Los neutrinos, al contrario que los fotones, viajan sin cesar de un lado a otro del universo sin que ningún campo magnético los desvíe de su camino, y sin ser destruidos tras colisionar con otras partículas, ya que apenas poseen carga eléctrica ni interaccionan con la materia. Por ello, estudiar de cerca un neutrino permitiría descubrir su procedencia y aportaría a los científicos una valiosa información sobre los rincones del universo de los que provienen.
El problema que se plantea es que agarrar un neutrino no es tarea nada fácil, y aunque se cree que el neutrino puede ser el mensajero cósmico ideal, primero habrá que retenerlo para poder hacer la comprobación. Esta partícula fue anunciada o prevista su existencia por Wolfgan Pauli, y su nombre, neutrino (pequeño neutro en italiano), se lo puso el físico Enrico Fermi. Pauli quiso quiso así, con la existencia del neutrino, explicar dónde estaba la masa perdida en la fusión nuclear de la materia, en los fenómenos producidos por la radiación inducida por la fuerza nuclear débil. El neutrino era la explicación: La masa “perdida” se eyectaba al espacio en forma de energía representada por los neutrinos.

Aunque parezca no venir a cuento, me viene a la mente que el fin de la Edad de Hielo, hace 300 millones de años fue precedido por bruscos cambios en el nivel de dióxido de carbono (CO2), alteraciones violentas del clima y efectos drásticos sobre la vegetación del planeta. Pero, ¡¿qué estamos haciendo ahora?! La irresponsabilidad de algunos seres humanos es ilimitada.
Hace 300 millones de años, el hemisferio sur del planeta estaba casi totalmente cubierto por el hielo; los océanos del norte eran una sola masa gélida y los trópicos estaban dominados por espesas selvas, pero 40 millones de años después, el hielo había desaparecido; el mundo era un lugar ardiente y árido. La vegetación era escasa y los vientos secos soplaban sobre una superficie donde casi no había vegetación. Sólo un reptil podría sobrevivir en aquellas condiciones.
Ahora parece que estamos decididos a repetirlo. ¿Qué hará Gaia para defenderse? Creo que hará lo que estime necesario para preservar su integridad, y si para ello es preciso eliminar a los molestos “bichitos” que causaron el mal, no creo que dude en hacerlo, ya que los acogió, les ofreció todos los recursos necesarios para la supervivencia, y el pago no fue, precisamente, el más adecuado. Lo peor de todo esto es que el comportamiento, el egoísmo de unos pocos lo pagaremos todos. Es como cuando un niño molesta en el colegio y el maestro castiga a toda la clase.

Franz Liszt dijo una vez la hermosa frase siguiente:
“Nuestras vidas son preludios; preludios de una desconocida canción cuya primera nota es la muerte.”
Liszt encabezó su referencia a un poema de Lamartine, en uno de sus más conocidos poemas sinfónicos, con esta memorable definición. Y se hizo la pregunta ¿Será verdad que la muerte es el comienzo?
Bueno, es mejor ser respetuoso con ciertos pensamientos. Hay ciertos temas sobre los que la ciencia no tiene potestades ni puede legislar. Yo, en este sentido, me parapeto tras mi ignorancia para no pronunciarme sobre lo que desconozco, y sobre temas que la ciencia no está en condiciones de explicar. Claro que, no por ello y para mi intimidad, no dejo de tener mi propio criterio sobre lo que vendrá luego de ese último momento por el que tenemos que pasar todos.
Por su trabajo siempre está fuera de casa… ¡La hecho de menos!
Llegados a este punto, recuerdo las palabras de mi hija María, pianista y clavecinista, que tiene una personal y artística interpretación de las cosas a través de argumentos musicales. Para ella, la música es algo más que un arte; es el todo, una manera de interpretar la vida y de ver las cosas. La música es para ella su esencia, su materia revelada y el camino elegido para vivir en un mundo aparte, de colores, lleno de notas musicales que forman melodías de una belleza infinita. Cuando habla de su música, se transporta y vive dentro de una suerte poética que la eleva a un plano superior y filosófico, casi místico o religioso, que la revitaliza, le da una fuerza especial y, sobre todo, le hace feliz al estar haciendo aquello que más le gusta. El que puede conseguir eso, es un elegido -yo no pude elegir-. Claro que, a veces pienso: ¿No será que María se sumerge en su música para no ver la fealdad del mundo?
Emilio Silvera
Dic
31
Agujeros negros gigantes
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en General ~
Clasificado en General ~
 Comments (0)
Comments (0)

Acreción de gas en un agujero negro estelar desde su estrella compañera azul – YU JINGCHUAN, PLANETARIO DE PEKÍN
Descubren en nuestra Galaxia un agujero negro tan descomunal que no debería existir.
Su gigantesca masa, 70 veces mayor que la del Sol, es mucho mayor de lo que se creía posible
Nuestra galaxia, la Vía Láctea, contiene unos 100 millones de agujeros negros estelares, unos cuerpos cósmicos formados por el colapso de estrellas masivas y tan densos que ni la luz puede escapar. Hasta ahora, los científicos habían estimado que la masa de cada uno de esos agujeros negros no era más de 20 veces mayor que la del Sol. Pero se equivocaban. Un equipo internacional liderado el el Observatorio Astronómico Nacional de China ha descubierto uno mucho más gigantesco. Y completamente inesperado. El coloso, con una masa 70 veces mayor, se encuentra a 15.000 años luz de la Tierra.
El hallazgo, dado a conocer en el último numero de la revista «Nature», fue una gran sorpresa. «Los agujeros negros de tal masa ni siquiera deberían existir en nuestra galaxia, de acuerdo con la mayoría de los modelos actuales de evolución estelar», asegura el profesor Jifeng Liu, responsable del trabajo. «Pensamos que las estrellas muy masivas con la composición química típica de nuestra galaxia deben arrojar la mayor parte de su gas en poderosos vientos estelares a medida que se acercan al final de su vida. Por lo tanto, no deberían dejar un remanente tan masivo. LB-1 (como ha sido bautizado el agujero negro) es el doble de masivo de lo que creíamos posible. Ahora los teóricos tendrán que asumir el desafío de explicar su formación», explica.
Una aguja en un pajar

Hasta hace solo unos años, los agujeros negros estelares solo se podían descubrir cuando tragaban gas de una estrella compañera. Este proceso crea potentes emisiones de rayos X, detectables desde la Tierra, que revelan la presencia del objeto colapsado. Sin embargo, la gran mayoría de los agujeros negros estelares en nuestra galaxia no participan en un banquete cósmico y, por lo tanto, no emiten rayos X reveladores. Como resultado, solo alrededor de dos docenas de agujeros negros estelares galácticos han sido bien identificados y medidos.
Para contrarrestar esta limitación, Liu y sus colaboradores examinaron el cielo con el telescopio espectroscópico LAMOST de China, buscando estrellas que orbitan un objeto invisible, arrastradas por su gravedad.

Esta técnica de observación fue propuesta por primera vez por el científico inglés John Michell en 1783, pero solo se ha hecho factible con las recientes mejoras tecnológicas en telescopios y detectores. Aún así, la hazaña es como buscar una aguja en un pajar: solo una estrella de cada mil puede estar rodeando un agujero negro.
Después del descubrimiento inicial, se utilizaron los telescopios ópticos más grandes del mundo, el Gran Telescopio Canarias (Grantecan) de 10,4 m en La Palma y el telescopio Keck I de 10 m en Hawái, para determinar los parámetros físicos del sistema. Según los autores, los resultados fueron fantásticos: se vio una estrella ocho veces más pesada que el Sol orbitando un agujero negro de 70 masas solares, cada 79 días.
Ondas gravitacionales



El descubrimiento de LB-1 encaja muy bien con otro gran avance en astrofísica. Recientemente, los observatorios de ondas gravitacionales LIGO y Virgo han comenzado a captar ondas en el espacio-tiempo causadas por colisiones de agujeros negros en galaxias distantes. Curiosamente, los agujeros negros involucrados en tales colisiones también son mucho más grandes de lo que anteriormente se consideraba típico.
La observación directa de LB-1 demuestra que esta población de agujeros negros estelares demasiado masivos existe incluso en nuestro propio «patio trasero». «Este descubrimiento nos obliga a volver a examinar nuestros modelos de cómo se forman los agujeros negros de masa estelar», afirma el director de LIGO, David Reitze, de la Universidad de Florida en los Estados Unidos.
«Este notable resultado junto con las detecciones LIGO-Virgo de colisiones de agujeros negros binarios durante los últimos cuatro años realmente apunta hacia un renacimiento en nuestra comprensión de la astrofísica de agujeros negros», señala Reitze.
Dic
30
Rumores del pasado
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Rumores del Saber ~
Clasificado en Rumores del Saber ~
 Comments (0)
Comments (0)



En la India le atribuyen un carácter divino a las Nanda Davi, Kailas, Kanchenjunga y a otras muchas cumbres que, según ellos, sirven de residencia a los dioses. Se afirma que Siva tiene su sede en el monte Kailas (Kang Rimpoche). Se cuenta también de él que descendió sobre el Kanchenjunga, mientras que la diosa Lakshmi, por el contrario, se elevó hacia los cielos desde la cumbre.
Analizando estos mitos se llega a la conclusión de que por aquellas épocas remotas en que los dioses se mezclaban con los humanos, se producía un tráfico en los dos sentidos a través del espacio.
A partir del momento en que se encaminó desde el salvajismo a los rudimentos de la civilización, la Humanidad creyó en la existencia de dioses poderosos y bienhechores. De alguna manera debían buscar el equilibrio y la fuerza necesaria para sobrevivir en aquellos peligrosos tiempos; creer en algo.

En la antigua Grecia se consideraban el Parnaso y el Olimpo como los lugares en que moraban los dioses.
Podría continuar hablando de estos temas de los que en su momento profundicé bastante, pero como el presente trabajo es aleatorio y sin un rumbo fijo, no es cosa de hacer ningún tratado de un tema concreto, así que dejémoslo aquí como una curiosidad muy interesante (con un fondo – siempre – de verdad).
¡Me falta tiempo! Quisiera hacer tantas cosas, quisiera aprender tantas cosas, quisiera arreglar tantas cosas, quisiera, quisiera, quisiera… mucho trabajo para uno solo.
 Algún día, cuando me sienta con ánimo, os hablaré de los muchos mundos que existen dentro de este mundo nuestro.
Algún día, cuando me sienta con ánimo, os hablaré de los muchos mundos que existen dentro de este mundo nuestro.
Os contaré cómo fue la primera batalla de la historia y os podré hablar del Jardín de las Hespérides. En más profundidad de la Atlántida y de cómo se formó el Estrecho de Gibraltar, de los gigantes y los ligures, de Lug y Lusina, de la Espiral del Dios Lug, de nuestra civilización y de la Civilización, la Diáspora que nos cuenta que, como todas las cosas, las civilizaciones son mortales. Hablaré de Isoré, cuyo nombre subsiste en estado puro en un solo lugar: un castillo cerca de la confluencia del Vienne y del Loire en Francia. Podré hablaros de la leyenda de Osiris… o de lo que le ocurrió al labrador Fradin en 1.924 en Bourbonnais (la aldea de Glozel, no lejos de Vichy). En ese mismo trabajo que tengo más que pensado, incluiré lo que sé sobre los dólmenes y los druidas (muy sabios), todo ellos enlazado con Liguria y las invasiones célticas, allá por el 1.700 a. de C.
Estas historias me fascinaron y sobre ellas escribí hace muchos años, cuando aún vivía en casa de mis padres. No sé dónde fueron a parar tantos folios emborronados con mi imaginación; ahora me gustaría conservarlos. Nadie los leyó nunca; mi pudor a descubrir mis pensamientos esa muy elevado en mi corta edad (tendría entonces 20 – 22 años). Así que, si me armo de valor, repetiré todo aquello. ¡Puedo!
Al investigador
Quienes piensen que la alquimia es de naturaleza terrestre, mineral y metálica, que se abstengan.
Quienes piensen que la alquimia es estrictamente espiritual, que se abstengan.
Quienes piensen que la alquimia es sólo un símbolo utilizado para desvelar analógicamente el proceso de la “realización espiritual”, en suma, que el hombre es la materia y el atanor de la obra, que abandonen sus propósitos.
Claude d’Ygá
El arte hermético, los principios de la alquimia, su historia y los contactos de la alquimia con la ciencia moderna. Los alquimistas licenciados por la universidad de Montpellier en el s. XIII, Alberto Magno, Arnau Vilanova y Raimundo Lulio, Roger Bacon y más tarde Michael de Nostre-Dame (más conocido por su pseudónimo Nostradamus), Rebelais y Erasmo, además de médicos árabes y judíos, todos ellos adictos a la filosofía hermética, y todos interesados por la alquimia y las transmutaciones metálicas.
Más tarde me topé con la física que me enlaza directamente con las matemáticas (que por desgracia no domino), la biología, la astronomía, la astrología y la cosmología, en fin, con todo lo que realmente importa, la vida misma y el universo.
Antes de llegar a la física pasé por innumerables recorridos del saber humano: los clásicos griegos, los filósofos, Platón, Sócrates, Aristóteles, pero sin dejar a Kepler y Galileo, ni tampoco a Newton y Darwin. Mi avidez de saber era ilimitada y más de una noche, sobre las 3 ó las 4 de la madrugada, mi madre apagaba la luz de mi mesita de noche y cerraba el libro abierto sobre mi pecho o caído en el suelo. El sueño me impedía seguir; además, muy temprano había que cumplir en el trabajo. ¡Qué tiempos!
Alternaba las matemáticas comerciales y la contabilidad con mi preparación a las oposiciones de gestor administrativo; dos pruebas en Madrid, una escrita, la segunda, y otra oral, la primera.
Pero entre libros de estudios y ratos libres, nunca dejaba otras clases de lecturas como a William Shakespeare, Dante, Goethe, Descartes, Beltran, Rusell, Flanmarion, Julio Verne, Voltaire, Isaac Asimov, y en realidad, todo lo que pillaba, hasta tostones de Homero como la Iliada y la Odisea o los de docenas de clásicos, tanto rusos como de otras nacionalidades que caían en mis manos. De los siete sabios de Grecia a los pensadores Buda o Confucio; todo para mí era saber más cosas.
Ahora recuerdo, y no tengo más remedio que reírme, que teniendo media novia aficionada a las plantas me leí un tratado de plantas de interior para poder prestarle ayuda y ofrecerle mis conocimientos. Cuando nos encontramos, muy de tarde en tarde, nos abrazamos con cariño.
Leí a Euclides y sobre los elementos (Autólico de Pitania), obra de la que se editaron bastantes ediciones (1.296 – 1.482 y otras) y la edición de Ratdolt que fue uno de los más bellos de los primeros libros científicos editados impresos y por los que me interesé en su momento.
Fidias, Arquímedes, Alejandría o Siracusa eran para mí nombres muy familiares. He leído sobre la esfera y el cilindro, sobre la medida del círculo, sobre conoides y esferoides, sobre las espirales, cuadratura de la parábola, sobre los cuerpos flotantes y el Método, obras irremisiblemente perdidas y reconstruidas parcialmente mediante complejas estructuraciones de restos que, seguramente, dieron como resultado un híbrido de distintos autores posteriores que se basaban en el texto original.
También captó mi atención Ptolomeo y su gran síntesis astronómica, Copérnico y su mundo astronómico y, desde luego, me empapé de la civilización romana, guardián de la herencia griega y de su mitología. La Gran Enciclopedia Científico-Técnica de Cayo Plinio segundo, llamado “el Viejo” que reunió el legado de todos los antepasados y recogió el saber para evitar su pérdida.
Todas estas cuestiones me interesaron y de ellos me empapaba con la avidez y la curiosidad sin límite de un niño.
Galeno (129 – 194) es el médico más famoso de la antigüedad. Nació en Pérgamo, hoy en la Turquía occidental. Miembro de una familia de la clase alta urbana del helenismo romano, fue médico de cuatro emperadores. En sus trabajos se apoyó en las enseñanzas de Hipócrates y Aristóteles, pero aportó sus propias ideas.
El siglo XVI vio una revolución científica con Vesalio y Copérnico.
No existe, como frecuentemente oímos o leemos, una época oscura en la historia de la Humanidad que va de los romanos de los primeros siglos de la era cristiana a los europeos del siglo XVI. Lo que hay es ignorancia de que existan otras culturas y civilizaciones de las que llamamos cultura occidental desconocida.
Había otros mundos científicos, tecnológicos y filosóficos de saberes acumulados en el orbe árabe.
Así, los exploradores del saber se encontraron con nombres como el del matemático y geógrafo Mamad Ibn Musa al-Iwarizmi (800 – 847), del que procede la voz algoritmo, el químico y médico al-Razi (865 – 925), el físimo Ibn al-Hatham, Alhazen (965 – 1038), el matemático al-Biruni (973 – 1048), el médico Ibn Sina, Avicena (980 – 1037), el astrónomo al-Zangali, Azarquiel (1029 – 1087) o el médico Ibn Rushd, Averroes (1126 – 1198), que si la historia hubiese seguido otros caminos acaso habrían figurado de manera prominente en muchos lugares destacados de la historia.
Bueno, como es mi costumbre, mi mente me la jugó de nuevo; estaba hablando de Copérnico y Vesalio. Sin querer, me acordé de la “oscuridad” de la edad media y no pude evitar el nombrar a personajes que, en otra parte del mundo, brillaban con luz propia.
De Nicolás Copérnico, cualquier interesado en la ciencia, como los pocos lectores que yo tengo, poco les puedo contar que no sepan.
En 1543, el año en el que se publicaron libros (dos) que terminarían convirtiéndose en dos clásicos de la ciencia: De Revolutionibus Oebium Coelestium, de Nicolás Copérnico, y De Humani Corporis Fabrica, de Andreas Vesalio, aunque ninguno de los dos supo nunca desembarazarse de las cargas doctrinales de las disciplinas a las que se referían, Vesalio de Galeno y Copérnico de Aristóteles. Pero ambos, en sus respectivos campos, marcaron una época, un antes y un después.
No me parece oportuno continuar reseñando aquí sus biografías, y con los mencionado lo dejo. Mejor comento algo sobre Tycho Brahe (1546 – 1601) y Johannes Kepler (1571 – 1630).
Emilio Silvera















 Totales: 75.598.392
Totales: 75.598.392 Conectados: 51
Conectados: 51


























