Ene
28
La necesidad agudiza la imaginación
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Física-química ~
Clasificado en Física-química ~
 Comments (0)
Comments (0)

La fuerza nuclear débil nos habla de materiales que, de manera natural, emiten radiación y se desintegran. Al pensar en la desintegración me ha traído a la memoria aquellos libros de Asimov que nos explicaba cuestiones de ciencia y nos decía existen materiales que se desintegran de manera natural y que son materiales fértiles, o que sin serlo, se pueden transformar en otros que sí lo son.
Al hablar de material fértil me estoy refiriendo a núclidos que pueden absorber neutrones formar material fisible. El uranio-238, por ejemplo, absorbe un neutrón para formar uranio-239, que se desintegra en plutonio-239. Este es el de conversión que la imaginación del hombre hace que ocurra en un reactor reproductor.

Lo explicaré con más detalles: El Reactor Reproductor Rápido es un reactor de neutrones rápidos diseñado producir combustible generando más material fisible del que consume. El FBR es uno de los tipos posibles de reactores reproductores.
Veámos: El uranio-235 es un combustible práctico, es decir, los neutrones lentos son capaces de que el uranio-235 se fisione, o lo que es lo mismo, se rompan sus átomos en dos, produciendo neutrones lentos, que a su vez inducen otras fisiones atómicas. El uranio-233 y el plutonio-239 son también combustibles nucleares prácticos por las mismas razones.
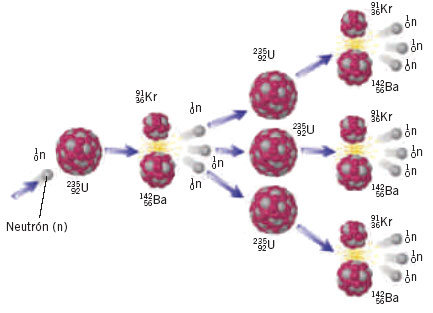
Desgraciadamente, el uranio-233 y el plutonio-239 no existen en natural sino en trazas mínimas, y el uranio-235, aunque existe en cantidades apreciables, no deja de ser raro. En cualquier muestra de uranio natural, sólo siete de cada mil átomos son de uranio-235, el resto es uranio-238.

Uranio
El uranio natural extraído de las minas contiene un 99´3 % de U-238 y apenas el 0´7 % de U-235.
El uranio-238, la variedad común de uranio, no es un combustible nuclear práctico. Así que, el uranio que más abunda en la naturaleza no sirve combustible nuclear. Podemos conseguir que se fisione, pero sólo con neutrones rápidos. Los átomos de uranio-238 que se rompen en dos, producen neutrones lentos, que no bastan para producir o inducir nuevas fisiones. El uranio-238 cabría compararlo a la madera húmeda: es posible que arda, pero acabará por apagarse.

El uranio es un elemento químico metálico de color plateado-grisáceo de la serie de los actínidos, su símbolo químico es U y su número atómico es 92. Por ello posee 92 protones y 92 electrones, con una valencia de 6. Su núcleo puede contener entre 142 y 146 neutrones, sus isótopos más abundantes son el 238U que posee 146 neutrones y el 235U con 143 neutrones. El uranio tiene el mayor peso atómico de entre todos los elementos que se encuentran en la naturaleza. El uranio es aproximadamente un 70% más denso que el plomo, aunque menos denso que el oro o el wolframio. Es levemente radioactivo. Fue descubierto como óxido en 1789 por M. H. Klaproth que lo llamó así en el honor del planeta Urano que acababa de ser descubierto en 1781.
Supongamos, sin embargo, que se separa el uranio-235 del uranio-238 ( más bien difícil) y que se utiliza aquel para hacer funcionar un reactor nuclear. Los átomos de uranio-235 que forman el combustible del reactor se fisionan y esparcen miríadas de neutrones lentos en todas direcciones. Si el reactor está rodeado por una capa de uranio ordinario (que en su mayor es uranio-238), los neutrones que van a parar allí son absorbidos por el uranio-238 y, aunque no pueden hacer que el uranio-238 se fisione, sí pueden provocar otros cambios que finalmente, producirán plutonio-239. Separando este plutonio-239 del uranio (tarea muy fácil), puede ser utilizado como combustible nuclear practico para la fisión.
De esta manera, el reactor nuclear genera combustible a partir de un material (uranio-238) que no lo es. Este es el motivo de que al reactor nuclear que hace posible la transformación se le llame “reactor generador”.
Un reactor generador bien diseñado puede producir más plutonio-239 que el uranio-234 consumido para ello. De este modo, las reservas totales de uranio de la Tierra (y no sólo las de uranio-235) se convierten en potenciales de combustible nuclear.

Torio
Carlo Rubbia, exdirector del CERN (los mismos que hicieron el Colisionador de Hadrones) y ganador del premio Nobel de física en 1984, ha trabajado buena de su carrera en el desarrollo de tecnologías para la producción de energía a partir de torio y calcula que con un reactor adecuado, este proceso de fisión podría generar a partir de 1 tonelada del elemento la misma cantidad de energía que 200 toneladas de uranio y 3.500.000 toneladas de carbón.
El torio, tal se da en la naturaleza, consiste todo él en torio-232, que al igual que el uranio-238, no es un combustible nuclear práctico, porque requiere neutrones rápidos para fisionarse. Pero si se coloca torio-232 alrededor de un reactor nuclear, sus átomos absorberán los neutrones y, sin experimentar fisión alguna, se convertirán en átomos de uranio-233. el uranio-233 es un combustible práctico que se puede separar fácilmente del torio, el resultado es otra variedad del reactor generador, que convierte las reservas de torio en un combustible nuclear en potencia.


Mientras que no se descubra otra manera de producir energía, el Uranio seguirá
La cantidad total de uranio y de torio que hay en la Tierra es unas 800 veces mayor que las reservas de uranio-235, lo que significa que el buen uso de los reactores generadores podría multiplicar por 800 la oferta potencial de energía extraída de plantas de fisión nuclear.
En este punto, sin dejar de elogiar la inteligencia del hombre que ha sabido encontrar la manera de transformar una materia inservible en otra practica, hay que decir que la energía de fisión nuclear genera también muchos problemas.
Como estará comprobando al lector de este , el autor ha querido esta vez diversificar los temas y plasmar una variedad múltiple que facilite el conocimiento de distintas cosas que ocurren en la naturaleza, o que la mano del hombre hace que ocurran, y todas estas cuestiones tratadas aquí van encaminadas a resolver preguntas que en alguna ocasión nos hemos podido , tales como:
¿Por qué al calentar un metal se pone primero rojo, luego naranja, después amarillo, pero a continuación blanco en lugar de seguir el espectro y ponerse verde?
¿Y el color en las estrellas?

Cuando un herrero está trabajando, el metal adquiere diferentes colores según recibe el calor de la fragua. Primero se mostrará de un rojo intenso, ir progresivamente adoptando tonos más claros, pasando del anaranjado al amarillo, y por fin al blanco. Con las estrellas pasa igual, Con el diagrama de arriba se demuestra una progresión entre estrellas enanas, amarillas y frías, subiendo hasta llegar a las supergigantes rojas y azules más calientes, y más grandes.
Si se pudiera seguir calentando el hierro, éste adquiriría tonos azulados. Estos cambios en la coloración son una consecuencia directa del aumento de la temperatura, que permitirá mayor maleabilidad. El Cúmulo del Joyero (en la constelación de la Cruz del Sur), fotografiado arriba, muestra cómo ocurre lo mismo con las estrellas, de manera que encontraremos estrellas azules, las más calientes, blancas, amarillas, anaranjadas y rojas, las más “frías”. A veces, estos colores pueden percibirse a simple vista, Antares (Alpha Scorpii) que es de color rojo, o Rigel (Beta Orionis) blanco-azulada.
En la Naturaleza rigen las mismas leyes todos y, en todas partes se producen los mismos fenómenos debidos a las mismas causas, en este caso: ¡La Temperatura!
Cualquier objeto, a cualquier energía superior al cero absoluto, radia ondas electromagnéticas. Si su temperatura es muy baja, emite sólo ondas de radio largas, muy pobres en energías. Al aumentar la temperatura, radia una cantidad mayor de ondas, pero empieza a radiar ondas de radio más cortas (y más energéticas). Si la temperatura sigue subiendo, empiezan a radiarse microondas aún más energéticas y después radiaciones infrarrojas.

Esto no quiere decir que a una temperatura dada sólo se emitan ondas de radio largas, un poco más arriba sólo ondas de radio cortas, luego sólo microondas y después sólo infrarrojos. En realidad, se emite toda la gama de radiaciones, pero siempre hay una radiación máxima, es decir, una gama de longitudes de onda que son las más radiadas, flanqueadas por cantidades menores en el lado de las energías bajas y por cantidades todavía más pequeñas en el de las altas.
Un objeto alcanza la temperatura del cuerpo humano (37°C), el máximo de radiación se encuentra en los infrarrojos largos. El cuerpo humano también radia ondas de radio, pero las longitudes de ondas más cortas y más energéticas son siempre las más fáciles de detectar por ser los más potentes.

Cuando la temperatura alcanza aproximadamente los 600°C, el máximo de radiación se halla en el infrarrojo corto. Pero a estas alturas la pequeña cantidad de radiación que se halla en el lado de las energías altas adquiere una importancia especial, porque entra ya en la región de la luz visible roja. El objeto reluce entonces con un rojo intenso.
Este rojo constituye sólo un pequeño porcentaje de la radiación total, pero da la casualidad de que nuestro ojo lo percibe, le otorgamos toda nuestra atención y decimos que el objeto está al “rojo vivo”.
Si la temperatura sigue subiendo, el máximo de radiación continúa desplazándose las longitudes de ondas cortas y cada vez se emite más luz visible de longitudes cada vez menores. Aunque el objeto radia más luz roja, se van agregando poco a poco luz anaranjada y luz amarilla en cantidades menores pero significativas. Al llegar a los 1.000°C la mezcla de colores la percibimos como naranja, y a los 2.000°C como amarilla. Lo cual no significa que a los 1.000°C sólo se radie luz naranja y a los 2.000°C sólo se radie luz amarilla, porque si fuese así, habría efectivamente que esperar que lo siguiente fuese “color verde”. Lo que en realidad vemos son mezclas de colores.

Al llegar a los 6.000°C (la temperatura superficial del Sol), el máximo de radiación está en el amarillo visible y lo que llega a nuestros ojos son grandes cantidades de luz visible, el violeta hasta el rojo. La incidencia simultánea de toda la gama de luz visible sobre nuestra retina nos da la sensación de blanco, y de ahí el color del Sol.
Los objetos más calientes aún que el Sol radian todas las longitudes de ondas de luz visible y en cantidades todavía mayores, el máximo de radiación se desplaza al azul, de modo que la mezcla se desequilibra y el blanco adquiere un tinte azulado.
Toda esta travesía se produce para objetos calientes que emiten “espectros continuos”, es decir, que radian luz en la forma de una ancha banda de longitudes de ondas. Ciertas sustancias en adecuadas, radian sólo luz de determinadas longitudes de onda. El nitrato de bario radia luz verde cuando se calienta, y con ese fin se lo utiliza en los fuegos de artificio, “calor verde”, podríamos decir.

Nitrato de Bario que produce el color verde en los bonitos fuegos artificiales
¡Qué bonito es saber!

En alguna ocasión todos hemos oído mencionar la palabra “gases nobles”, y sin embargo no siempre sabemos lo que son y el por qué le llaman así. Los elementos que reaccionan difícilmente o que no reaccionan en absoluto con otros elementos se denominan “inertes”. El nitrógeno y el platino son ejemplos de elementos inertes.
En la última década del siglo pasado se descubrieron en la atmósfera una serie de gases que no parecían intervenir en ninguna reacción química. Estos nuevos gases (helio, neón, argón, kripton, xenón y radón) son más inertes que cualquier otro elemento y se agrupan bajo el de gases inertes.
Los elementos inertes reciben a veces el calificativo de “nobles” porque esa resistencia a reaccionar con otros elementos recordaba un poco a la altanería de la aristocracia. El oro y el platino son ejemplos de “metales nobles”, y por la misma razón se llaman a veces “gases nobles” a los gases inertes. Hasta 1.962, el más común era el de gases inertes, quizá porque lo de nobles parecía poco apropiados en sociedades democráticas.

Es apropiado incluir una descripción de este grupo de elementos conocido en un capítulo dedicado a los halógenos, porque el flúor es el único elemento conocido que entra en combinación química directa con los dos gases nobles más pesados, el xenón y el criptón, resultando en compuestos estables.
Los gases nobles surgen en la naturaleza como constituyentes menos abundantes de la atmósfera. La primera indicación de la existencia de los gases nobles fue divulgada por el químico ingles Cavendish, en 1784.
La razón de que los gases inertes sean inertes es que el conjunto de electrones de cada uno de sus átomos está distribuido en capas especialmente estables. La más exterior, en concreto, tiene 8 electrones. Así la distribución electrónica del neón es (2,8) y la del argón (2,8,8). Como la adición o sustracción de electrones rompe distribución estable, no pueden producirse cambios electrónicos. Lo cual significa que no pueden producirse reacciones químicas y que estos elementos son inertes.
bien, el grado de inercia depende de la fuerza con que el núcleo, cargado positivamente y situado en el centro del átomo sujeta a los 8 electrones de la capa exterior. Cuantas más capas electrónicas haya entre la exterior y el centro, más débil será la atracción del núcleo central sobre los electrones de esa última capa de electrones.

El Radón es un gas radiactivo de origen natural procedente de la desintegración radiactiva de pequeñas cantidades de uranio presentes en rocas y suelo, es el responsable de miles de muertes por cáncer de pulmón en Europa cada año. El gas se filtra en los edificios a través del suelo y de los sótanos, puede acumularse llegando a niveles elevados, especialmente en espacios cerrados y poco ventilados.
Quiere esto decir que el gas inerte más complejo es también el menos inerte. El gas inerte de estructura atómica más complicada es el radón. Sus átomos tienen una distribución electrónica de (2,8,18,32,18,8). El radón, sin embargo está sólo constituido por isótopos radiactivos y es un elemento con el que difícilmente se pueden experimentos químicos. El siguiente en orden de complejidad es el xenón, que es estable. Sus átomos tienen una distribución electrónica de (2,8,18,18,8).

Se sabe desde hace décadas que la abundancia en la Tierra del xenón es menor de lo que debería ser según las proporciones observadas del resto de gases nobles. Las abundancias de estos gases se usan por los geoquímicos para evaluar y datar los principales procesos terrestres, incluyendo la formación de la atmósfera. Para poder hacerlo parten de una hipótesis básica: que los gases nobles son inertes en toda circunstancia. Un realizado por Gary Schrobilgen y David Brock, de la Universidad McMaster (Canadá), cuyos resultados se publican en el Journal of the American Chemical Society explica la baja abundancia del xenón y pone en evidencia que el xenón no es tan noble se suponía.
Los electrones más exteriores de los átomos de xenón y radón están bastante alejados del núcleo y, por consiguiente, muy sueltos. En presencia de átomos que tienen una gran apetencia de electrones, son cedidos rápidamente. El átomo con mayor apetencia de electrones es el flúor, y así fue como en 1.962 el químico canadiense Neil Bartlett consiguió formar compuestos de xenón y flúor.
Desde entonces se han conseguido formar también compuestos de radón y kriptón. Por eso los químicos rehúyen el de gases inertes, porque a fin de cuentas, esos gases no son completamente inertes. Hoy día se ha impuesto la denominación de “gases nobles”, y existe toda una rama de la química que se ocupa de los “compuestos de gases nobles”.

Naturalmente, cuanto más pequeño es el átomo de un gas noble, más inerte es, y no se ha encontrado nada que sea capaz de arrancarles algún electrón. El argón, cuya distribución electrónica es de 2,8,8 y el neón, con 2,8 electrones respectivamente, sigue siendo completamente inerte. Y el más inerte de todos es el helio, cuyos átomos contienen una sola capa electrónica con dos electrones (que es lo máximo que alojar esta primera capa) que al estar en la primera linea cerca del núcleo positivo, están fuertemente atraídos al tener su carga eléctrica el signo negativo.
finalizar diré que los gases nobles (gases inertes, gases raros) están clasificados en el grupo 18 (antiguamente 0) de la Tabla periódica de los elementos y se definen por símbolos que responden a: helio (He), neón (Ne), argón (Ar), kriptón (Kr), xenón (Xe) y radón (Rn).

Ya se dijo antes la configuración electrónica de cada uno de ellos y todas las capas internas están completamente ocupadas, lo que hace que estos elementos, por tanto, constituyan la terminación de un periodo y posean configuración de capa completa, por lo que sus energías de ionización son muy elevadas y su reactividad química escasa.
Como son monoatómicos, las moléculas de los gases nobles poseen simetría esférica, y las fuerzas intermoleculares son muy débiles, por lo que sus entalpías de vaporización son muy bajas.
Con todo lo anteriormente expuesto sobre los gases nobles, espero que el lector del aquí reflejado pueda tener una idea más amplia y un conocimiento más certero sobre lo que en realidad son los denominados como “gases nobles”.
En comparación con la inmensidad del universo, nos queda aún muchísimo que aprender. Si nos limitamos a nuestro entorno más cercano, la Tierra, ¿cómo hemos podido llegar tan lejos?
¡La curiosidad! y ¡La necesidad! ¡El Instinto! y ¡La Evolución! Todo ello, amigos míos, nos lleva a querer saber y, para ello, debemos desvelar los secretos de la Naturaleza, que por cierto, no resulta nada fácil. Llevamos miles de años intentando comprender y, de momento, sólo sabemos… ¡Algunas cosas!
emilio silvera
Fuente: Variada y destacando, Cien preguntas básicas sobre ciencia de Asimov.
Ene
28
¡La Física! en el siglo XIX
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Física ~
Clasificado en Física ~
 Comments (0)
Comments (0)


La Física, como todo, evoluciona
Simplemente con echar una mirada al siglo XIX, nos podemos percatar de que, ese período fue apasionante la Ciencia y la Tecnología que comenzaron a cambiar de manera acelerada produciendo importantes cambios en nuestra Sociedad, sus usos y sus costumbres.
No es extraño encontrar textos de la época en los que, aquella sucesión imparable de inventos y de muchos descubrimientos, marcarían el desarrollo de una nueva Humanidad.
Faraday y J. C. Maxwell.
Las lecturas de la época dejan a veces traslucir sentimientos de asombro, admiración, desconcierto y, a veces, un poco de temor de todos aquellos avances que parecían sacados de una novela de ciencia ficción.
Sí, queremos mostrar episodios referidos a grandes descubrimientos que, por estas razones, llaman la atención. Claro que, si nos trasladamos mentalmente a aquellos momentos y aquella época, podremos comprender mejor, todas aquellas reacciones entonces desencadenadas que , vistas en perspectiva, son lo que sería de esperar y de una total normalidad.

¿Que sería de nuestro mundo sin las personas que aparecen en esta foto?. Sería difícil nombrar a un físico relevante del siglo XX que no aparezca en ella. Corresponde a la quinta conferencia, año 1927, promovida por el filántropo belga Ernerst Solvay. De los 29 asistentes, 17 ya habían, o lo harían poco después, ganado el premio Nobel (al menos una vez). Schrödinger, Einstein (repite en esta lista), M. Curie, Bohr, Planck, Lorentz, Heissenberg, Pauli… científicos inigualables que cambiaron el concepto del mundo, desde el vasto Universo hasta el pequeño átomo.
Aquellos episodios fueron recogidos en lecturas y manuales de Física del siglo XIX, y, lo mismo que fueron saliendo a la luz (sin orden ni concierto), serán aquí comentados. Lo cierto es que, todo aquello nos trajo consecuencias históricas, sociales y educativas.
En general, el siglo XIX es el de la consolidación de la Física como disciplina autónoma. Se manifiesta en ella un afán por establecer un campo de estudio propio, separándose por un lado de la Química, y por el otro de las matemáticas, a la que ha pertenecido hasta entonces como una rama de la misma: las matemáticas mixtas(óptica, estática, astronomía.
En ese momento la Física comienza a adquirir importancia las distintas ramas del saber. Dos factores contribuyen a ello. El primero, la incorporación de nuevos conocimientos que amplían espectacularmente el horizonte de la disciplina. El segundo, el fundamental: el cambio de orientación con relación al espíritu especulativo que estuvo presente hasta bien avanzado el siglo anterior.

Pronto llegarían nuevos conceptos, nuevas teorías
De este modo, la Física asume un enfoque más experimental, al tiempo que dará paso a una utilización creciente de las matemáticas.
Drespretz, en el prólogo de su Física Experimental (1839): “La Física, en el estado á que ha llegado en la actualidad, no tiene de común más que el con la Física llamada escolástica, que los preceptos de Bacón y los ejemplos de Galileo han contribuido felizmente á desterrar de la enseñanza pública.”
La Física de orientación escolástica todavía perdura, especialmente en nuestro país, a principios del siglo XIX. marcar las diferencias, se insiste en que la nueva Física es Física Experimental que se contempla como “ciencia útil” y capaz de incidir con sus aplicaciones en la vida de las personas y en las Sociedades en general.

Aquellos tiempos eran de carruajes que comenzaron a correr sin caballos, máquinas de vapor que “aprovecha la potencia motriz del fuego” que surgieron en Inglaterra del siglo XVIII para sustituir a los animales en el bombeo del agua, cuando ésta inundaba las minas de carbón. La máquina “atmosférica” de Newcomen fue la primera, seguida por la de Watt que mejoró el diseño con un condensador para el vapor, haciéndola mucho más eficiente.
En 1827, el ingeniero francés Marc Seguir inventó la caldera tubular, que obtenía mayor provecho de la fuerza generada por el vapor. Stephenson aplicó sistema a la locomotora The Rocket, que era capaz de transportar 12.942 kilos a 24 km por hora con una pendiente del 2%.
Ninguno de aquellos avances se llevó a cabo con respaldo teórico hasta que aparecen los estudios de Carnot en 1824. En ese nace la termodinámica y a partir de ahí el progreso se dispara.
La Máquina de vapor tiene lugar preferente en los manuales de Física de la época y se describen de manera minuciosa todos y uno de los elementos que intervienen en su funcionamiento. Faltaba sin embargo, la fundamentación teórica, la cual tardaría varias décadas en ser incorporada.
A lo más, los dos únicos principios explicativos que aparecen son la “fuerza elástica del vapor” y “la caída de presión cuando el vapor se condensa”. Claro que, la máquina de vapor adoptó nuevos y más modernos diseños y, de estar fijas en sus lugares de , pasaron a poder desplazarse con la gran ventaja que ello suponía, y, hasta tal punto fue así que, aquella idea del desplazamiento, dio lugar a la llegada del Ferrocarril por una parte y de la Navegación fluvial a vapor por otra, con lo cual, aquello nos llevó en volandas hacia el futuro. Un futuro hasta hacía poco impensable.

“[…] máquinas admirables que lo mismo producen su efecto en puntos fijos, como marchando con una prodigiosa velocidad, ya sobre las barras de hierro, borrando las distancias, ó ya surcando los mares sobre unas tablas, y haciendo vecinos los dos mundos que estos mares separan. (Rodríguez, 1858, p. 320, en su manual de Física general y aplicada a la agricultura y a la industria. Madrid, Aguado (1858).”
Resulta muy curioso en la que eran presentados estos nuevos inventos y las referencias que utilizaban para ello al tratar de transmitir al lector novedades de tal magnitud:

“Igualmente se las ha aplicado á los carruajes que se hacen marchar sin caballerías para transportar cargamentos muy considerables, ó mejor para arrastrar tras de sí un número mayor o menor de carruajes ordinarios cargados de todas las mercancías, ó de otra clase de objetos. (Beudant, 1841, p. 283. Tratado Elemental de Física (3ª Edic.) Madrid, Imprenta de Arias (1841).”
Como vemos, lo era descrito en base a lo ancestral. Se percibe que comienza a producirse cambios de incalculables consecuencias, que hará que el mundo, deje de ser lo que era.
Tras haber pasado desapercibida siglos, la electricidad comienza un desarrollo fulgurante en el siglo XVIII. En ese período se establecen las leyes básicas y surgen las primeras teorías explicativas de los fenómenos conocidos. Coulomb cierra el siglo estableciendo la primera ley cuantitativa e introduciendo la electricidad en el marco de la ciencia newtoniana.

La bateria eléctrica de Volta y las primeras ciudades alumbradas
Volta apiló discos de igual tamaño de cobre y de cinc, sólo o con estaño, alternados, que llevan intercalados cada uno de ellos un paño humedecido. Esta “pila de discos” empieza y termina con discos de diferente tipo. Conectando con un alambre los discos situados en los extremos logró que fluyera un flujo eléctrico. Impregnando el paño en determinadas sales la corriente obtenida era mucho mayor.
Así, en el siglo XIX se abre con una aportación de gran trascendencia: la pila de Volta, cuyos efectos “son tan extraordinarios que sin exageración se puede decir que es el instrumento más maravilloso que ha creado la inteligencia humana” (González Chávarri, 1848). La pila amplia el campo de la electricidad incorporando todos los fenómenos relacionados con la entonces llamada “electricidad galvánica”. Poco más tarde, gracias a los trabajos de Oersted y Faraday, aparece otro dominio de inmensas posibilidades: el electromagnetismo. El descubrimiento de la conexión entre corriente eléctrica e imanes va a ser seguida de la puesta a punto de aparatos y máquinas que serán el soporte de la electricidad industrial y marcarán el tránsito hacia la Sociedad contemporánea.
La Electricidad acuña fama de ser un agente físico poderoso y, al mismo tiempo, sorprendente, vistos los fenómenos y efectos que suele protagonizar. Se presenta como capaz de hacer posible todo lo imaginable e inimaginable. Tanto es así que por ejemplo, es capaz de producir luz ¡sin utilizar fuego! Así, los manuales describen la experiencia realizada por Davy en 1801, que mediante una pila de gran de elementos hace saltar un arco de luz cegadora (arco voltaico) entre dos barras próximas de carbón.


Liebherr, en el emplazamiento británico de Sunderland, se decidió por el moderno procedimiento por arco voltaico pulsado, por lo que utiliza sistemas digitales del TransPuls Synergic 5000 de Fronius.
La luz a diferencia de las chispas se mantenían durante un cierto tiempo, pero las barras se iban consumiendo y llegaba un momento en que cesaba el fenómeno. Con base a experiencia se construyeron aparatos destinados a la iluminación, provistos de un complicado sistema que mantenía las distancias de las barras. El arco estaba protegido de las corrientes de aire por un tubo de vidrio.
Otro inconveniente era la duración muy limitada de pilas y baterías, pero a partir de los años 1860 comenzaron a estar operativas las dinamos y problema quedó solucionado.

No sería justo hablar de la luz sin nombrar a N. Tesla
Poco más tarde, 1880 y gracias a que el espabilado Edison se apropió de las ideas de Tesla, surgió y se impulsó la bombilla de incandescencia, dispositivo durable y de bajo coste de producir luz mediante la corriente. Ha sido el sistema que hemos conocido hasta nuestros días.
Podríamos seguir hasta llegar a lo que hoy es la Fisica, sin embargo, ni el sitio es tan extenso ni el tiempo lo permite.
emilio silvera
















 Totales: 72.290.531
Totales: 72.290.531 Conectados: 88
Conectados: 88

























