La paradoja de Fermi: ¿dónde está todo el mundo?
Si existen miles de millones de posibilidades de que haya civilizaciones inteligentes, ¿por qué ninguna ha contactado todavía con nosotros?
IMPRESIÓN NO PERMITIDA - TEXTO SUJETO A DERECHOS DE AUTOR
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en EL DETERIORO DEL PLANETA tIOERRA ~
Clasificado en EL DETERIORO DEL PLANETA tIOERRA ~
 Comments (7)
Comments (7)
Richard Alley, experto en cambio climático y Premio BBVA Fronteras del Conocimiento

Richard Alley, experto en cambio climático y Premio BBVA Fronteras del Conocimiento. SERGIO ENRÍQUEZ-NISTAL
Richard Alley hace 20 años que no paga una plaza de aparcamiento. No se considera un activista ni un ejemplo de ciudadano que ha pasado a la acción, pero cada mañana acude a su puesto de catedrático de Geociencias de la Universidad de Pennsylvania en bicicleta. Alley ha pasado más de 30 años extrayendo testigos de hielo de Groenlandia o la Antártida y leyendo en ellos la historia del clima desde hace millones de años. Sus propias conclusiones le permiten hablar con la firmeza: «la huella dactilar del ser humano está en el cambio climático que estamos viviendo». Ha sido investigador principal de uno de los grupos del panel científico de Naciones Unidas para el Cambio Climático (IPCC, por sus siglas en inglés) y acaba de visitar Madrid para recoger el Premio Fundación BBVA Fronteras del Conocimientos en esa categoría.
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Física ~
Clasificado en Física ~
 Comments (0)
Comments (0)

Cuando hablamos de masa, nos estamos refiriendo a la medida de la inercia de un cuerpo, es decir, su resistencia a la aceleración. Todos sabemos la inmensa cantidad de combustible que se necesita para enviar al espacio exterior a esos transbordadores que llevan suministros y astronáutas al espacio exterior para el mantenimeinto de la Estación Espacial Internacional. El esfuerzo, es vencer la masa que se quiere transportar hasta que esta, alcanzando los 11 km/s de velocidad, pueda escapar de la fuerza de gravedad de la Tierra y poder así, cumplir con su cometido.

De acuerdo con las leyes de Newton del movimiento, si dos masas distintas, m1 y m2, son hechas colisionar en ausencia de cualquier otra fuerza, ambas experimentaran la misma fuerza de colisión. Si los dos cuerpos adquieren aceleraciones a1 y a2, como resultado de la colisión, entonces m1 a1 = m2 a2. Esta ecuación permite comparar dos masas. Si una de las masas se considera como una masa estándar, la masa de todas las demás puede ser medida comparándola con esta masa estándar. El cuerpo utilizado para este fin es un cilíndro de un kilógramo de una aleación de platino iridio. llamado el estándar internacional de masa. La masa definida de esta forma es llamada masa inercial del cuerpo.

Las masas también se pueden definir midiendo la fuerza gravitacional que producen. Por tanto, de acuerdo con la ley de gravitación de Newton, mg = Fd2 / MG, donde M es la masa de un cuerpo estándar situado a una distancia d del cuerpo de masa mg; F es la fuerza gravitacional entre ellos, y G es la constante gravitacional. La masa definida de esta forma es la masa gravitacional. En el siglo XIX, Roland Eötvös (1848-1919) demostró experimentalmente que las masas inerciales y gravitatorias son indistinguibles, es decir, m1 = mg.
Aunque la masa se define formalmente utilizando el concepto de inercia, es medida habitualmente por gravitación. El peso (W) de un cuerpo es la fuerza con la que un cuerpo es atraído gravitacionalmente a la Tierra, corregido por el efecto de la rotación, y es igual al producto de la masa del cuerpo y la aceleración en caída libre (g), es decir, W = mg.

Kilogramo patrón.
El kilogramo (unidad de masa) tiene su patrón en: la masa de un cilindro fabricado en 1880, compuesto de una aleación de platino-iridio (90 % platino – 10 % iridio), creado y guardado en unas condiciones exactas, y que se guarda en la Oficina Internacional de Pesos y Medidas en Sevres, cerca de París.
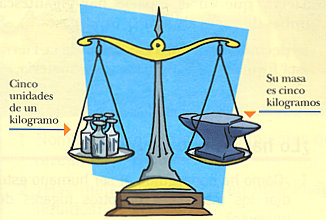 |
| Una balaza mide solo cantidad de masa. |
La masa es la única unidad que tiene este patrón, además de estar en Sevres, hay copias en otros países que cada cierto tiempo se reúnen para ser regladas y ver si han perdido masa con respecto a la original.
No olvidemos que medir es comparar algo con un patrón definido universalmente.
¿Y el peso?
De nuevo, atención a lo siguiente: la masa (la cantidad de materia) de cada cuerpo es atraída por la fuerza de gravedad de la Tierra. Esa fuerza de atracción hace que el cuerpo (la masa) tenga un peso, que se cuantifica con una unidad diferente: el Newton (N).
La UNIDAD DE MEDIDA DEL PESO ES EL NEWTON (N)
Entonces, el peso es la fuerza que ejerce la gravedad sobre una masa y ambas magnitudes son proporcionales entre sí, pero no iguales, pues están vinculadas por el factor aceleración de la gravedad.
En el lenguaje común, el peso y la masa son frecuentemente usados como sinónimos; sin embargo, para fines científicos son muy diferentes. La masa es medida en kilogramos; el peso, siendo una fuerza, es medido en newtons (símbolo N. Unidad del SI de la fuerza, siendo la fuerza requerida para comunicar a una masa de un kilogramo una aceleración de 1 m s –2). Es más, el peso depende de donde sea medido, porque el valor de g es distintos en diferentes puntos de la superficie de la Tierra. La masa, por el contrario, es constante donde quiera que se mida, sujeta a la teoría especial de la relatividad. De acuerdo con esta teoría, publicada por Albert Einstein en 1905, la masa de un cuerpo es una medida de su contenido total de energía.




Por tanto, si la energía del cuerpo crece, por ejemplo, por un aumento de su energía cinética o temperatura, entonces su masa también crece. De acuerdo con esta ley, un aumento de energía ΔE está acompañado de un aumento de masa Δm, en conformidad con la ecuación de masa-energía Δm = ΔE/c2, donde c es la velocidad de la luz. Por tanto, si un kilo de agua se eleva de temperatura en 100 K, su energía interna aumentará en 4 x 10 –12 kg. Este es, por supuesto, un incremento despreciable y la ecuación de masa-energía es sólo significativa para energías extremadamente altas. Por ejemplo, la masa de un electrón es siete veces mayor si se mueve con relación a un observador al 99% de la velocidad de la luz.
Ya sabemos que, se ha comprobado una y mil veces que, la teoría de Einstein de la relatividad especial es cierta en el sentido de que, al ser la velocidad de la luz el límite de velocidad del Universo, nada puede ir más rápido que la luz, cuando un cuerpo viaja a velocidades cercanas a la de la luz, a medida que se acerca a ella, puede ver como su masa aumenta, ya que, la energía de movimiento se convierte en masa al no poder conseguir su objetivo de marchar más rápido que la luz.

En los anillos enterrados en las entrañas de la Tierra, haces de partículas son lanzadas a la velocidad de la luz para que colisionen y, su peso aumenta conforme se van acercando a ese límite marcado por el universo.
La masa relativista de un cuerpo medida por un observador (un físico del LHC que mide el aumento de masa de los protones a medida que adquieren velocidad en el acelerador de partículas del CERN) con respecto al cual este cuerpo se mueve. De acuerdo con la teoría de Einstein, la masa m de un cuerpo moviendose a velocidad v está dada por m = m0/√ (1 – v2 / c2), donde m0 es su masa en reposo y c es la velocidad de la luz. La masa relativista solo difiere significativamente de la masa en reposo si su velocidad es una fracción apreciable de la velocidad de la luz. Si v = c/2, por ejemplo, la masa relativista es un 15% mayor que la masa en reposo.
Según las consecuencias obtenidas en el proyecto Manhattan, lo que sí es seguro es que, una pequeña fracción de materia, contiene una gran cantidad de energía. Según nos decía Asimov: “…un sólo gramo de materia se podría convertir en energía eléctrica que bastaría para mantener luciendo continuamente una bombilla de 100 vatios durante unos 28.200 años. O bien, la energía que representa un sólo gramo de materia es equivalente a la que se obtendría de quemar unos 32 millones de litros de gasolina”.

Una cosa si que nos puede quedar muy clara: Aunque sabemos algunas cosas sobre la masa y lo que entendemos por la energía, no podemos decir que, al día de hoy, “sepamos de verdad”, lo que la masa y la energía son.
Seguiremos aprendiendo. Sin embargo, nunca dejes de tener en cuenta que, lo que es cierto hoy, mañana será una verdad distinta. Todo dependen de la teoría aceptada en el momento, toda vez que, con el paso del tiempo las ideas evolucionan y todo es mejorables a medida que nuestros conocimientos avanzan. Así que la idea que podamos tener de Gravedad, masa, energía e inercia, mañana podría ser distinta a la que hoy podamos tener.
emilio silvera
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Las constantes de la Naturaleza ~
Clasificado en Las constantes de la Naturaleza ~
 Comments (4)
Comments (4)
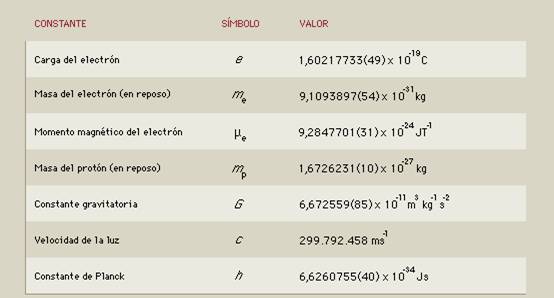
Si alguna de estas constantes de la Naturaleza, variaran tan sólo una millonésima, la vida no estaría presente
“En la Física existen una serie de magnitudes que contienen información que es independiente del sistema de medida que elijamos, lo cual es muy valioso no sólo en los cálculos. Además, estos parámetros que fija la naturaleza aparecen en las ecuaciones como parámetros que debemos ajustar lo más que podamos para que nuestras predicciones y nuestros modelos se ajusten a la realidad en la medida de lo posible.
Y aquí es donde viene el problema. Que son parámetros, es decir, su valor cuantitativo no es deducible de la teoría y por tanto hay que medirlo. Y esto añade la dificultad no sólo de idear un experimento, sino de hacerlo lo bastante preciso como para que el modelo sirva para algo.
El Modelo Estándar por ejemplo, que es el paradigma actual en el que se mueve la física de partículas y que recoge las interacciones fundamentales tiene unos 25 parámetros que se deben ajustar. Parámetros tales como la carga eléctrica, la masa, el espín, las constantes de acoplamiento de los campos, que miden la intensidad que éstos tienen, etcétera.
Ya no sólo se trata de averiguar el valor de cada una de ellas. Tampoco sabemos decir de antemano cuantas constantes fundamentales puede haber. Y es evidente que cuantas más constantes hay, más complicado se nos hace nuestro modelo.”
Si miramos hacia atrás en el Tiempo podemos contemplar los avances que la Humanidad logró en los últimos tiempos, caigo en la cuenta de que poco a poco hemos sido capaces de identificar una colección de números mágicos y misteriosos arraigados en la regularidad de la experiencia.
¡Las constantes de la naturaleza!
Dan al universo su carácter distintivo y lo hace singular, distinto a otros que podría nuestra imaginación inventar. Estos números misteriosos, a la vez que dejan al descubierto nuestros conocimientos, también dejan al desnudo nuestra enorme ignorancia sobre el universo que nos acoge. Las medimos con una precisión cada vez mayor y modelamos nuestros patrones fundamentales de masa y tiempo alrededor de su invarianza; no podemos explicar sus valores.

Nunca nadie ha explicado el valor numérico de ninguna de las constantes de la naturaleza. ¿Recordáis el 137? Ese número puro, adimensional, que guarda los secretos del electrón (e), de la luz (c) y del cuanto de acción (h). Hemos descubierto otros nuevos, hemos relacionado los viejos y hemos entendido su papel crucial para hacer que las cosas sean como son, pero la razón de sus valores sigue siendo un secreto profundamente escondido.
Buscar esos secretos ocultos implica que necesitamos desentrañar la teoría más profunda de todas y la más fundamental de las leyes de la naturaleza: descubrir si las constantes de la naturaleza que las definen están determinadas y conformadas por alguna consistencia lógica superior o si, por el contrario, sigue existiendo un papel para el azar.

Si estudiamos atentamente las constantes de la naturaleza nos encontramos con una situación muy peculiar. Mientras parece que ciertas constantes estuvieran fijadas, otras tienen espacio para ser distintas de las que son, y algunas no parecen afectadas por ninguna otra cosa del - o en el – universo.
¿Llegaron estos valores al azar?
¿Podrían ser realmente distintos?

¿Cuán diferentes podrían ser para seguir albergando la existencia de seres vivos en el universo?
En 1.986, el libro The Anthropic Cosmological Principle exploraba las diez maneras conocidas en que la vida en el universo era sensible a los valores de las constantes universales. Universos con constantes ligeramente alteradas nacerían muertos, privados del potencial para desarrollar y sostener la complejidad que llamamos vida.
En la literatura científica puede encontrarse todo tipo de coincidencias numéricas que involucran a los valores de las constantes de la naturaleza. He aquí algunas de las fórmulas propuestas (ninguna tomada en serio) para la constante de estructura fina.
Valor experimental: 1/α = 137’035989561…

Por supuesto, si la teoría M da al fin con una determinación del valor de 1/α podría parecerse perfectamente a una de estas fórmulas especulativas. Sin embargo ofrecería un amplio y constante edificio teórico del que seguiría la predicción.
También tendría que haber, o mejor, que hacer, algunas predicciones de cosas que todavía no hemos medido; por ejemplo, las siguientes cifras decimales de 1/α, que los futuros experimentadores podrían buscar y comprobar con medios más adelantados que los que ahora tenemos, a todas luces insuficientes en tecnología y potencia.
Todos estos ejercicios de juegos mentales numéricos se acercan de manera impresionante al valor obtenido experimentalmente, pero el premio para el ingeniero persistente le corresponde a Gary Adamson, cuya muestra de 137-logía se mostraron en numerosas publicaciones.
Estos ejemplos tienen al menos la virtud de surgir de algún intento de formular una teoría de electromagnetismo y partículas. Pero hay también matemáticos “puros” que buscan cualquier combinación de potencias de números pequeños y constantes matemáticas importantes, como π, que se aproxime al requerido 137’035989561… He aquí algún ejemplo de este tipo.

Unidades naturales que no inventó el hombre
Ni siquiera el gran físico teórico Werner Heisenberg pudo resistirse a la ironía o irónica sospecha de que…
“En cuanto al valor numérico, supongo que 1/α = 24 33 / π, pero por supuesto es una broma.”
Arthur Eddington, uno de los más grandes astrofísicos del siglo XX y una notable combinación de lo profundo y lo fantástico, más que cualquier figura moderna, fue el responsable impulsor de poner en marcha los inacabables intentos de explicar las constantes de la naturaleza mediante auténticas proezas de numerología pura. Él también advirtió un aspecto nuevo y especular de las constantes de la naturaleza.
“He tenido una visión muy extraña, he tenido un sueño; supera el ingenio del hombre decir qué sueño era. El hombre no es más que un asno cuando tiene que exponer este sueño. Se llamará el sueño del fondo, porque no tiene fondo.”
A. S. Eddington
“El conservadurismo recela del pensamiento, porque el pensamiento en general lleva a conclusiones erróneas, a menos que uno piense muy, muy intensamente.”
Roger Scruton

Todo lo que existe… ¡Tiene una explicación!
Hay que prestar atención a las coincidencias. Uno de los aspectos más sorprendentes en el estudio del universo astronómico durante el siglo XX, ha sido el papel desempeñado por la coincidencia: que existiera, que fuera despreciada y que fuera recogida. Cuando los físicos empezaron a apreciar el papel de las constantes en el dominio cuántico y a explorar y explorar la nueva teoría de la gravedad de Einstein para describir el universo en conjunto, las circunstancias eran las adecuadas para que alguien tratara de unirlas.
Entró en escena Arthur Eddington; un extraordinario científico que había sido el primero en descubrir cómo se alimentaban las estrellas a partir de reacciones nucleares. También hizo importantes contribuciones a nuestra comprensión de la galaxia, escribió la primera exposición sistemática de la teoría de la relatividad general de Einstein y fue el responsable de verificar, en una prueba decisiva durante un eclipse de Sol, la veracidad de la teoría de Einstein en cuanto a que el campo gravitatorio del Sol debería desviar la luz estelar que venía hacia la Tierra en aproximadamente 1’75 segmentos de arco cuando pasaba cerca de la superficie solar, y así resultó.
“Arthur Eddington creyó en las teorías de Einstein desde el principio, y fueron sus datos tomados durante el eclipse solar de 1919 los que dieron la prueba experimental de la teoría general de la relatividad. La amplia cobertura informativa de los resultados de Eddington llevó a la teoría de la relatividad, y al propio Einstein, a unos niveles de fama sin precedentes.
Arthur Eddington está considerado uno de los más importantes astrónomos ingleses del siglo XX. Se especializó en la interpretación de las observaciones de los movimientos de las estrellas en el Observatorio de Greenwich. En 1913, fue uno de los primeros científicos no alemanes en entrar en contacto con las primeras versiones de la teoría general de la relatividad, e inmediatamente se convirtió en un declarado partidario.”
( http://www.experientiadocet.com)
Albert Einstein y Arthur Stanley Eddington se conocieron y se hicieron amigos. Se conservan fotos de los dos juntos conversando sentados en un banco en el jardín de Eddington en el año 1.930, donde fueron fotografiados por la hermana del dueño de la casa.
Aunque Eddington era un hombre tímido con pocas dotes para hablar en público, sabía escribir de forma muy bella, y sus metáforas y analogías aún las utilizan los astrónomos que buscan explicaciones gráficas a ideas complicadas. Nunca se casó y vivió en el observatorio de Cambridge, donde su hermana cuidaba de él y de su anciana madre.
Eddington creía que a partir del pensamiento puro sería posible deducir leyes y constantes de la naturaleza y predecir la existencia en el universo de cosas como estrellas y galaxias. ¡Se está saliendo con la suya!
Entre los números de Eddington, uno lo consideró importante y lo denominó “número de Eddington”, que es igual al número de protones del universo visible. Eddington calculó (a mano) este número enorme y de enorme precisión en un crucero trasatlántico concluyendo con esta memorable afirmación.
“Creo que en el universo hay
15.747.724.136.275.002.577.605.653.961.181.555.468.044.717.914.527.116.709.366.231.425.076.185.631.031.296
protones y el mismo número de electrones.”
Este número enorme, normalmente escrito NEdd, es aproximadamente igual a 1080. Lo que atrajo la atención de Eddington hacia él era el hecho de que debe ser un número entero, y por eso en principio puede ser calculado exactamente.
Durante la década de 1.920, cuando Eddington empezó su búsqueda para explicar las constantes de la naturaleza, no se conocían bien las fuerzas débil y fuerte, y las únicas constantes dimensionales de la física que sí se conocían e interpretaban con confianza eran las que definían la gravedad y las fuerzas electromagnéticas.

No siempre sabemos valorar la grandeza a la que puede llegar la mente humana: “… puedan haber accedido a ese mundo mágico de la Naturaleza para saber ver primero y desentrañar después, esos números puros y adimensionales …”
Eddington las dispuso en tres grupos o tres puros números adimensionales. Utilizando los valores experimentales de la época, tomó la razón entre las masas del protón y del electrón:
mp / me ≈ 1.840
La inversa de la constante de estructura fina:
2πhc / e2 ≈ 137
Y la razón entre la fuerza gravitatoria y la fuerza electromagnética entre un electrón y un protón:
e2 / Gmpme ≈ 1040
A éstas unió o añadió su número cosmológico, NEdd ≈ 1080.

¿No cabría la posibilidad de que todos los grandes sucesos presentes correspondan a propiedades de este Gran Número [1040] y, generalizando aún más, que la historia entera del universo corresponda a propiedades de la serie entera de los números naturales…? Hay así una posibilidad de que el viejo sueño de los filósofos de conectar la naturaleza con las propiedades de los números enteros se realice algún día.
Eddington a estos cuatro números los llamó “las constantes últimas”, y la explicación de sus valores era el mayor desafío de la ciencia teórica.
“¿Son estas cuatro constantes irreducibles, o una unificación posterior de la física demostrará que alguna o todas ellas pueden ser prescindibles?
¿Podrían haber sido diferentes de los que realmente son?”
De momento, con certeza nadie ha podido contestar a estas dos preguntas que, como tantas otras, están a la espera de esa Gran Teoría Unificada del Todo, que por fin nos brinde las respuestas tan esperadas y buscadas por todos los grandes físicos del mundo. ¡Es todo tan complejo! ¿Acaso es sencillo y no sabemos verlo? Seguramente un poco de ambas cosas; no será tan complejo, pero nuestras mentes aún no están preparadas para ver su simple belleza. Una cosa es segura, la verdad está ahí, esperándonos.
Para poder ver con claridad no necesitamos gafas, sino evolución. Hace falta alguien que, como Einstein hace 100 años, venga con nuevas ideas y revolucione el mundo de la física que, a comienzos del siglo XXI, está necesitada de un nuevo y gran impulso. ¿Quién será el elegido? Por mi parte me da igual quién pueda ser, pero que venga pronto. Quiero ser testigo de los grandes acontecimientos que se avecinan, la teoría de supercuerdas y mucho más.
emilio silvera
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Física ~
Clasificado en Física ~
 Comments (1)
Comments (1)
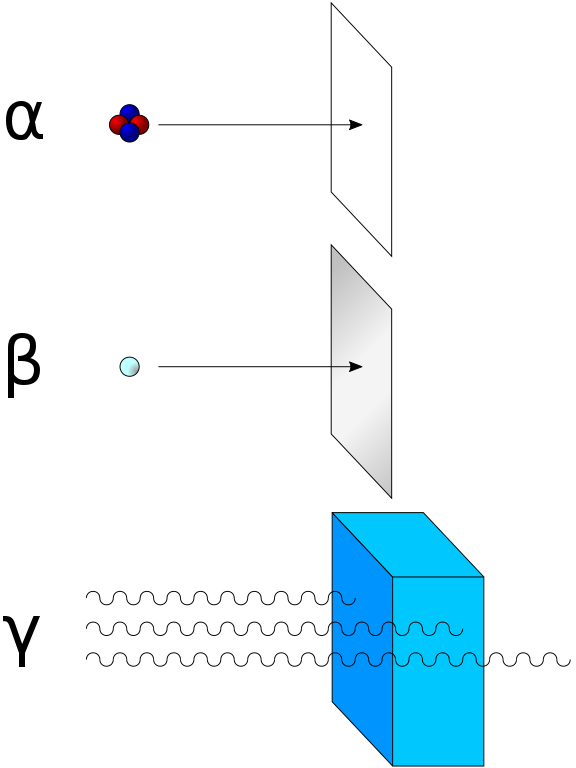
La radiación alfa consiste en núcleos de helio-4 (4He) y es detenida fácilmente por una hoja de papel. La radiación Beta que consiste en electrones, es detenida por una placa de aluminio. La radiación gamma es finalmente absorbida cuando penetra en un material denso. El plomo es bueno en la absorción de la radiación gamma, debido a su densidad.
¿Qué no será capaz de inventar el hombre para descubrir los misterios de la naturaleza?
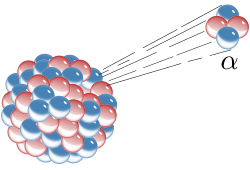
Ha pasado mucho tiempo desde que Rutherford identificara la primera partícula nuclear (la partícula alfa). El camino ha sido largo y muy duro, con muchos intentos fallidos antes de ir consiguiendo los triunfos (los únicos que suenan), y muchos han sido los nombres que contribuyen para conseguir llegar al conocimiento del átomo y del núcleo actual; los electrones circulando alrededor del núcleo, en sus diferentes niveles, con un núcleo compuesto de protones y neutrones que, a su vez, son constituidos por los quarks allí confinados por los gluones, las partículas mediadoras de la fuerza nuclear fuerte. Pero, ¿qué habrá más allá de los quarks?, ¿las supercuerdas vibrantes? Algún día se sabrá.
Partículas
El universo de las partículas es fascinante. Cuando las partículas primarias chocan con átomos y moléculas en el aire, aplastan sus núcleos y producen toda clase de partículas secundarias. En esta radiación secundaria (aún muy energética) la que detectamos cerca de la Tierra, por los globos enviados a la atmósfera superior, han registrado la radiación primaria.

El físico estadounidense Robert Andrews Millikan, que recogió una gran cantidad de información acerca de esta radiación (y que le dio el nombre de rayos cósmicos), decidió que debería haber una clase de radiación electromagnética. Su poder de penetración era tal que, parte del mismo, atravesaba muchos centímetros de plomo. Para Millikan, esto sugería que la radiación se parecía a la de los penetrantes rayos gamma, pero con una longitud de onda más corta.
Otros, sobre todo el físico norteamericano Holly Compton, no estaban de acuerdo en que los rayos cósmicos fuesen partículas. Había un medio para investigar este asunto; si se trataba de partículas cargadas, deberían ser rechazadas por el campo magnético de la Tierra al aproximarse a nuestro planeta desde el espacio exterior. Compton estudió las mediciones de la radiación cósmica en varias latitudes y descubrió que en realidad se curvaban con el campo magnético: era más débil cera del ecuador magnético y más fuerte cerca de los polos, donde las líneas de fuerza magnética se hundían más en la Tierra.
Las partículas cósmicas primarias, cuando entran en nuestra atmósfera, llevan consigo unas energías fantásticas, muy elevadas. En general, cuanto más pesado es el núcleo, más raro resulta entre las partículas cósmicas. Núcleos tan complejos como los que forman los átomos de hierro se detectaron con rapidez; en 1.968, otros núcleos como el del uranio. Los núcleos de uranio constituyen sólo una partícula entre 10 millones. También se incluirán aquí electrones de muy elevada energía.
Ahora bien, la siguiente partícula inédita (después del neutrón) se descubrió en los rayos cósmicos. A decir verdad, cierto físico teórico había predicho ya este descubrimiento. Paul Adrien Dirac había aducido, fundándose en un análisis matemático de las propiedades inherentes a las partículas subatómicas, que cada partícula debería tener su antipartícula (los científicos desean no sólo que la naturaleza sea simple, sino también simétrica). Así pues, debería haber un antielectrón, salvo por su carga que sería positiva y no negativa, idéntico al electrón; y un antiprotón, con carga negativa en vez de positiva.
En 1.930, cuando Dirac expuso su teoría, no llamó demasiado la atención en el mundo de la ciencia. Pero, fiel a la cita, dos años después apareció el antielectrón. Por entonces, el físico americano Carl David Anderson trabajaba con Millikan en un intento por averiguar si los rayos cósmicos eran radiación electromagnética o partículas. Por aquellas fechas, casi todo el mundo estaba dispuesto a aceptar las pruebas presentadas por Compton, según las cuales, se trataría de partículas cargadas; pero Millikan no acababa de darse por satisfecho con tal solución.

La existencia de los pòsitrones puede llegar a ser indefinida, lo que ocurre es que, al estar en un universo repleto de electrones, cuando apenas han iniciado su veloz carrera se encuentran con uno y, su carrera, dura apenas una millonésima de segundo y, el electrón y el positrón quedan asociados y giran alrededor de un centro de fuerza común

Anderson se propuso averiguar si los rayos cósmicos que penetraban en una cámara de ionización se curvaban bajo la acción de un potente campo magnético. Al objeto de frenar dichos rayos lo suficiente como para detectar la curvatura, si la había, puso en la cámara una barrera de plomo de 6’35 mm de espesor. Descubrió que, cuando cruzaba el plomo, la radiación cósmica trazaba una estela curva a través de la cámara; y descubrió algo más. A su paso por el plomo, los rayos cósmicos energéticos arrancaban partículas de los átomos de plomo. Una de esas partículas dejó una estela similar a la del electrón. ¡Allí estaba, pues, el antielectrón de Dirac! Anderson le dio el nombre de positrón. Tenemos aquí un ejemplo de radiación secundaria producida por rayos cósmicos. Pero aún había más, pues en 1.963 se descubrió que los positrones figuraban también entre las radiaciones primarias.
Abandonado a sus propios medios, el positrón es tan estable como el electrón (¿y por qué no habría de serlo si el idéntico al electrón, excepto en su carga eléctrica?). Además, su existencia puede ser indefinida. Ahora bien, en realidad no queda abandonado nunca a sus propios medios, ya que se mueve en un universo repleto de electrones. Apenas inicia su veloz carrera (cuya duración ronda la millonésima de segundo), se encuentra ya con uno.
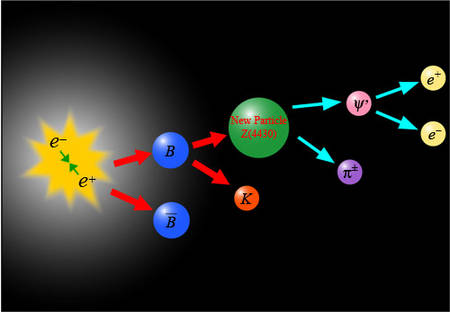
Así, durante un momento relampagueante quedaron asociados el electrón y el positrón; ambas partículas girarán en torno a un centro de fuerza común. En 1.945, el físico americano Arthur Edwed Ruark sugirió que se diera el nombre de positronio a este sistema de dos partículas, y en 1.951, el físico americano de origen austriaco Martin Deutsch consiguió detectarlo guiándose por los rayos gamma característicos del conjunto.
Pero no nos confundamos, aunque se forme un sistema positronio, su existencia durará, como máximo, una diezmillonésima de segundo. El encuentro del electrón-positrón provoca un aniquilamiento mutuo; sólo queda energía en forma de radiación gamma. Ocurre pues, tal como había sugerido Einstein: la materia puede convertirse en energía y viceversa. Por cierto, que Anderson consiguió detectar muy pronto el fenómeno inverso: desaparición súbita de rayos gamma para dar origen a una pareja electrón-positrón. Este fenómeno se llama producción en pareja. Anderson compartió con Hess el premio Nobel de Física de 1.936.
Poco después, los Joliot-Curie detectaron el positrón por otros medios, y al hacerlo así realizaron, de paso, un importante descubrimiento. Al bombardear los átomos de aluminio con partículas alfa, descubrieron que con tal sistema no sólo se obtenían protones, sino también positrones. Cuando suspendieron el bombardeo, el aluminio siguió emitiendo positrones, emisión que sólo con el tiempo se debilitó. Aparentemente habían creado, sin proponérselo, una nueva sustancia radiactiva. He aquí la interpretación de lo ocurrido según los Joliot-Curie: cuando un núcleo de aluminio absorbe una partícula alfa, la adición de los dos protones transforma el aluminio (número atómico 13) en fósforo (número atómico 15). Puesto que las partículas alfa contienen cuatro nucleones en total, el número masivo se eleva 4 unidades, es decir, del aluminio 27 al fósforo 31. Ahora bien, si al reaccionar se expulsa un protón de ese núcleo, la reducción en una unidad de sus números atómicos y masivos hará surgir otro elemento, o sea, el silicio 30.
Puesto que la partícula alfa es el núcleo del helio, y un protón es el núcleo del hidrógeno, podemos escribir la siguiente ecuación de esta reacción nuclear:
aluminio 27 + helio 4 = silicio 30 + hidrógeno 1
Nótese que los números másicos se equilibran:
27 + 4 = 30 + 1
Adentrarse en el universo de las partículas que componen los elementos de la tabla periódica, y en definitiva, la materia conocida, es verdaderamente fantástico.
Tan pronto como los Joliot-Curie crearon el primer isótopo radiactivo artificial, los físicos se lanzaron en tropel a producir tribus enteras de ellas. En realidad, las variedades radiactivas de cada elemento en la tabla periódica son producto de laboratorio. En la moderna tabla periódica, cada elemento es una familia con miembros estables e inestables, algunos procedentes de la naturaleza, otros sólo del laboratorio. Por ejemplo, el hidrógeno presenta tres variedades: en primer lugar, el corriente, que tienen un solo protón. En 1.932, el químico Harold Urey logró aislar el segundo. Lo consiguió sometiendo a lenta evaporación una gran cantidad de agua, de acuerdo con la teoría de que los residuos representarían una concentración de la forma más pesada del hidrógeno que se conocía, y, en efecto, cuando se examinaron al espectroscopio las últimas gotas de agua no evaporadas, se descubrió en el espectro una leve línea cuya posición matemática revelaba la presencia de hidrógeno pesado.
El núcleo de hidrógeno pesado está constituido por un protón y un neutrón. Como tiene un número másico de 2, el isótopo es hidrógeno. Urey llamó a este átomo deuterio (de la voz griega deutoros, “segundo”), y el núcleo deuterón. Una molécula de agua que contenga deuterio se denomina agua pesada, que tiene puntos de ebullición y congelación superiores al agua ordinaria, ya que la masa del deuterio es dos veces mayor que la del hidrógeno corriente. Mientras que ésta hierve a 100º C y se congela a 0º C, el agua pesada hierve a 101’42º C y se congela a 3’79º C. El punto de ebullición del deuterio es de -23’7º K, frente a los 20’4º K del hidrógeno corriente. El deuterio se presenta en la naturaleza en la proporción de una parte por cada 6.000 partes de hidrógeno corriente. En 1.934 se otorgó a Urey el premio Nobel de Química por su descubrimiento del deuterio.

El deuterio resultó ser una partícula muy valiosa para bombardear los núcleos. En 1.934, el físico australiano Marcus Lawrence Edwin Oliphant y el austriaco P. Harteck atacaron el deuterio con deuterones y produjeron una tercera forma de hidrógeno, constituido por un protón y dos neutrones. La reacción se planteó así:
hidrógeno 2 + hidrógeno 2 = hidrógeno 3 + hidrógeno 1
Este nuevo hidrógeno superpesado se denominó tritio (del griego tritos, “tercero”); su ebullición a 25º K y su fusión a 20’5º K.
Como es mi costumbre, me desvío del tema y sin poderlo evitar, mis ideas (que parecen tener vida propia), cogen los caminos más diversos. Basta con un fugaz recuerdo; lo sigo y me lleva a destinos distintos de los que me propuse al comenzar. Así, en este caso, me pasé a la química, que también me gusta mucho y está directamente relacionada con la física; de hecho son hermanas: la madre, las matemáticas, la única que finalmente lo podrá explicar todo.
emilio silvera
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Seguimos elucubrando ~
Clasificado en Seguimos elucubrando ~
 Comments (4)
Comments (4)

Esplendoroso Arco de la Vía Láctea desde Monument Valley en los Estados Unidos. Aquí, como en otros muchos rincones de nuestro planeta Tierra, podemos contemplar esa inmensidad, ese carrusel de estrellas, gas y polvo que conforma la Galaxia espiral en kla que nos encontramos, y, de la misma manera, otros muchos cientos de miles de mundos, también podrán ser el habitat de criaturas inteligentes que, como nosotros, se ven allí confinadas sin poder recorrer “infinitas” distancias que las separan de otras civilizaciones situadas a decenas, cientos o miles de años-luz de ellos. Lo explica bien el reportaje publicado por El País.


Artículo originalmente escrito por Tim Urban. Traducción de Eva Millán.
Todo el mundo siente algo cuando está en un sitio desde el que se ven muy bien las estrellas en una noche especialmente estrellada y mira hacia arriba y ve esto.
Algunos prefieren lo tradicional y se sobrecogen por la belleza épica del universo o les impresiona su absurda escala. Yo, personalmente, me decanto por la clásica “crisis existencial y posterior comportamiento extraño durante la siguiente media hora”. Pero todo el mundo siente algo.
El físico Enrico Fermi también sintió algo: ”¿Dónde está todo el mundo?”.
Un cielo repleto de estrellas parece enorme… pero lo que vemos no es más que nuestro vecindario más próximo. En las mejores noches posibles podemos ver hasta 2.500 estrellas (aproximadamente una cienmillonésima parte de las estrellas de nuestra galaxia), y casi todas ellas están a menos de 1.000 años luz de nosotros (o un 1% del diámetro de la Vía Láctea). Así que a lo que realmente estamos mirando es a esto:

Nick Risinger
Cuando se enfrentan al tema de las estrellas y galaxias, una pregunta que atormenta a la mayoría de los humanos es: “¿Hay más vida inteligente ahí fuera?”. Veamos algunos números.
Hay tantas estrellas en nuestra galaxia (100.000 – 400.000 millones) como galaxias hay en el universo observable, aproximadamente, así que por cada estrella en la colosal Vía Láctea hay toda una galaxia ahí fuera. Si las sumamos todas llegamos al intervalo típicamente citado de entre 1022 y 1024 estrellas en total, lo que significa que por cada grano de arena en cada playa de la Tierra hay 10.000 estrellas ahí fuera.
El mundo científico no acaba de ponerse de acuerdo sobre qué porcentaje de esas estrellas son de “tipo solar” (similares al Sol en tamaño, temperatura y luminosidad): las opiniones suelen estar entre el 5% y el 20%. Quedándonos con el cálculo más conservador (5%), y el extremo más bajo del número total de estrellas (1022), nos da 500 trillones o 500 millones de billones de estrellas de tipo solar.
También hay un debate sobre qué porcentaje de esas estrellas de tipo solar podrían ser orbitadas por un planeta similar a la Tierra (uno con temperatura y condiciones similares que pudiese tener agua líquida y albergar potencialmente una vida similar a la de la Tierra). Algunos dicen que serían hasta el 50% de ellas, pero vamos a quedarnos con el más conservador 22% que se extrajo de un estudio reciente de la PNAS. Esto sugiere que hay un planeta potencialmente habitable como la Tierra orbitando alrededor de al menos un 1% del total de estrellas del universo —un total de 100 millones de billones de planetas parecidos a la Tierra.
Así que hay 100 planetas análogos a la Tierra por cada grano de arena del mundo. Piensa en ello la próxima vez que estés en la playa.
A partir de aquí no tenemos más remedio que entrar completamente en el terreno de la especulación. Imaginemos que después de millones y millones de años de existencia, un 1% de esos planetas parecidos a la Tierra desarrollan vida (si eso es verdad, cada grano de arena representaría un planeta con vida en él). E imagina que, en el 1% de esos planetas, la vida avanza hasta un nivel inteligente como lo hizo aquí en la Tierra. Esto significa que habría 10.000 billones de civilizaciones inteligentes en el universo observable.
Volviendo a nuestra galaxia y haciendo el mismo cálculo con la estimación más baja de estrellas en la Vía Láctea (100.000 millones), obtendríamos que hay mil millones de planetas análogos a la Tierra y 100.000 civilizaciones inteligentes en nuestra galaxia.
El SETI (Search for Extraterrestial Intelligence, o Búsqueda de inteligencia extraterrestre) es una organización dedicada a prestar atención a las señales de vida inteligente. Si estamos en lo cierto y hay 100.000 civilizaciones inteligentes o más en nuestra galaxia, e incluso si solo una fracción de ellas está enviando ondas de radio o rayos láser u otros modos de intentar contactar con otros, ¿no debería la colección de satélites del SETI estar captando todo tipo de señales?
Pero no lo ha hecho. Ni una. Nunca.
¿Dónde está todo el mundo?
Y la cosa se vuelve aún más extraña. Nuestro sol es bastante joven comparado con la edad del universo. Hay estrellas mucho más viejas con planetas parecido a la Tierra mucho más viejos, lo que en teoría debería haber dado civilizaciones mucho más avanzadas que la nuestra. Por poner un ejemplo, vamos a comparar nuestra Tierra de 4.540 millones de años con un hipotético Planeta X de 8.000 millones de años de edad.
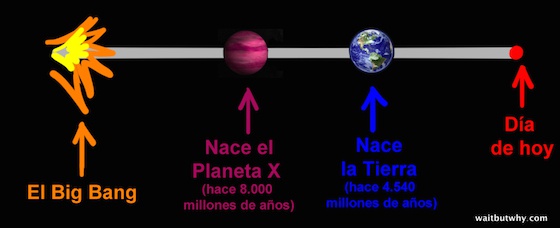
Si el Planeta X tiene una historia parecida a la de la Tierra, veamos en qué punto estaría su civilización a día de hoy (usamos como referencia el periodo naranja para mostrar lo enorme que es el periodo verde):
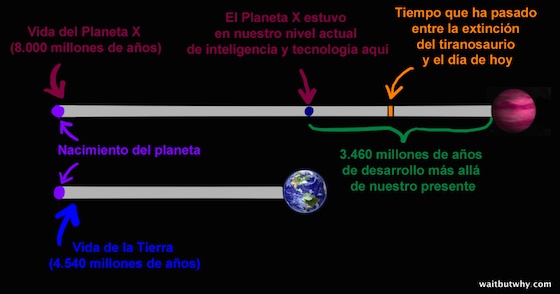
La tecnología y el conocimiento de una civilización tan solo 1.000 años por delante de nosotros nos resultarían tan chocantes como lo sería nuestro mundo para una persona medieval. Una civilización con un millón de años de adelanto con respecto a la nuestra sería tan incomprensible para nosotros como lo es nuestra cultura humana para los chimpancés. Y el Planeta X nos lleva 3.400 millones de años de ventaja…
Hay algo llamado Escala de Kardashov que nos ayuda a agrupar civilizaciones inteligentes en tres amplias categorías según la cantidad de energía que usan:
Una Civilización Tipo I tiene la habilidad de usar toda la energía de su planeta. Nosotros no llegamos a ser un Tipo I del todo, pero nos quedamos cerca (Carl Sagan creó una fórmula para esta escala que nos sitúa en una civilización Tipo 0,7).
Una Civilización Tipo II puede aprovechar toda la energía de su estrella anfitriona. Nuestros débiles cerebros apenas pueden imaginar cómo se podría hacer esto, pero lo hemos intentado lo mejor que hemos podido, imaginando cosas como la esfera de Dyson.
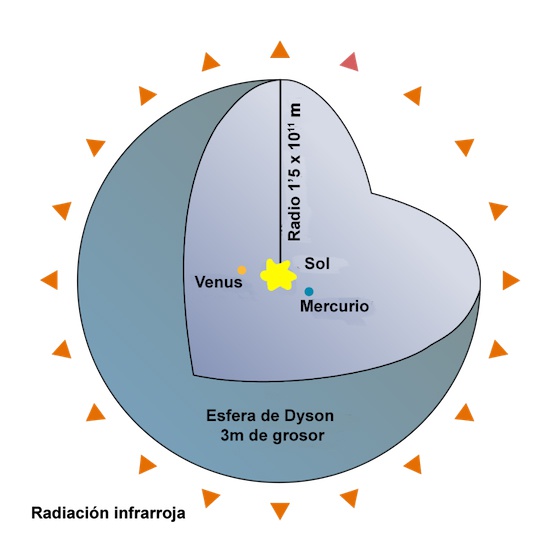
Una Civilización Tipo III arrasa a las otras dos, accediendo a un poder comparable al de toda la galaxia de la Vía Láctea.
Si este nivel de avance parece difícil de creer, recuerda el Planeta X de antes y sus 3.400 millones de años de desarrollo de ventaja. Si una civilización del Planeta X fuera parecida a la nuestra y hubiera sido capaz de sobrevivir hasta llegar al nivel del Tipo III, lo natural es que probablemente ya hubiera dominado el viaje interestelar, incluso podría haber colonizado toda la galaxia.
Otra hipótesis de cómo podría producirse la colonización galáctica sería creando maquinaria que pueda viajar a otros planetas, pasarse unos 500 años autorreplicándose usando las materias primas del nuevo planeta y después mandar dos réplicas a hacer lo mismo. Incluso sin viajar a una velocidad que no se acerque ni a la de la luz, este proceso colonizaría toda la galaxia en 3,75 millones de años, un relativo abrir y cerrar de ojos cuando hablamos de una escala de miles de millones de años:
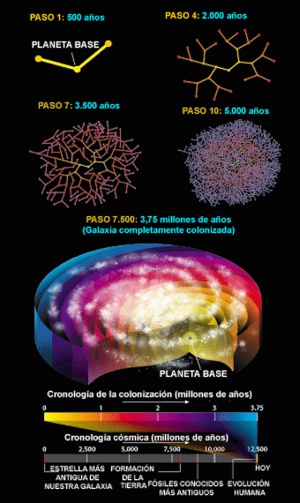
Fuente: Scientific American, “Where Are They”
Siguiendo con la especulación, si un 1% de la vida inteligente sobrevive el tiempo suficiente como para llegar a ser una civilización Tipo III colonizadora de galaxias, nuestros cálculos de antes sugieren que debería haber al menos 1.000 civilizaciones Tipo III solo en nuestra galaxia —y teniendo en cuenta el poder de tal civilización, lo más probable es que su presencia fuera bastante notoria. Y, aun así, no vemos nada, no oímos nada y no nos visita nadie.
Bienvenido a la paradoja de Fermi.
No tenemos respuesta para la paradoja de Fermi —como mucho podemos ofrecer “posibles explicaciones”. Y si preguntas a diez científicos distintos cuál creen que es la correcta, te darán diez respuestas distintas. ¿Recuerdas cuando los humanos del pasado debatían sobre si la Tierra era redonda o si el Sol giraba alrededor de la Tierra o pensaban que ese rayo había caído por Zeus, y ahora nos resultan tan primitivos y desinformados? Pues así es cómo estamos nosotros con este tema.
Para echarle un vistazo a algunas de las explicaciones posibles de la paradoja de Fermi más debatidas, vamos a dividirlas en dos amplias categorías —aquellas explicaciones que entienden que si no hay ningún indicio de las civilizaciones de Tipo II y Tipo III es porque no existe ninguna de ellas ahí fuera, y aquellas otras que asumen que sí que están ahí fuera, pero no estamos viendo ni oyendo nada de ellas por otras razones:
Grupo 1 de explicaciones: no hay indicios de civilizaciones superiores (Tipo II y III) porque no existen civilizaciones superiores.
Aquellos que suscriben las explicaciones del Grupo 1 señalan algo llamado el problema de la no exclusividad, que rechaza cualquier teoría que diga “hay civilizaciones superiores, pero ninguna de ellas ha establecido ningún tipo de contacto con nosotros porque todas”. La gente del Grupo 1 se fija en los cálculos que dicen que debería haber tantos miles (o millones) de civilizaciones superiores que al menos una de ellas debería ser la excepción a la regla. Incluso si esa teoría afectara al 99,99% de las civilizaciones, el otro 0,01% se comportaría de forma distinta y seríamos conscientes de su existencia.
Por tanto, dicen las explicaciones del Grupo 1, debe ser que no existen civilizaciones super avanzadas. Y como los cálculos sugieren que hay miles de ellas tan solo en nuestra galaxia, algo más debe de estar pasando.
Ese algo más se llama El Gran Filtro.
La teoría del Gran Filtro dice que, en algún punto desde la pre-vida hasta la inteligencia Tipo III, hay un muro contra el que todos o casi todos los intentos de vida chocan. Hay alguna etapa del largo proceso evolutivo que es extremadamente improbable o imposible que la vida supere. Esa etapa es el Gran Filtro.
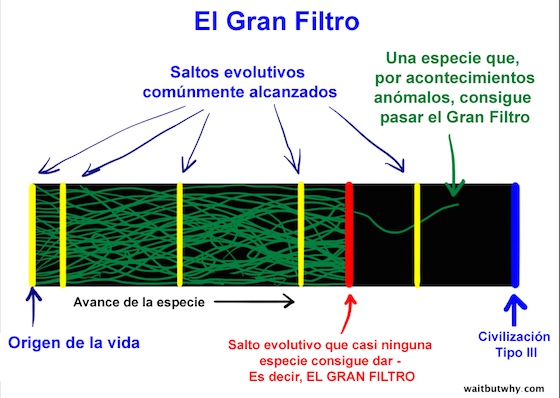
Si esta teoría es cierta, la gran pregunta es ¿en qué punto de la línea temporal ocurre el Gran Filtro?.
Resulta que, cuando estamos hablando del destino de la humanidad, esta pregunta es muy importante. Dependiendo de dónde ocurra el Gran Filtro, nos deja tres realidades posibles: somos excepcionales, somos los primeros, o estamos jodidos.
1. Somos excepcionales (el Gran Filtro está detrás de nosotros)
Una esperanza que tenemos es que el Gran Filtro esté detrás de nosotros —hemos conseguido superarlo, lo que significaría que es extremadamente inusual que la vida llegue a nuestro nivel de inteligencia. El diagrama de abajo muestra solo a dos especies consiguiendo pasarlo, y nosotros somos una de ellas.
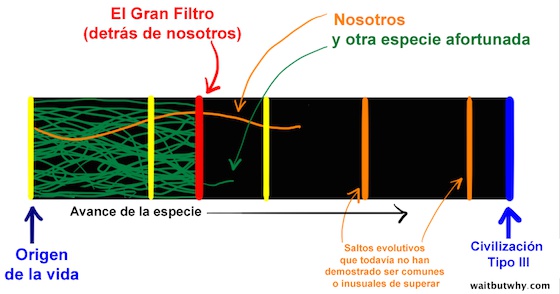
Este escenario explicaría por qué no hay civilizaciones Tipo III… pero también significaría que nosotros podríamos ser una de las pocas excepciones ahora que hemos conseguido llegar tan lejos. Significaría que hay esperanza. Superficialmente, esto suena un poco a la gente de hace 500 años sugiriendo que la Tierra es el centro del universo —implica que somos especiales. Sin embargo, algo que los científicos llaman “sesgo antrópico” sugiere que cualquiera que se plantee su propia rareza forma parte inherentemente de un “caso de éxito” de la vida inteligente -y ya sean realmente inusuales o bastante comunes, los pensamientos que se plantean y las conclusiones que sacan serán idénticos. Esto nos obliga a admitir que ser especiales es, al menos, una posibilidad.
Y, si somos especiales, ¿exactamente cuándo nos convertimos en especiales? —esto es, ¿qué paso superamos en el que casi todos los demás se quedan atascados?
Una posibilidad: el Gran Filtro podría estar muy al principio —podría ser increíblemente inusual que la vida comenzase en absoluto. Esta es una candidata porque hicieron falta unos mil millones de años de existencia de la Tierra para que finalmente ocurriera, y porque hemos intentado minuciosamente replicar tal acontecimiento en laboratorios y nunca hemos podido hacerlo. Si este es efectivamente el Gran Filtro, significaría que no solo no hay vida inteligente ahí fuera, sino que puede que no haya ningún otro tipo de vida.
Otra posibilidad: el Gran Filtro podría ser el salto de la simple célula procariota a la compleja célula eucariota. Después de que las procariotas nacieran, se quedaron tal cual durante casi dos mil millones de años antes de dar el salto evolutivo de ser complejas y tener un núcleo. Si este es el Gran Filtro, significaría que el universo está repleto de células procariotas simples y casi nada más allá de eso.
Hay varias posibilidades más —algunos llegan a pensar que el salto más reciente que hemos dado hasta nuestra inteligencia actual es un candidato para ser el Gran Filtro. Aunque el paso de vida semi-inteligente (chimpancés) a vida inteligente (humanos) no parece a primera vista un salto milagroso, Steven Pinker rechaza la idea de un “ascenso” inevitable de la evolución: “Ya que la evolución no aspira a una meta sino que simplemente ocurre, usa la adaptación más útil para un nicho ecológico dado, y el hecho de que, en la Tierra, esto haya conducido a la vida inteligente solo una vez hasta el momento puede sugerir que este resultado de la evolución natural es infrecuente y por lo tanto de ningún modo es un desarrollo indiscutible de la evolución de un árbol de la vida”.
La mayoría de los saltos no reúnen los requisitos para ser un candidato a Gran Filtro. Cualquier Gran Filtro tiene que ser un tipo de cosa entre un millón en la que una o más ocurrencias totalmente anormales tienen que ocurrir para facilitar una excepción absurda —por eso, algo como el paso de vida unicelular a pluricelular está descartado, porque ha ocurrido hasta 46 veces, en incidentes aislados, tan solo en nuestro planeta. Por la misma razón, en caso de encontrarnos una célula eucariota fosilizada en Marte, se descartaría el salto de más arriba de “célula simple a compleja” como posible Gran Filtro (así como cualquier cosa anterior a ese punto en la cadena evolutiva) —porque si ha ocurrido tanto en la Tierra como en Marte, casi con toda seguridad no se trata de una ocurrencia anómala de las de una-entre-un-millón.
Si en efecto somos excepcionales, podría ser por un acontecimiento biológico accidental, pero también podría atribuirse a lo que llamamos la Hipótesis de la Tierra Especial, que sugiere que, aunque puede que haya muchos planetas parecidos a la Tierra, las condiciones particulares de la Tierra —ya estén relacionadas con las particularidades de este sistema solar, su relación con la luna (una luna tan grande es inusual para un planeta tan pequeño y contribuye a nuestra meteorología y condiciones oceánicas particulares), o algo del propio planeta —son excepcionalmente acogedoras para la vida.
2. Somos los primeros
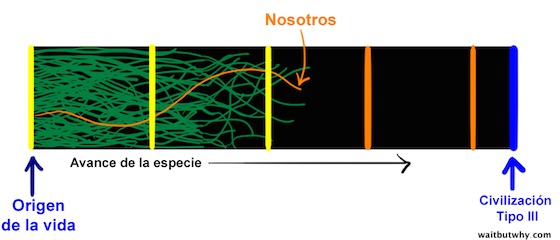
Para los Pensadores del Grupo 1, si el Gran Filtro no se encuentra detrás de nosotros, la única esperanza que nos queda es que las condiciones del universo estén desde hace poco, por primera vez desde el Big Bang, llegando a un punto que permitiría desarrollar vida inteligente. En ese caso, nosotros, junto con muchas otras especies, podríamos estar dirigiéndonos a la super inteligencia, y simplemente no habría ocurrido todavía. Estaríamos aquí justo en el momento adecuado para llegar a ser una de las primeras civilizaciones super inteligentes.
Un ejemplo de fenómeno que podría hacer esto realista es el predominio de brotes de rayos gamma, explosiones increíblemente grandes que hemos observado en galaxias lejanas. De la misma manera que la Tierra primigenia tardó unos cientos de millones de años antes de que amainaran los asteroides y los volcanes y la vida fuera posible, podría ser que el primer trozo de la existencia del universo estuviera lleno de acontecimientos catastróficos como los brotes de rayos gamma que incinerasen todo alrededor de vez en cuando e impidiesen que la vida se desarrollase más allá de una cierta fase. Tal vez ahora nos encontramos en un cambio de fase astrobiológica y esta es la primera vez que una forma de vida ha podido evolucionar tanto tiempo ininterrumpidamente.
3. Estamos jodidos (el Gran Filtro está por delante de nosotros)
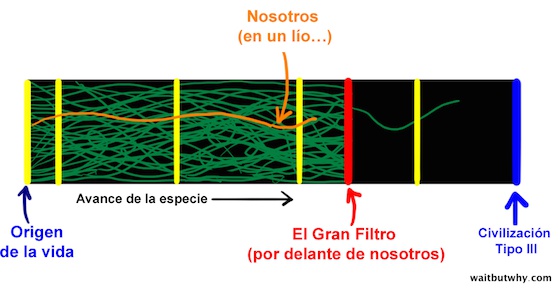
Si no somos ni excepcionales ni precoces, los pensadores del Grupo 1 concluyen que el Gran Filtro debe estar en nuestro futuro. Esto sugeriría que la vida evoluciona periódicamente hasta donde estamos nosotros, pero que algo impide a la vida avanzar más allá y alcanzar una inteligencia superior en casi todos los casos —y es poco probable que nosotros seamos una excepción.
Un Gran Filtro futuro posible es un suceso natural catastrófico que ocurra periódicamente, como los brotes de rayos gamma que mencionamos antes, solo que desafortunadamente aún no han acabado y es solo cuestión de tiempo antes de que toda la vida de la Tierra sea aniquilada por uno de ellos. Otro candidato es la posible fatalidad de que casi todas las civilizaciones acaben autodestruyéndose una vez alcanzan un cierto nivel de tecnología.
Esto es por lo que el filósofo de la Universidad de Oxford Nick Bostrom dice que “el que no haya noticias es una buena noticia”. El descubrimiento de incluso vida sencilla en Marte sería devastador, porque eliminaría una gran cantidad de potenciales Grandes Filtros detrás de nosotros. Y si encontrásemos vida compleja fosilizada en Marte, Bostrom dice que “sería de lejos la peor noticia jamás impresa en la portada de un periódico”, porque significaría que el Gran Filtro estaría casi definitivamente por delante de nosotros —condenando a la larga a la especie. Bostrom cree que cuando se trata de la paradoja de Fermi, “el silencio del cielo nocturno vale oro”.
Grupo 2 de explicaciones: las civilizaciones inteligentes Tipo II y III están ahí fuera -y hay razones lógicas por las que podríamos no saber de ellas.
Las explicaciones del Grupo 2 eliminan cualquier noción de que somos excepcionales o los primeros de nada —por el contrario, creen en el principio de mediocridad, cuyo punto de partida es que nuestra galaxia, sistema solar, planeta o nivel de inteligencia no tienen nada de inusual ni de excepcional hasta que se demuestre lo contrario. También son mucho menos proclives a asumir que la falta de pruebas de seres de inteligencia superior sea una prueba de su no existencia —haciendo hincapié en el hecho de que nuestra búsqueda de señales se extiende solo hasta unos 100 años luz de lejos de nosotros (0,1% de la galaxia) y sugiriendo una serie de posibles explicaciones. He aquí diez:
Posibilidad 1) La vida super inteligente bien podría haber visitado ya la Tierra, pero antes de que estuviésemos aquí. En el gran contexto del universo, los seres humanos conscientes solo han estado presentes unos 50.000 años, un segundillo. Si hubo contacto antes de eso, podría haber hecho flipar a unos patos que habrían salido corriendo hacia el agua y ya. Además, la historia escrita solo se remonta 5.500 años —un grupo de cazadores-recolectores podría haber experimentado una movida muy loca con aliens, pero no tenían ninguna forma de contárselo a nadie del futuro.
Posibilidad 2) La galaxia ya ha sido colonizada, pero resulta que vivimos en una zona rural y desierta de la galaxia. Los europeos podrían haber colonizado las Américas mucho antes de que nadie en una pequeña tribu inuit en el extremo norte de Canadá se hubiera enterado de lo que había pasado. Podría haber un elemento de urbanización en los asentamientos interestelares de las especies superiores, en que todos los sistemas solares cercanos son colonizados y comunicados entre sí, pero no sería práctico ni tendría sentido que nadie se dedicara a venir aquí a una parte remota de la espiral en la que vivimos.
Posibilidad 3) Todo el concepto de colonización física le resulta un concepto delirantemente atrasado a las especies más avanzadas. ¿Recuerdas la imagen de la civilización Tipo II de antes con la esfera sobre su estrella? Con toda esa energía, podrían haber creado el medio ambiente perfecto para sí mismos que satisficiera todas sus necesidades. Podrían tener formas demencialmente avanzadas de reducir su necesidad de recursos y ningún interés por dejar su feliz utopía para explorar el frío, vacío y subdesarrollado universo.
Una civilización aún más avanzada podría considerar todo el mundo físico como un lugar terriblemente primitivo, habiendo conquistado ya hace tiempo su propia biología y cargado sus cerebros en un paraíso de vida eterna en la realidad virtual. La vida en el mundo físico de la biología, mortalidad, deseos y necesidades podría ser para ellos como vemos nosotros a las especies oceánicas primitivas que viven en el mar gélido y oscuro. Para tu información, pensar en otra especie que haya dominado la mortalidad me hace sentir envidia y tristeza.
Posibilidad 4) Hay civilizaciones depredadoras aterradoras ahí fuera y la mayor parte de la vida inteligente sabe que es mejor no emitir señales al exterior y anunciar su ubicación. Este es un concepto desagradable y ayudaría a explicar la falta de señales recibidas por los satélites del SETI. También quiere decir que nosotros podríamos ser los novatos super ingenuos que están siendo increíblemente estúpidos y arriesgados al transmitir señales al exterior. Hay un debate ahora mismo sobre si deberíamos participar en METI (Messaging to Extraterrestrial Intelligence —lo contrario del SETI) o no, y la mayoría dice que no deberíamos. Stephen Hawking advierte de que “si los alienígenas nos visitasen, las consecuencias serían como cuando Colón llegó a América, lo que no salió muy bien para los nativos americanos”. Incluso Carl Sagan (un partidario por lo general de que cualquier civilización lo suficientemente avanzada para el viaje interestelar sería altruista, no hostil) llamó a la práctica de METI “profundamente imprudente e inmadura”, y recomendó que “los chicos más nuevos en un cosmos extraño e incierto deberían escuchar en silencio durante mucho tiempo, aprendiendo pacientemente sobre el universo y comparando apuntes, antes de gritarle a una jungla desconocida que no entendemos”. Miedo.
Posibilidad 5) Solo hay un caso de vida con inteligencia superior -una civilización “super depredadora” (como lo son los humanos aquí en la Tierra)- que está mucho más avanzada que todas las demás y se mantiene en esa posición exterminando cualquier civilización inteligente una vez pasan un cierto nivel. Esto sería una mierda. Podría ser así: exterminar a todas las inteligencias emergentes es un uso ineficiente de recursos, seguramente porque la mayoría se extinguen solas. Pero pasado un cierto punto, los super seres mueven ficha —porque para ellos, una especie inteligente emergente se vuelve como un virus una vez empieza a crecer y expandirse. Esta teoría sugiere que el que fuera el primero de la galaxia en alcanzar la inteligencia ganó, y ahora nadie más tiene ninguna posibilidad. Esto explicaría la falta de actividad ahí fuera porque el número de civilizaciones super inteligentes sería solo una.
Posibilidad 6) Hay un montón de actividad y ruido ahí fuera, pero nuestra tecnología es demasiado primitiva y estamos prestando atención a las cosas equivocadas. Como si entrases en un edificio de oficinas moderno, encendieses un walkie-talkie, y cuando no escuchases ninguna actividad (que por supuesto no escucharías porque todo el mundo está hablando por WhatsApp, no usando walkie-talkies), concluyeras que el edificio debe de estar vacío. O tal vez, como ha señalado Carl Sagan, podría ser que nuestras mentes funcionan exponencialmente más rápido o más despacio que otra forma de inteligencia exterior —por ejemplo, ellos tardan 12 años en decir “Hola”, y cuando oímos esa comunicación, nos suena a ruido.
Posibilidad 7) Estamos contactando con otra vida inteligente, pero el gobierno lo oculta. Cuanto más leo sobre el tema, más me parece una teoría estúpida, pero tenía que mencionarla porque se habla mucho de ella.
Posibilidad. Las civilizaciones superiores son conscientes de nuestra existencia y nos están observando (también conocida como “la hipótesis del zoológico”). Por lo que sabemos, las civilizaciones super inteligentes existen en una galaxia firmemente regulada, y a nuestra Tierra la tratan como parte de un enorme parque natural protegido, con una política estricta de “se mira, pero no se toca” para planetas como el nuestro. Nosotros no los percibiríamos, porque si una especie mucho más lista quisiera observarnos, sabría hacerlo fácilmente sin que nosotros nos diéramos cuenta. A lo mejor hay una regla parecida a la “Primera Directiva” de Star Trek, que prohíbe a los seres super inteligentes establecer ningún contacto abierto con especies inferiores como nosotros o mostrarse de ningún modo hasta que la especie inferior haya alcanzado cierto nivel de inteligencia.
Posibilidad 9) Las civilizaciones superiores están aquí, a nuestro alrededor. Pero somos demasiado primitivos como para percibirlas. Michio Kaku lo resume así:
Digamos que hay un hormiguero en medio del bosque. Y justo al lado del hormiguero construyen una superautopista de diez carriles. Y la pregunta es “¿Serían las hormigas capaces de entender qué es una superautopista de diez carriles? ¿Serían capaces las hormigas de entender la tecnología y las intenciones de los seres que construyen la autopista a su lado?”.
Así que no es que no podamos recibir las señales del Planeta X usando nuestra tecnología, es que ni siquiera podemos comprender qué son los seres del Planeta X o lo que intentan hacer. Está tan por encima de nosotros que incluso si realmente hubieran querido explicárnoslo, sería como intentar enseñarle a las hormigas qué es internet.
Así mismo, esto podría responder también a “Bueno, si hay tantas sofisticadas civilizaciones Tipo III, ¿por qué no han contactado con nosotros todavía?”. Para responder a eso, preguntémonos —cuando Pizarro se adentró en Perú, ¿se paró un momento en un hormiguero a intentar comunicarse? ¿Fue magnánimo, intentando ayudar a las hormigas del hormiguero? ¿Se volvió hostil y frenó su misión original para ponerse a destrozar el hormiguero? ¿O fue el hormiguero completamente irrelevante para Pizarro? Esa podría ser nuestra situación.
Situación 10) Estamos completamente equivocados con respecto a nuestra realidad. Hay muchas maneras de las que podríamos simplemente estar totalmente equivocados en todo lo que pensamos. El universo podría parecer de una forma y ser cualquier otra cosa completamente diferente, como un holograma. O a lo mejor nosotros somos los alienígenas y nos han plantado aquí como un experimento o como una forma de fertilizante. Incluso existe la posibilidad de que todos formemos parte de una simulación por ordenador de algún investigador de otro mundo, y que otras formas de vida simplemente no hubieran sido programadas en la simulación.

Mientras nuestra posiblemente inútil búsqueda de inteligencia extraterrestre continúa, no estoy del todo seguro de mi postura. Francamente, descubrir tanto que estamos oficialmente solos en el universo como oficialmente acompañados por otros sería escalofriante, lo que es común a todas las tramas surrealistas listadas anteriormente —sea cual sea realmente la verdad, es alucinante.
Más allá de su sorprendente componente de ciencia ficción, la paradoja de Fermi también me deja un profundo sentimiento de humildad. No solo la típica humildad de “oh, sí, soy microscópico y mi existencia dura tres segundos” que siempre despierta el universo. La paradoja de Fermi revela una humildad más afilada y personal, una que solo puede darse tras pasarte horas de investigación, escuchando a los científicos más reconocidos de tu especie presentar teorías demenciales, cambiar de opinión una y otra vez y contradecirse violentamente unos a otros —recordándonos que las generaciones futuras nos verán igual que vemos nosotros a los antiguos que estaban seguros de que las estrellas eran la cara inferior de la bóveda del cielo, y pensarán “madre mía, realmente no tenían ni idea de lo que ocurría”.
Para agravar la situación, está el golpe a la autoestima de nuestra especie que conlleva toda esta charla de civilizaciones Tipo II y III. Aquí en la Tierra somos los reyes de nuestro pequeño mundo, orgullosos de reinar sobre el enorme grupo de imbéciles con los que compartimos planeta. Y en esta burbuja sin competencia y sin nadie que nos juzgue, es poco frecuente que nos enfrentemos al concepto de ser una especie dramáticamente inferior a nadie. Pero después de pasar mucho tiempo con las Civilizaciones Tipo II y III, nuestro poder y orgullo parece un poco como de David Brent.
Dicho esto, dado que mi perspectiva habitual es la de que la humanidad es una huérfana solitaria en una roca minúscula en medio de un universo desierto, la lección de humildad de que probablemente no seamos tan listos como creemos y la posibilidad de que mucho sobre lo que estamos seguros pueda estar equivocado, suena maravilloso. Deja la puerta abierta, aunque solo sea una rendija, a que tal vez, solo tal vez, puede que haya algo más de lo que nos damos cuenta.
Publica: emilio silvera