Feb
8
Objetos, moléculas, agregados, sustancias…Materia… Y,...
 por Emilio Silvera ~
por Emilio Silvera ~
 Clasificado en Tenemos que saber ~
Clasificado en Tenemos que saber ~
 Comments (1)
Comments (1)
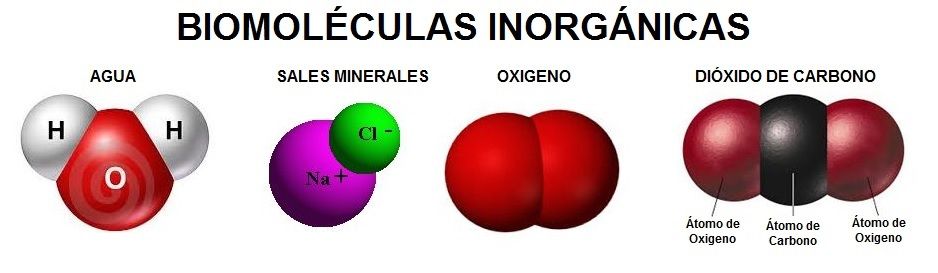
En los organismos se encuentran cuatro tipos diferentes de moléculas orgánicas en gran cantidad: carbohidratos, lípidos, proteínas y nucleótidos. Todas estas moléculas contienen carbono, hidrógeno y oxígeno. Además, las proteínas contienen nitrógeno y azufre, y los nucleótidos, así como algunos lípidos, contienen nitrógeno y fósforo. Se ha dicho que es suficiente reconocer cerca de 30 moléculas para tener un conocimiento que permita trabajar con la bioquímica de las células. Dos de esas moléculas son los azúcares glucosa y ribosa; otra, un lípido; otras veinte, los aminoácidos biológicamente importantes; y cinco las bases nitrogenadas, moléculas que contienen nitrógeno y son constituyentes claves de los nucleótidos. En esencia, la química de los organismos vivos es la química de los compuestos que contienen carbono o sea, los compuestos orgánicos.


Modelos de esferas y varillas y fórmulas estructurales del metano, etano y butano.
Las propiedades químicas específicas de una molécula orgánica derivan principalmente de los grupos de átomos conocidos como grupos funcionales. Estos grupos están unidos al esqueleto de carbono, reemplazando a uno o más de los hidrógenos que estarían presentes en un hidrocarburo.
La diversidad de especies expresa la riqueza ó el número de especies diferentes que están presentes en determinado ecosistema, región ó país. Esta riqueza ha sido estudiada tan solo en parte, y prueba de ello es que cada vez que hay un inventario en nuevas zonas se descubren nuevas especies.
La enorme variedad de formas, colores, comportamientos, etc que acompaña a los objetos, incluidos los vivientes, sería una consecuencia de la riqueza en la información que soportan las moléculas (y sus agregados) que forman parte de dichos objetos. Ello explicaría que las moléculas de la vida sean en general de grandes dimensiones (macromoléculas). La inmensa mayoría de ellas contiene carbono. Debido a su tetravalencia y a la gran capacidad que posee dicho átomo para unirse consigo mismo, dichas moléculas pueden considerarse como un esqueleto formado por cadenas de esos átomos.
Podemos encontrar numerosos tipos de silicio, ácido silícico, orto-silícico, dióxido de silicio, silicio coloidal, silanol, etc.
El carbono no es el único átomo con capacidad para formar los citados esqueletos. Próximos al carbono en la tabla periódica, el silicio, fósforo y boro comparten con dicho átomo esa característica, si bien en un grado mucho menor. Refiriéndonos al silicio, que para nosotros es el más importante, señalaremos que las “moléculas” que dicho átomo forma con el oxígeno y otros átomos, generalmente metálicos poseyendo gran nivel de información, difieren en varios aspectos de las moléculas orgánicas, es decir, de las que poseen un esqueleto de átomos de carbono.
Las propiedades químicas específicas de una molécula orgánica derivan principalmente de los grupos de átomos conocidos como grupos funcionales. Estos grupos están unidos al esqueleto de carbono, reemplazando a uno o más de los hidrógenos que estarían presentes en un hidrocarburo
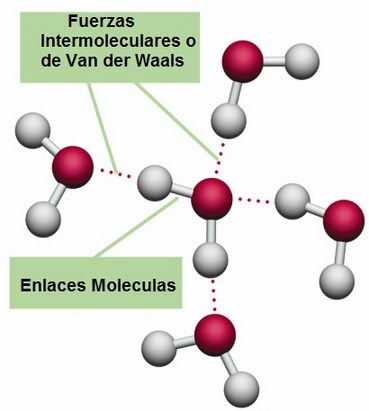
El mundo de los silicatos es de una gran diversidad, existiendo centenares de especies minerológicas. Esas diferencias se refieren fundamentalmente a que el enlace químico en el caso de las moléculas orgánicas es covalente, y cuando se forma la sustancia correspondiente (cuatrillones de moléculas) o es un líquido, como es el caso de los aceites, o bien un sólido que funde fácilmente. Entre las moléculas que lo forman se ejercen unas fuerzas, llamadas de Van der Waals, que pueden considerarse como residuales de las fuerzas electromagnéticas, algo más débiles que éstas. En cambio, en los silicatos sólidos (como en el caso del topacio) el enlace covalente o iónico no se limita a una molécula, sino que se extiende en el espacio ocupado por el sólido, resultando un entramado particularmente fuerte.

Hacen posible que el mosquito se pose sobre el agua
Al igual que para los cristales de hielo, en la mayoría de los silicatos la información que soportan es pequeña, aunque conviene matizar este punto. Para un cristal ideal así sería en efecto, pero ocurre que en la realidad el cristal ideal es una abstracción, ya que en el cristal real existen aquí y allá los llamados defectos puntuales que trastocan la periodicidad espacial propia de las redes ideales. Precisamente esos defectos puntuales podían proporcionar una mayor información.
Si prescindimos de las orgánicas, el resto de las moléculas que resultan de la combinación entre los diferentes átomos no llega a 100.000, frente a los varios millones de las primeras. Resulta razonable suponer que toda la enorme variedad de moléculas existentes, principalmente en los planetas rocosos, se haya formado por evolución de los átomos, como corresponde a un proceso evolutivo. La molécula poseería mayor orden que los átomos de donde procede, esto es, menor entropía. En su formación, el ambiente se habría desordenado al ganar entropía en una cierta cantidad tal, que arrojarse un balance total positivo.

No puedo dejar pasar la oportunidad, aunque sea de pasada, de mencionar las sustancias
Las sustancias pueden ser simples y compuestas, según que la molécula correspondiente tenga átomos iguales o diferentes. El de las primeras es enormemente inferior al de las segundas.
Las así llamadas, son cuerpos formados por moléculas idénticas, entre las cuales pueden o no existir enlaces químicos. Veremos varios ejemplos. Las sustancias como el oxígeno, cloro, metano, amoníaco, etc, se presentan en estado gaseoso en condiciones ordinarias de presión y temperatura. Para su confinamiento se embotellan, aunque existen casos en que se encuentran mezcladas en el aire (os podéis dar una vueltecita por el polo químico de Huelva).
Polo Químico de Huelva
En cualquier caso, un gas como los citados consiste en un enjambre de las moléculas correspondientes. Entre ellas no se ejercen fuerzas, salvo cuando colisionan, lo que hacen con una frecuencia que depende de la concentración, es decir, del número de ellas que están concentradas en la unidad de volumen; número que podemos calcular conociendo la presión y temperatura de la masa de gas confinada en un volumen conocido.
“La temperatura de un gas monoatómico es una medida relacionada con la energía cinética promedio de sus moléculas al moverse. En esta animación, la relación del tamaño de los átomos de helio respecto a su separación se conseguiría bajo una presión de 1950 atmósferas. Estos átomos a temperatura ambiente tienen una cierta velocidad media (aquí reducida dos billones de veces).”
¿Y la teoría cinética molecular? Si, también está presente en las nebulosas y actúa conforme a las temperaturas allí reinantes y a los vientos estelares emitidos por estrellas nuevas.
Decía que no existen fuerzas entre las moléculas de un gas. En realidad es más exacto que el valor de esas fuerzas es insignificante porque las fuerzas residuales de las electromagnéticas, a las que antes me referí, disminuyen más rápidamente con la distancia que las fuerzas de Coulomb; y esta distancia es ordinariamente de varios diámetros moleculares.
Podemos conseguir que la intensidad de esas fuerzas aumente tratando de disminuir la distancia media entre las moléculas. Esto se puede lograr haciendo descender la temperatura, aumentando la presión o ambas cosas. Alcanzada una determinada temperatura, las moléculas comienzan a sentir las fuerzas de Van der Waals y aparece el estado líquido; si se sigue enfriando aparece el sólido. El orden crece desde el gas al líquido, siendo el sólido el más ordenado. Se trata de una red tridimensional en la que los nudos o vértices del entramado están ocupados por moléculas.
Todas las sustancias conocidas pueden presentarse en cualquiera de los tres estados de la materia (estados ordinarios y cotidianos en nuestras vidas del día a día).
Si las temperaturas reinantes, como decíamos en páginas anteriores, es de miles de millones de grados, el estado de la materia es el plasma, el material más común del universo, el de las estrellas (aparte de la materia oscura, que no sabemos ni lo que es, ni donde está, ni que “estado” es el suyo).
En condiciones ordinarias de presión, la temperatura por debajo de la cual existe el líquido y/o sólido depende del tipo de sustancia. Se denomina temperatura de ebullición o fusión la que corresponde a los sucesivos equilibrios (a presión dada) de fases: vapor ↔ líquido ↔ sólido. Estas temperaturas son muy variadas, por ejemplo, para los gases nobles son muy bajas; también para el oxígeno (O2) e hidrógeno (H2). En cambio, la mayoría de las sustancias son sólidos en condiciones ordinarias (grasas, ceras, etc).
Las sustancias pueden ser simples y compuestas, según que la molécula correspondiente tenga átomos iguales o diferentes. El número de las primeras es enormemente inferior al de las segundas.
El concepto de molécula, como individuo físico y químico, pierde su significado en ciertas sustancias que no hemos considerado aún. Entre ellas figuran las llamadas sales, el paradigma de las cuales es la sal de cocina. Se trata de cloruro de sodio, por lo que cualquier estudiante de E.G.B. escribiría sin titubear su fórmula: Cl Na. Sin embargo, le podríamos poner en un aprieto si le preguntásemos dónde se puede encontrar aisladamente individuos moleculares que respondan a esa composición. Le podemos orientar diciéndole que en el gas Cl H o en el vapor de agua existen moléculas como individualidades. En realidad y salvo casos especiales, por ejemplo, a temperaturas elevadas, no existen moléculas aisladas de sal, sino una especie de molécula gigante que se extiende por todo el cristal. Este edificio de cristal de sal consiste en una red o entramado, como un tablero de ajedrez de tres dimensiones, en cuyos nudos o vértices se encuentran, alternativamente, las constituyentes, que no son los átomos de Cl y Na sino los iones Cl– y Na+. El primero es un átomo de Cl que ha ganado un electrón, completándose todos los orbitales de valencia; el segundo, un átomo de Na que ha perdido el electrón del orbital s.

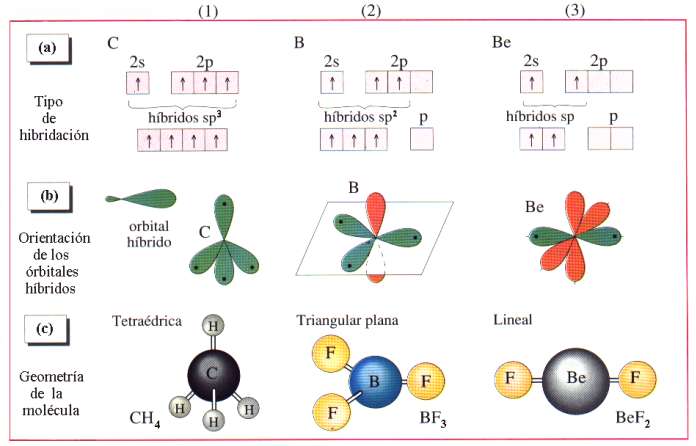
Cuando los átomos de Cl y Na interaccionan por aproximarse suficientemente sus nubes electrónicas, existe un reajuste de cargas, porque el núcleo de Cl atrae con más fuerza los electrones que el de Na, así uno pierde un electrón que gana el otro. El resultado es que la colectividad de átomos se transforma en colectividad de iones, positivos los de Na y negativos los de Cl. Las fuerzas electromagnéticas entre esos iones determinan su ordenación en un cristal, el Cl Na. Por consiguiente, en los nudos de la red existen, de manera alternativa, iones de Na e iones de Cl, resultando una red mucho más fuerte que en el caso de que las fuerzas actuantes fueran de Van der Waals. Por ello, las sales poseen puntos de fusión elevados en relación con los de las redes moleculares.
Hablando de átomos y moléculas estamos hablando de ese “universo” de lo muy pequeño”, ese lugar que estando en nuestro “mundo” parece que está en otro, toda vez que, su infinitesimales medidas, no hacen posible que el ojo lo pueda contemplar a simple vista y, para saber que están ahí, nos valemos de experimentos de altas energías en aceleradores de partículas.

El mundo de lo muy pequeño (el micro espacio), a nivel atómico y subatómico, es el dominio de la física cuántica, así nunca podríamos saber, de acuerdo m con el principio de incertidumbre, y, en un momento determinado, la posición y el estado de una partícula. Este estado podría ser una función de la escala espacio-temporal. A esta escala tamaños todo sucede demasiado deprisa para nosotros.
El “universo cuántico” nada es lo que parece a primera vista, allí entramos en otro mundo que en nada, se parece al nuestro
Cuando hablamos de la mecánica cuántica, tenemos mirar un poco hacia atrás en el tiempo y podremos darnos del gran impacto que tuvo en el devenir del mundo desde que, en nuestras vidas, apareció el átomo y, más tarde, sus contenidos. Los nombres de Planck, Einstein, Bohr, Heisenberg, Schrödinger, Pauli, Bardeen, Roentgen, Dirac y muchos otros, se pudieron a la cabeza de la lista de las personas más famosas. Aquel primer premio Nobel de Física otorgado en 1900 a Roentgen por descubrir los rayos X, en el mismo año llegaría el ¡cuanto! De Planck que inspiró a Einstein para su trabajo sobre el Efecto fotoeléctrico que también, le valdría el Nobel, y, a partir de ese momento, se desencadenó una especie de alucinante por saber sobre el átomo, sus contenidos, y, de qué estaba hecha la materia.
La conocida como Paradoja EPR y los conceptos de Tiempo y , presente, pasado y futuro
Fueron muchas las polémicas desatadas a cuenta de las aparentes incongruencias de la moderna Mecánica Cuántica. La paradoja de Einstein-Podolsky-Rosen, denominada “Paradoja EPR”, trata de un experimento mental propuesto por Albert Einstein, Boris Podolsky y Nathan Rosen en 1935. Es relevante, pues pone de manifiesto un problema aparente de la mecánica cuántica, y en las décadas siguientes se dedicaron múltiples esfuerzos a desarrollarla y resolverla.

“El entrelazamiento cuántico (Quantenverschränkung, originariamente en alemán) es una propiedad predicha en 1935 por Einstein, Podolsky y Rosen (EPR) en su formulación de la llamada paradoja EPR.
El término fue introducido en 1935 por Erwin Schrödinger para describir un fenómeno de mecánica cuántica que se demuestra en los experimentos, cuya relevancia para la física teórica no fue bien comprendido inicialmente. Un conjunto de partículas entrelazadas (en su término técnico en inglés: entangled) no pueden definirse como partículas individuales con estados definidos, sino como un sistema con una función de onda única para todo el sistema.”
A Einstein (y a muchos otros científicos), la idea del entrelazamiento cuántico le resultaba extremadamente perturbadora. Esta particular característica de la mecánica cuántica permite preparar estados de dos o más partículas en los cuales es imposible obtener útil sobre el estado total del sistema haciendo sólo mediciones sobre una de las partículas.
Por otro lado, en un entrelazado, manipulando una de las partículas, se puede modificar el estado total. Es decir, operando sobre una de las partículas se puede modificar el estado de la otra a distancia de manera instantánea. Esto habla de una correlación entre las dos partículas que no tiene paralaje en el mundo de nuestras experiencias cotidianas. Cabe enfatizar pues que cuando se mide el estado de una partícula, enseguida sabemos el estado de la otra, lo cual aparentemente es instantáneo, es decir, sin importar las distancias a las que se encuentren las partículas, una de la otra, ambas saben instantáneamente el estado de la otra.
El experimento planteado por EPR consiste en dos partículas que interactuaron en el pasado y que quedan en un estado entrelazado. Dos observadores reciben cada una de las partículas. Si un observador mide el momento de una de ellas, sabe cuál es el momento de la otra. Si mide la posición, gracias al entrelazamiento cuántico y al principio de incertidumbre, puede la posición de la otra partícula de forma instantánea, lo que contradice el sentido común.
Animación que muestra dos átomos de oxígeno fusionándose para formar una molécula de O2 en su estado cuántico fundamental. Las nubes de color representan los orbitales atómicos. Los orbitales 2s y 2p de cada átomo se combinan para formar los orbitales σ y π de la molécula, que la mantienen unida. Los orbitales 1s, más interiores, no se combinan y permiten distinguir a cada núcleo. Lo que ocurre a escalas tan pequeñas es fascinante.
Si nos pudiéramos convertir en electrones, por ejemplo, sabríamos dónde y cómo estamos en cada momento y podríamos ver asombrados, todo lo que estaba ocurriendo a nuestro alrededor que, entonces sí, veríamos transcurrir a un ritmo más lento del que podemos detectar en los electrones desde nuestro macroestado espacio temporal. El electrón, bajo nuestro punto de vista se mueve alrededor del núcleo atómico a una velocidad de 7 millones de km/h.
A medida que se asciende en la escala de tamaños, hasta el tiempo se va ajustando a esta escala, los objetos, a medida que se hacen mayores se mueven más despacio y, además, tienen más duración que los pequeños objetos infinitesimales del micro mundo cuántico. La vida media de un neutrón es de unos 15 minutos, por ejemplo, mientras que la vida media de una estrellas se puede contar en miles de millones de años.
El Sistema solar, ahora mismo, está viajando a unos 600 kilómetros por segundo por toda la inmensidad del Universo. También en el micro-cosmos de las partículas los objetos se mueven a otras velocidades muy distintas a las nuestras en el planeta Tierra.
En nuestra macro-escala, los acontecimientos y ,los objetos se mueven a velocidades que a nosotros nos parecen normales. Si se mueven con demasiada lentitud nos parece que no se mueven. Así hablamos de escala de tiempo geológico, para referirnos al tiempo y velocidad de la mayor parte de los acontecimientos geológicos que afectan a la Tierra, el tiempo transcurre aquí en millones de años y nosotros ni lo apreciamos; nos parece que todo está inmóvil. Nosotros, los humanos, funcionamos en la escala de años (tiempo biológico).

El Tiempo Cosmológico es aún mucho más dilatado y los objetos cósmicos (mundos, estrellas y galaxias), tienen una mayor duración aunque su movimiento puede ser muy rápido debido a la inmensidad del espacio universal en el que se mueven. La Tierra, por ejemplo, orbita alrededor del Sol a una velocidad media de 30 Km/s., y, el Sol, se desplaza por la Galaxia a una velocidad de 270 km/s. Y, además, se puede incrementar el tiempo y el espacio en su andadura al estar inmersos y ligados en una misma maya elástica.
Así, el espacio dentro de un átomo, es muy pequeño; dentro de una célula, es algo mayor; dentro de un animal, mayor aún y así sucesivamente… hasta llegar a los enormes espaciosa que separan las estrellas y las galaxias en el Universo.

Distancias astronómicas separan a las estrellas entre sí, a las galaxias dentro del cúmulo, y a los cúmulos en los supercúmulos.
Las distancias que separan a los objetos del Cosmos se tienen que medir con unidades espaciales, tal es su inmensa magnitud que, nuestras mentes, aunque podamos hablar de ellas de manera cotidiana, en realidad, no han llegado a asimilarlas.Y, a todo ésto, los físicos han intentado con denuedo elaborar una teoría completa de la gravedad que incluya la mecánica cuántica. Los cálculos de la mayoría de las teorías propuesta de la «gravedad cuántica» arrojan numerosos infinitos. Los físicos no están seguros si el problema es técnico o conceptual. No obstante, incluso prescindiendo de una teoría completa de gravedad cuántica, se puede deducir que los efectos de la teoría cuántica, habrían cruciales durante los primeros 10-43 segundos del inicio del universo, cuando éste tenía una densidad de 1093 gramos por centímetro cúbico y mayor.
(El plomo sólido tiene una densidad de aproximadamente diez gramos por centímetro cúbico.) Este período, que es el que corresponde a la era de Planck, y a su estudio se le llama cosmología cuántica. Como el universo en su totalidad habría estado sujeto a grandes incertidumbres y fluctuaciones durante la era de Planck o era cuántica, con la materia y la energía apareciendo y desapareciendo de un vacío en grandes cantidades, el concepto de un principio del universo podría no tener un significado bien definido. En todo caso, la densidad del universo durante este período es de tal magnitud que escapa a nuestra comprensión. Para propósitos prácticos, la era cuántica podría considerarse el estado inicial, o principio, del universo. En consecuencia, los procesos cuánticos ocurridos durante este período, cualquiera sea su naturaleza, determinaron las iniciales del universo.
Una cosa nos ha podido quedar clara: Los científicos para lograr conocer la estructura del universo a su escala más grande, deben retroceder en el tiempo, centrando sus teorías en el momento en que todo comenzó. Para ello, como todos sabeis, se han formulado distintas teorías unificadoras de las cuatro fuerzas de la naturaleza, con las cuales se han modelado acontecimiento y en el universo primitivo casi a todo lo largo del camino hasta el principio. Pero cómo se supone que debió haber habido un «antes», aparece una barrera que impide ir más allá de una frontera que se halla fijada a los 10-43 [s] después del Big Bang, un instante conocido como «momento de Planck», en homenaje al físico alemán Max Planck.


La Era de Planck es un viaje del James West al límite de lo que podemos alcanzar, ya que, en ese punto, aún los fotones estaban confinados y no se había hecho la luz, por lo que ningún telescopio puede llegar más allá, no hay luz que le transporte la imagen hacia sus espejos.
Esta barrera existe debido a que antes del momento de Planck, durante el período llamado la «era de Planck o cuántica», se supone que las cuatro fuerza fundamentales conocidas de la naturaleza eran indistinguibles o se hallaban unificadas , que era una sola fuerza. Aunque los físicos han diseñado teorías cuánticas que unen tres de las fuerzas, una por una, a través de eras que se remontan al momento de Planck, hasta ahora les ha prácticamente imposible armonizar las leyes de la teoría cuántica con la gravedad de la relatividad de Einstein, en un sólo modelo teórico ampliamente convincente y con posibilidades claras de ser contrastado en experimentos de laboratorio y, mucho menos, con observaciones.
Y después de todo esto, sólo una caso me queda clara: ¡Lo poco que sabemos! A pesar de la mucha imaginación que ponemos en las cosas que creemos conocer.
Emilio Silvera Vázquez
















 Totales: 73.291.078
Totales: 73.291.078 Conectados: 31
Conectados: 31










































el 31 de octubre del 2018 a las 8:15
Como nadie puede saberlo todo sobre todas las cosas, cada cual se especializa en un campo determinado que, por lo general, es la profesión que ejerce y con la que se suele ganar la vida. Existen personas estudiosas y muy laboriosas que, llevados por su afan de saber, han tocado campos diversos y casi siempre relacionados, y, con ello, han obtenido una amplia cultura en disciplinas diferentes.
Los campos del saber humano son muy amplios y abarcan todos los conocimientos que hemos podido ir atesorando desde que, en la ciudad de Uruk, en Mesopotamia, los sumerios inventaron la rueda, emplearon el arco en la construcción, descubrieron el sistema sexagesimal, utilizaron la agricultura para generar alimentos y la alfarería para construir utensilios de barro… Desde entonces, nuestra especie ha recorrido un largo camino hasta las fuentes del saber de todas las disciplinas que hoy dominamos y que son las que rigen nuestras vidas.
Aparte de las matemáticas que en el árbol de las ramas de la Ciencia vienen a ser las raíces que posibilitan el crecimiento, están la química (entre otras muchas) que, es una de las disciplinas más importantes y que, directamente relacionado con la biología y con la vida, tiene mucho que decir de nuestra presencia en este mundo.
Aunque seámos aficionado a unas determinadas materias, como en este caso, a la Astronomía y la Física, no por ello debemos dejar de lado otras ramas del saber y, de vez en cuando, nos podemos dar una vuelta por esos lugares y “ver” lo que allí se está cociendo, estar al día, saber de que va el tema, y, las ramificaciones que tiene con todo lo demás.
En las escuelas, debería ser obligatorio que todos los niños y niñas tuvieran una idea básica de todas las ramas del saber, al menos de las más importantes para nosotros y, con ello, adquirirían una vasta cultura que les daría la opción de no estar callados en reuniones donde se tocaran esos temas que (lástima), por lo general, casi todos desconocen.
Es la peor de las miserias: La falta de conocimiento.
De hecho, cuando no se tiene, te lleva directamente a ella.
Preparemos a los niños de hoy para evitar a los hombres ignorantes del mañana.